Introducción
La zona sur de Costa Rica o Región Brunca, de acuerdo con la división socioeconómica del Ministerio de Planificación, está constituida por cinco cantones; uno de los cuales es Osa. A su vez, este último se integra por los distritos: Palmar, Sierpe, Bahía Drake, Piedras Blancas, Puerto Cortés y Bahía Ballena (Alvarado, 2003).
Según la clasificación de la fauna íctica de Costa Rica (Bussing, 1993; 2002), la zona sur se encuentra en la provincia ístmica; o, con base en la clasificación ictiobiogeográfica de Abell et al. (2008), se ubica en la ecorregión Chiriquí, en la cual se pueden encontrar sensu stricto hasta 41 especies de peces incluidas en 15 familias (Bussing, 2002), riqueza que debe considerarse más un patrón regional sin interés comparativo.
En Costa Rica, se han registrado 250 especies de peces de agua dulce (135 primarias y secundarias); de las cuales, 24 han sido consideradas endémicas (9,6%). De estas 24 especies endémicas, 13 están distribuidas naturalmente en la zona sur, registradas hasta el momento en el Río Grande de Térraba y en varios ríos de la península de Osa (Bussing, 2002; Obando, 2002; SINAC, 2007; Angulo, Garita-Alvarado, Bussing y López, 2013).
Estudios pioneros sobre los peces de esta región del país fueron realizados por Bussing (1974 a, b), en los cuales se incluye la descripción de nuevas especies para Costa Rica; sin embargo, no se contemplaron aspectos relacionados con la estructura de poblaciones ni con su abundancia. Más adelante y debido a un fuerte impacto ambiental causado por buscadores de oro en la península de Osa, tanto Constantz, Bussing y Saul (1981) como Winemiller (1983) investigaron la composición de la ictiofauna y su grado de resiliencia a estas perturbaciones; particularmente, en el Parque Nacional Corcovado.
Otras importantes investigaciones en esta región, en el delta del Humedal Nacional Térraba-Sierpe ‒el cual abarca cerca de 50% del área cubierta por manglar del país (Kapelle, Castro, Acevedo, González y Monge, 2002)‒ incluyen las de Chicas (2001) y Rojas y Rodríguez (2008), quienes han determinado la importancia de estos ecosistemas costeros en el mantenimiento de poblaciones de peces; en especial, la función ecológica como zonas de crianza, de reproducción y de maduración, no solo para especies de agua dulce, sino también marinas periféricas.
Muchos impactos antrópicos han afectado de forma negativa los ecosistemas lénticos y lóticos en Costa Rica, sin que hasta la fecha se hayan estudiado a profundidad sus efectos sobre las comunidades faunísticas que allí se encuentran. Las actividades humanas que mayor daño causan a los ecosistemas acuáticos son las agrícolas, la extracción descontrolada de recursos biológicos, la sedimentación, los agroquímicos, el desvío de cauces, la extracción de materiales o concesiones mineras, la desecación de humedales y hasta la contaminación por descarga de aguas negras de los grandes centros poblacionales o urbanos (SINAC, 2007).
Los ríos de la zona sur de Costa Rica se consideran ecosistemas complejos, con grupos faunísticos inexplorados, particularmente, macroinvertebrados bentónicos, donde las comunidades de peces de agua dulce son bien conocidas; no obstante, aún falta investigación sobre el comportamiento de las poblaciones dulceacuícolas y estuarinas (Rojas y Rodríguez, 2008). El objetivo de la presente investigación fue determinar la composición y la estructura taxonómica en peces de agua dulce de ríos cercanos a la costa en el Pacífico Sur de Costa Rica; en particular, en los distritos de Bahía Ballena y Puerto Cortés.
Metodología
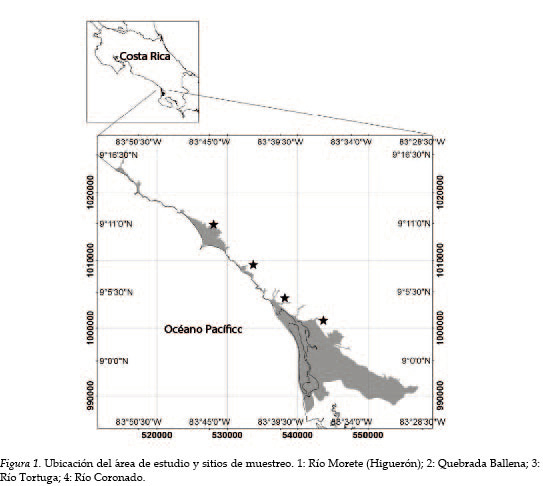
La investigación se desarrolló en la zona costera de los distritos Bahía Ballena y Puerto Cortés hasta el pie de monte, definido en la costa 20 m s. n. m., para un área de estudio total de 12 223,10 hectáreas, entre los 9°16´00´´ N, 83°50´00´´ W y los 8°7´00´´ N, 83°28´00´´ W.
Se establecieron cuatro estaciones de muestreo: Río Morete (Higuerón), Quebrada Ballena, Río Tortuga y Río Coronado, distribuidas cada 10 km aproximadamente. Los muestreos se realizaron, de forma bimensual, entre junio 2017 y abril de 2018, visitando los sitios aleatoriamente con luz del día. En cada sitio, se efectuaron capturas de peces a partir de la pesca eléctrica (Cowx, 1990; Persat y Copp, 1990), con un equipo Samus, modelo 725G configurado para descargar 150-200 W (cerca de 400 voltios), 99 Hz.
Los muestreos se efectuaron en un transecto de aproximadamente 50 m y con una frecuencia de una descarga cada 10 m. Considerando que cada sitio se visitó en 6 ocasiones, se tuvo un esfuerzo de muestreo de 0,3 km por sitio. Se abarcaron diferentes ambientes (remansos, pozas, fondos arenosos, rocosos o arenoso-rocoso o ambientes dominados por lirios o matorrales en las orillas del cauce), según los criterios y las sugerencias de Bain y Finn (1991), Fièvet, Bonnet-Arnaud y Mallet (1999), Protti, Sáenz, Guevara y Herrera (2005a, 2005b, 2007).
Todos los peces afectados por las descargas eléctricas en cada estación de muestreo fueron recolectados. Para ello, se utilizó una red monofilamento tipo chinchorro de 2,5 x 1,5 m y 1,1 cm de luz de malla adherida al aro cátodo del equipo. Todos los muestreos con este arte se ejecutarán, a menos de 1 m de profundidad. De acuerdo con García de Jalón (1997), se aplicó una descarga adicional en aquellos casos en los que no se constató satisfactoriamente la efectividad de la descarga eléctrica durante el muestreo.
La determinación taxonómica se realizó in situ en el nivel taxonómico específico mediante las claves y descripciones de Bussing (2002). La adscripción taxonómica nomenclatural sigue los criterios de Fricke, Eschmeyer y Van Der Laan (2019). Para la evaluación de la estructura y la composición taxonómica en los s y quebradas seleccionadas, se determinaron algunos datos estadísticos básicos, como la riqueza, la abundancia y la distribución de especies, y se determinó su diversidad (sensu lato). Para las comparaciones en la riqueza y abundancia entre sitios y periodo de muestreo, se utilizó un análisis de varianza (ANOVA) no paramétrico Kruskall-Wallis con contrastes como prueba post hoc (Zar 2010).
Riqueza
Representada por la cantidad total de las especies (total de taxones) colectadas por sitios de muestreo.
Con base en el registro total de taxones, se definió el número total de las especies dominantes (de importancia numérica), lo cual se estimó a partir de las especies que aportan más de 80 % de la abundancia total de captura por sitio de muestreo (Ayala-Pérez, Avilés-Alatriste y Rojas-Galaviz, 1998).
Abundancia relativa
Esta se obtiene desde la relación entre los individuos totales colectados por especie, ya sea por sitio o por mes, respecto a la totalidad de muestreos realizados estandarizando y homogeneizando el esfuerzo de muestreo en 0,3 km por sitio.
Distribución
La distribución espaciotemporal de las especies se determinó con ayuda de la diversidad Beta, que se obtiene mediante el índice de reemplazo de Bray-Curtis según los criterios de Magurran (1988), Henderson y Seaby (2006) y Moreno (2001), cuyo algoritmo de cálculo se fundamenta en la proporción del número promedio de especies en todas las muestras entre el número de especies registradas en un conjunto de muestras. Estos valores se utilizaron para estimar diferencias espaciales y la composición íctica por sitios.
Las asociaciones espaciotemporales se obtuvieron mediante un análisis multivariado de conglomerados, las cuales se graficaron en un dendrograma, según el criterio de encadenamiento simple establecido por Sorensen en 1948 (citado por Balzarini et al. 2017).
En este método, la distancia entre dos conglomerados está definida por la del par de objetos más distantes, que se obtuvo tomando el coeficiente de correlación cofenética mayor, de acuerdo con Fowler, Cohen y Jarvis (1998) y Balzarini et al. (2017).
Diversidad
La diversidad de peces ( o diversidad alfa por ser exclusiva de un sitio particular de muestreo) se estableció mediante dos índices ecológicos de uso popular en este tipo de investigación cuantitativa: el de proporcionalidad Shannon-Wiener (H’ = –∑pi ln pi) y el de dominancia mediante el recíproco Berguer-Parker (1/d: d = Nmax/N), según los criterios de Magurran (1988), Henderson y Seaby (2006) y Moreno (2001).
Resultados
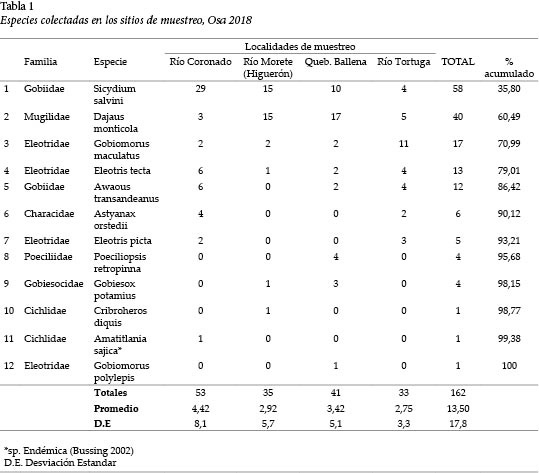
Se colectaron un total de 162 individuos, que representaron 12 especies y 7 familias. El Río Coronado registró la mayor cantidad con 53., seguido de la Quebrada Ballena con 41.
La especie Gobiomorus polylepis corresponde con un nuevo registro para la zona sur de Costa Rica (Figuras 2 y 3).

Riqueza
Del total de especies (n = 12), 5 (S. salvini, D. montícola, G. maculatus, E. tecta y A. transandeanus) fueron dominantes. Representaron 86,42% de la abundancia total (Tabla 1).
La riqueza ictiológica en el área de estudio osciló entre 6 (Morete) y 8 (Coronado) especies. De acuerdo con la prueba de Kruskal-Wallis (H = 1,72; g.l. = 3; p = 0,59), no hay diferencias significativas (Figura 4).
El mes que registró menos especies fue julio con 3; mientras que diciembre el mayor número, con 8 (Kruskall-Wallis H = 4,71; g.l. = 5; p = 0,39) (Figura 5).


Distribución
El reemplazo de especies entre sitios puede considerarse alto. Se registró la compartición en los ensamblajes taxonómicos entre sitios en76,31% (queb. Ballena y Río Morete) –estos dos sitios los más similares‒ y 35,29% (Río Morete y Río Tortuga), los cuales son de mayor reemplazo de especies, pues comparten la menor cantidad (Figura 6).

Abundancia relativa
La mayor cantidad de individuos se colectaron en el Río Coronado (n = 53); luego sigue la Quebrada Ballena (n = 41), el Río Morete o Higuerón (n = 35); mientras que el menor número de individuos se registró en el Río Tortuga (n = 33) (Fig.4). Tales diferencias no son estadísticamente significativas (Kruskall-Wallis H = 0,13; g.l. = 3; p = 0,98).
Julio fue el mes con menos capturas (n = 8), mientras que, al siguiente muestreo en agosto, se registró la mayor cantidad de individuos colectados (n = 37) (Fig. 5) (Kruskall-Wallis H = 4,76; g.l. = 5; p = 0,43).
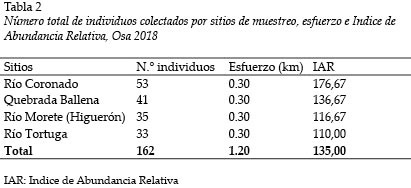
Se recorrió 0,3 km en total para cada uno de los cuatro sitios muestreados, para un total de 1,20 km. Esto sugiere un índice de abundancia relativa (IAR) promedio de 135 ind/km. El Río Coronado es el sitio con mayor abundancia relativa con 176,67 ind/km (Tabla 2).
Diversidad
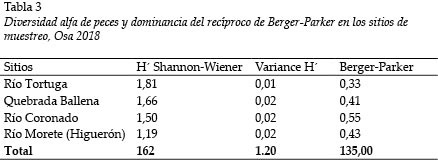
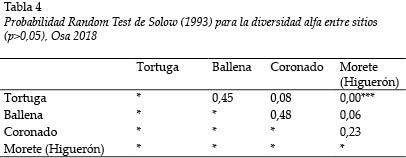
El índice de diversidad de Shannon-Wiener es bajo en general. Los valores más altos fueron detectados en el Río Tortuga (H´ = 1,81); y el más bajo, en el Río Morete (H´ = 1,19); de manera inversa, la mayor dominancia se registró en el Río Tortuga (0,33) (Tabla 3). Se estimaron diferencias estadísticamente significativas entre la diversidad de los Ríos Morete (Higuerón) y Tortuga (Tabla 4).
Discusión
Riqueza y abundancia
Ángulo, Garita-Alvarado, Bussing y López (2013) consideran que la riqueza de peces de agua dulce en Costa Rica es de 250 especies; de las cuales, 135 especies son primarias y secundarias (Bussing 2002). De estas, solo en el delta del Térraba-Sierpe, podrían registrarse hasta 80 especies.
Así pues, la composición de los peces de agua dulce que drena la zona costera del Sur de Costa Rica es baja (12 especies) y representa 8,9 % del total de especies primarias y secundarias registrado para el país (Bussing 2002). Una reciente alteración de los cauces en estos ríos, debido a eventos estocásticos naturales como las depresiones tropicales Otto y Nate, podrían ser las causantes de la baja riqueza y abundancia. Entre los registros, destaca el nuevo de G. polylepis.
De acuerdo con Bussing (2002), esta especie de eleótrido habita la vertiente pacífica de México y tuvo su primer registro para Costa Rica en el año 1998 (año de la primera impresión de la obra). Se colectó en Playa Naranjo, en el Parque Nacional Santa Rosa, y en la zona de Herradura y Bejuco, en el pacífico central. En el resto de Centroamérica, se considera escaza.
El presente registro de G. polylepis confirma la presencia de la especie en Costa Rica y su primer registro para la zona sur; particularmente, en la Quebrada Ballena, tributaria del Parque Nacional Marino Ballena.
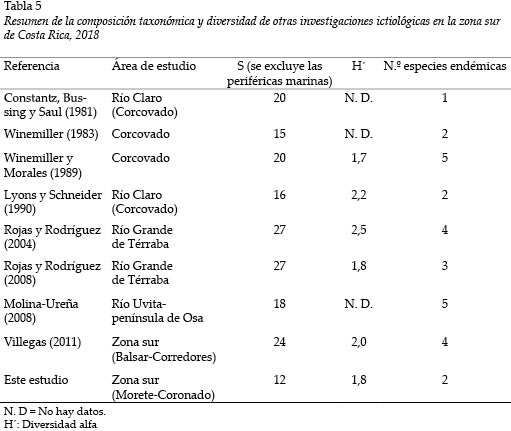
La limitada riqueza de especies de peces de agua dulce reportados durante la presente no difiere, en gran medida, de otros reportes para la zona sur del país en términos cuantitativos (Tabla 5).
La región del Río Grande de Térraba se ubica en la provincia íctica ístmica, la cual, en términos comparativos, según Alpírez (1985) y Bussing (2002) posee una riqueza y diversidad de peces de agua dulce intermedia respecto a otros ríos de Puntarenas y de Guanacaste ubicados en otra provincia íctica, la Chiapas-nicaragüense. Por su parte, Rojas y Rodríguez (2008) plantean que la región del Térraba es más rica en especies dulceacuícolas que la zona norte de Costa Rica (provincia íctica San Juan).
En la presente investigación, las especies con mayor importancia numérica fueron particularmente dulceacuícolas secundarias, como los góbidos y eleótridos. Similar registro obtuvo Villegas (2011) con el eleótrido Dormitator latifrons en afluentes del Río Grande de Térraba en la comunidad de Puerto Cortés de Osa, lo cual sugiere la gran influencia territorial que ejerce este sistema deltaico estuarino-rivereño.
Fièvet, Dolédec y Lim (2001), en las Antillas Menores, capturaron gran cantidad de una especie de Gobiomorus en ecosistemas costeros, con mucha influencia marina, dado el limitado territorio de algunas de las islas. Esto sugiere la gran dominancia de los eleótridos en ambientes estuarinos.
En la Península de Osa, Winemiller y Morales (1989) reconocieron la abundancia de Astyanax fasciatus (= A. orstedii), Poeciliopsis turrubarensis y Brachyrhaphis rhabdophora; mientras que Lyons y Schneider (1990) registraron como especies dulceacuícolas comunes a A. fasciatus (= A. orstedii), B. rhabdophora y Gobiesox potamius. Estos registros, complementados con la presente investigación, evidencian la diversidad de especies según sus distintos ambientes de colecta, donde en zonas de montaña, con ríos sin influencia marina, dominan las especies primarias, pero en lugares cercanos a la costa con influencia marina, predominan especies secundarias.
Por su parte, Barbee (2002), en el Pacífico Central de Costa Rica, sí reportó dominancia y gran abundancia de especies de góbidos y eleótridos, en el Río Tarcolitos de Quebrada Ganado Garabito, donde las especies dominantes fueron S. salvini, G. maculatus, G. polylepis, E. picta, A. banana (= A. transandeanus), G. potamius y D. montícola, coincidente con la presente.
En concordancia con la presente investigación, se tiene que las variaciones de la abundancia y distribución de especies estuarinas corresponden más a condiciones cíclicas de comportamientos migratorios que se ofrecen en las distintas etapas de desarrollo de los peces, los cuales utilizan agua dulce o salobre, dependiendo de su edad y requerimientos nutricionales (Arceo-Carranza y Vega-Cendejas, 2009), lo cual puede explicar la dominancia de los góbidos y eleótridos. Esto no queda claro, ya que los autores pudieron detectarlo, dado que efectuaron muestreos bimensuales. Entonces, se espera que haya diferencias temporales; no obstante, ese tipo de información no se presenta.
Distribución
Se registró una marcada influencia de las especies estuarinas en los sitios de muestreo, las cuales se distribuyeron, de manera bastante homogénea entre los sitios; sin embargo, se registró un elevado reemplazo de especies entre sitios, lo cual podría ser sugerido por las capturas esporádicas de P. retropinna, C. diquis, A. sajica y G. polylepis.
Tanto C. diquis como G. polylepis, dada su baja captura, confirman que son especies raras y que su registro es esporádico; también, influye en los análisis de distribución en estos ríos evaluados (Bussing, 2002; Rojas y Rodríguez, 2008).
Los resultados son dominados por especies secundarias, cuyo origen es marino, pero hay especies que invadieron los ambientes dulceacuícolas, como en los eleótridos G. maculatus, E. tecta y E. picta.
Según McKaye, Weiland y Lim (1979), el ciclo de vida de G. maculatus se completa totalmente en agua dulce; no obstante, las crías de dicha especie son abundantes cerca de las costas (Bussing, 2002). Eso coincide con esta investigación, en la cual las tallas registradas para tal especie son pequeñas; además, que los sitios de muestreo se ubicaron en zonas estuarinas cercanas a la desembocadura de los rios.
En el caso del género Eleotris, y acorde con los resultados de Chinchilla, Protti y Cabrera (2002), la relativa facilidad de captura de E. tecta y E. picta, se sugiere, posiblemente, a la ubicación de los sitios de muestreo más o menos cercanos a las desembocaduras de los sistemas ribereños; sobre todo, los ríos Tortuga y Coronado, muy influenciados por el delta del Térraba-Sierpe.
De acuerdo con Bussing (2002), ambas especies son simpátricas, aunque no sintópicas, condición reafirmada con los resultados del presente estudio. Asimismo, se sugiere que E. picta es una especie más cercana a la desembocadura de los ríos, con mayor influencia marina. No así, E. tecta, la cual suele colectarse en sitios de muestreo más alejados del mar, aun en sistemas deltaicos, como el Río Grande de Térraba (Rojas y Rodríguez, 2004).
S. salvini y A. transandeanus son las únicas especies de góbidos secundarios dulceacuícolas registrados, que habitan ambientes cercanos a las costas (Bussing 2002), cuya captura abunda en todos los ríos, excepto en el Río Morete (Higuerón). Así se confirma que estos tres ríos presentan tal influencia y que el Morete fue el más diferente (Tabla 4), donde se hallaron las especies con capturas esporádicas las que definieron las asociaciones Bray-Curtis.
Diversidad
Los valores del índice de diversidad indican una escasa riqueza y reflejan la dominancia de algunas especies secundarias. Por lo tanto, la tendencia hacia valores de diversidad (H´) entre 1,19 a 2 bit coinciden con estudios previos en esta misma zona de Costa Rica: Winemiller y Morales (1989) y Lyons y Schneider (1990) indican que la diversidad fluctuó entre 1,7 y 2,2, en ríos del Parque Nacional Corcovado; Rojas y Rodríguez (2004, 2008) reportan datos de 1,8 y 2,5 para el Río Grande de Térraba, en condiciones de influencia marina dada la cercanía a las respectivas desembocaduras de los ríos. Considerando estos registros de diversidad similares, se sugiere una alta dominancia de especies secundarias en la región.
Con excepción de la diferencia estadísticamente significativa que mostró el Río Morete, los otros tres ríos reflejan tal condición de la ictiodiversidad influenciada por la desembocadura. El Río Morete es un río en el cual dicha influencia es menos perceptible y cuya ubicación del sitio de muestreo estuvo ligeramente más alejado de la desembocadura; por consiguiente, se registró especies dependientes de ambientes más rocosos o con corrientes con mayores velocidades y más dulceacuícolas como C. diquis y G. potamius.
Los fenómenos naturales (ciclones, huracanes, deslaves, entre otros) producen efectos estocásticos sobre las poblaciones faunísticas, y afectan los ensamblajes taxonómicos, de manera que generan patrones adaptativos cíclicos anualmente en las especies involucradas (Strange, Moyle y Foin, 1992); por lo tanto, no es extraño que luego de un fuerte evento de este tipo sean menores las capturas de muchas especies.
Durante los muestreos, no se presentaron condiciones climáticas extremas, como fuertes lluvias o cambios notables de los caudales de los cuatro ríos evaluados, aunque la zona fue afectada en noviembre 2016 por el huracán Otto; y, en octubre 2017, por la tormenta tropical Nate, por eso, no se descarta que los cambios en los ensamblajes taxonómicos registrados o en la ictiodiversidad no tengan alguna influencia de efectos estocásticos asociados a dichas condiciones.
En otros estudios en Costa Rica y Panamá, los investigadores sugirieron este tipo de afectaciones en la diversidad, como Winemiller (1993) en Tortuguero en la vertiente caribe donde se evalúo la afectación a las poblaciones de peces por disponibilidad de recursos alimenticios, relacionados con estas variaciones estacionales y climáticas; mientras que Angermeier y Karr (1983) sugirieron afectaciones similares, en ríos de Panamá central.
La especie G. polylepis fue considerada escaza y de capturas raras, el registro en la presente investigación; y el reporte de Barbee (2002), en la zona del Pacífico Central de Costa Rica, representa registros recurrentes para esta y en sitios en apariencia similares, cercanos a la costa y cerca de las desembocaduras. En consecuencia, sugiere que sea una especie con menos adaptación a las condiciones totalmente dulceacuícolas como sí lo es su congénere G. maculatus, eventualmente, pudiendo ser una especie más abundante que lo que se considera.
La ictiodiversidad y abundancia en la presente investigación no difiere grandemente de otros registros en la zona sur de Costa Rica; no obstante, son bajas y con dominancia de especies dulceacuícolas secundarias y periféricas, debido a que las investigaciones se han desarrollado en sitios cercanos a la costa con influencia de las desembocaduras de los ríos. El significado de la palabra ictiodiversidad se debe tener claro si es relativo a los valores de los índices, pues el dato de abundancia ya está incluído, pero si, únicamente, alude a la riqueza, es correcto plantear los dos términos.
La diversidad de peces de agua dulce para los cuatro ríos evaluados se considera similar, sin diferencias importantes en cantidad de especies y en registro de individuos, de riqueza y de abundancia relativamente bajas. Se debe evitar la palabra “cantidad”; en su lugar, se debe usar “número de especies” o “riqueza”.
Considerando las diferencias en los ensamblajes taxonómicos influenciados por algunas capturas de especies primarias, particularmente en el Río Morete, en general, la ictiodiversidad de estos ríos, y en esta región, es similar, con dominancia de especies estuarinas o secundarias dulceacuícolas.
Referencias
Abell, R.; Thieme, M. L.; Revenga, C.; Bryer, M.; Kottelat, M. y Bogutskaya et al. (2008). Freshwater Ecoregions of the World: A New Map of Biogeographic Units for Freshwater Biodiversity Conservation. Biosc, 58: 5-403.
Alpírez, O. (1985). Ictiofauna de la vertiente Pacífica de Costa Rica. Brenes, 24: 297-318.
Alvarado, R. (2003). Regiones y cantones de Costa Rica. Instituto de Fomento y Asesoría Municipal. Mimeógrafo,
Angermeier, P. L. y Karr, J. R. (1983). Fish communities along environmental gradients in a system of tropical streams. Env. Biol. Fish. 9(2): 117-135.
Angulo, A.; Garita-Alvarado, C. A.; Bussing, W. A. y López, M. (2013). Annotated checklist of the freshwater fishes of continental and insular Costa Rica: additions and nomenclatural revisions. Check List, 9(5): 987–1019.
Arceo-Carranza, D. y Vega-Cendejas, M. E. (2009). Spatial and temporal characterization of fish assemblages in a tropical coastal system influenced by freshwater inputs: northwestern Yucatan peninsula. Rev. Biol. Trop., 57(1-2): 89-103.
Ayala-Pérez, L. A.; Avilés-Alatriste, O. A. y Rojas-Galaviz, J. L. (1998), Estructura de la comunidad de peces en el sistema Candelaria-Panlau, Campeche, México, Rev. Biol. Trop., 46(3):763-774.
Bain, M. B. y Finn, J. T. (1991). Analysis of microhabitat use by fish: Investigator effect and investigator bias, Riv., 2(1): 57-65.
Balzarini, M. G.; Casanoves, F.; Di Rienzo, J. A.; González, L. A.; Robledo, C. W. y Tablada, E. M. (2017), InfoStat, versión 1.1, Manual del Usuario, Grupo InfoStat, FCA, Universidad Nacional de Córdoba, (5.ª ed.), Editorial Brujas: Córdoba, Argentina
Barbee, N. C. (2002). Distribution patterns of two grazers, Sicydium salvini and Protoptila sp., in riffles and pools in a pacific coast stream in Costa Rica. Verh. Int. Ver. Limn., 28: 739-743.
Berra, T. M. (2001). Freshwater fish distribution. Academic Press. San Diego, California. United States of America
Bussing, W. A. (1993). Fish communities and environmental characteristics of a tropical rainforest river in Costa Rica. Rev. Biol. Trop., 41(3): 791-809.
Bussing, W. A. (2002). Peces de las aguas continentales de Costa Rica. San José: Editorial de la Universidad de Costa Rica
Chicas, F. (2001). Peces juveniles en una poza provocada por la marea, Reserva Forestal Térraba-Sierpe, Puntarenas, Costa Rica. Rev. Biol. Trop., 49: 307-314.
Chinchilla, I. y Protti, M. y Cabrera, J. (2002). Peces dulceacuícolas de la Isla del Caño: Distribución y aspectos biogeográficos. Unicienc, 19: 53-57
Constantz, G. y W. Bussing y Saul, W. (1981). Freshwater fishes of Corcovado National Park, Costa Rica. Proc. Acad. Nat. Scien. Philad, 133: 15-19.
Cowx, I. G. (1990). Developments in electric fishing, Fishing new books, Cambridge, United Kingdom
Fricke, R.; Eschmeyer, W. N. y Van der Laan, R. (eds.) 2019. Eschmeyer´s catalog of fishes: Genera, Species. Recuperado de http://researcharchive.calacademy.org/research/ichthyology/catalog/fishcatmain.asp.
Fièvet, É. y Bonnet-Arnaud, P. y Mallet, J. (1999). Efficiency and sampling bias of electrofisching for freshwater shrimp and fish in two Caribbean streams, Guadeloupe Island, Fisheries Research, 44:149-166.
Fièvet, E. y Dolédec, S. y Lim, P. (2001). Distribution of migratory fishes and shrimps along multivariate gradients in tropical island streams. J. Fish. Biol., 59: 390-402.
Fowler, J.; Cohen, L. y Jarvis, P. (1998), Practical statistics for field biology, (2.da ed.), West Sussex, England: John Wiley & Sons
García de Jalón, D. (1997). Efectos del vaciado en las comunidades de peces fluviales. Trabajo presentado en Simposio sobre los Estudios de los Desembalses en Joaquín Costa, Sevilla, España.
Henderson, P. A. y R. M. Seaby. (2006). Species, diversity and richness, Versión 4.0 Pisces Conservation Ltda., (Programa informático), Pennigton, Lyminton, Union King.
Kappelle, M.; Castro, M.; Acevedo, H.; González, L. y Monge, H. Costa Rica e Instituto Nacional de Biodiversidad (Costa Rica). (2002). Ecosistemas del Área de Conservación Osa (ACOSA) (1.a. ed.). Heredia, Costa Rica.
Lyons, J. y Schneider, D. W. (1990). Factors influencing fish distribution and community structure in a small coastal river in southwestern Costa Rica. Hydrobiol, 203: 1-14.
Magurran, A. E. (1988). Ecological diversity and its Measurement (1.a ed.) Princeton University Press: New Jersey, United States of America.
McKaye, K.; Weiland, D. y Lim, T. (1979). Comments on the breeding biology of Gobiomorus dormitory (Osteichthyes: Eleotridae) and the advantage of schooling behavior to its fry. Copeia 1979: 542-544.
Molina-Ureña, H. (2008). Estado de población de peces del Sitio Osa. Informe parcial N.° 2, Programa de Monitoreo Acosa. TNC-INBio. 10 pp. Recuperado de http://docplayer.es/7794725-Programa-de-monitoreo-ecologico-para-la-evaluacion-de-la-efectividad-de-las-estrategias-de-conservacion-en-el-area-de-conservacion-osa.html
Moreno, C. E. (2001). Métodos para medir la biodiversidad. M&T-Manuales y Tesis SEA, vol. 1: Zaragoza, España
Myers, A. y Giller, P. (1995). Biogeographic perspectives. Process, pattern and scale in biogeography, pp. 3-12. En Myers, A. y Giller, P. (eds.). Analytical biogeography. An integrated approach to the study of animal and plant distribution. Chapman y Hall. London, England.
Obando, V. Costa Rica e Instituto Nacional de Biodiversidad (Costa Rica). (2002).Biodiversidad en Costa Rica: estado del conocimiento y gestión, Santo Domingo, Heredia, Costa Rica, INBio.
Persat, H. y Copp, G. (1990). Electric fishing and point abundance sampling for the ichthyology of large rivers. En Cowx, I. J. (comp.), Developments in Electric Fishing, Fishing News Books, (1.a ed.) (pp. 197-209), Cambridge Press: Cambridge, United Kingdom.
Protti, M., Sáenz, I.; Guevara, M. y Herrera, M. (2005a). Evaluación de la ictio y entomofauna acuática en el área de impacto y zonas aledañas al Proyecto Hidroeléctrico Cariblanco, “Informe Científico Técnico Periodo 2004”, Laboratorio de Recursos Naturales y Vida Silvestre, Heredia, Costa Rica.
Protti, M.; Sáenz, I.; Guevara, M. y Herrera, M. (2005b). Evaluación de la ictio y entomofauna acuática en el área de impacto y zonas aledañas al Proyecto Hidroeléctrico Cariblanco, “Informe Científico Técnico Anual: Periodo Diciembre 2004-Octubre 2005”, Laboratorio de Recursos Naturales y Vida Silvestre, Heredia, Costa Rica.
Protti, M.; Sáenz, I.; Guevara, M. y Herrera, M. (2007). Evaluación de la ictio y entomofauna acuática en el área de impacto y zonas aledañas al Proyecto Hidroeléctrico Cariblanco, “Informe Científico Técnico Anual: Periodo Diciembre 2005-Octubre 2006”, Laboratorio de Recursos Naturales y Vida Silvestre, Heredia, Costa Rica.
Rojas, R. y Rodríguez, O. San José (provincia) e Instituto Costarricense de Electricidad (Costa Rica). (2004). Importancia ecológica y socioeconómica de las comunidades ictiológicas del Río Grande de Térraba, como elemento esencial en la viabilidad ambiental del Proyecto Hidroeléctrico Boruca. Informe técnico sin publicar. San José, Costa Rica.
Rojas, R. y Rodríguez, O. (2008). Diversidad y abundancia ictiofaunística del Río Grande de Térraba, sur de Costa Rica. Rev. Biol. Trop. 56(3): 1429-1447.
Sistema Nacional de Áreas de Conservación (SINAC). (2007). Grúas II. Análisis de vacíos de conservación en Costa Rica: vol. II. Análisis de Vacíos en la Representatividad e Integridad de la Biodiversidad de los sistemas de aguas continentales (1.a ed.). San José, Costa Rica: Asociación Conservación de la Naturaleza.
Strange, E. M.; Moyle, P. B. y Foin, T. C. (1992). Interactions between stochastic and deterministic processes in stream fish community assembly. Env. Biol. Fish, 36:1-15.
Villegas, J. C. (2011). Relación entre la diversidad de ictiofauna y la calidad del agua en ríos con diferente grado de afectación por diques y canales en la zona sur de Costa Rica (Tesis posgrado). UNED. Costa Rica. Mimeógrafo.
Winemiller, K. (1993). Seasonality of reproduction by livebearing fishes in tropical rainforest streams. Oecolog, 95: 266-276.
Winemiller, K. O. y Morales, N. E. (1989). Comunidades de peces del Parque Nacional Corcovado luego del cese de las actividades mineras. Brenes, 31: 75-91.
Zar, J. H. (2010). Biostatistical analysis (5.a ed.) Nueva Jersey: Upper Saddle River. Prentice Hall.