|
UNED Research Journal. Vol. 17, ENE-DIC,
2025.
|
|
Variación estacional de parasitoides idiobiontes y koinobiontes (Hymenoptera: Ichneumonidae) en Isla Barro Colorado, Panamá
1Universidad de Costa Rica, Sede Guanacaste, Recinto de Santa Cruz. Laboratorio de Entomología, Guanacaste, Costa Rica; jairo.mora@ucr.ac.cr
Recibido 17-I-2025 Å Corregido 10-III-2025 Å Aceptado 07-IV-2025
DOI: https://doi.org/10.22458/urj.v17i1.e5648
ABSTRACT: “Seasonal Variation of Idiobiont and Koinobiont Parasitoids (Hymenoptera: Ichneumonidae) on Barro Colorado Island, Panamá.” Introduction: Ichneumonids are a group of parasitoid wasps that play a fundamental role in the biological control of other insects. Based on their reproductive strategy, they are classified as idiobionts and koinobionts. Idiobionts paralyze or kill their host immediately after oviposition, preventing further development, while koinobionts allow the host to continue growing and developing for some time, often manipulating its physiology to benefit the wasp larva. Tropical species are poorly known. Objective: To evaluate the seasonal variation of idiobiont and koinobiont parasitoids on Barro Colorado Island, Panamá. Methodology: I analyzed Hymenoptera samples collected weekly between 2014 and 2017 as part of the ForestGeo® project, managed by the Smithsonian Tropical Research Institute. My study focused on specimens of the Ichneumonidae family, which I classified by subfamilies and reproductive strategies. Results: Idiobiont parasitoids were more abundant and remained more stable over time compared to koinobionts, which dropped sharply in numbers during 2016 and 2017. In the dry season, idiobionts became more common, while koinobiont numbers stayed about the same between wet and dry seasons. Idiobionts also had more species, especially in the dry season. However, both groups started to decline in numbers and species from 2015 onward. Conclusions: Idiobionts were more common and stable over the years than koinobionts. They also had more species in every year of the study.
Keywords: biological regulators, climate change, population dynamics, population ecology
RESUMEN. Introducción: Los ichneumónidos son un grupo de avispas parasitoides que desempeñan un papel fundamental en el control biológico de otros insectos. Según su estrategia reproductiva, se clasifican en idiobiontes y coinobiontes. Los idiobiontes paralizan o matan a su huésped inmediatamente después de la oviposición, impidiendo su desarrollo posterior, mientras que los koinobiontes permiten que el hospedero continúe creciendo y desarrollándose durante un tiempo, manipulando a menudo su fisiología para beneficiar a la larva de la avispa. Las especies tropicales son poco conocidas. Objetivo: Evaluar la variación estacional de parasitoides idiobiontes y koinobiontes en la Isla Barro Colorado, Panamá. Métodos: Analicé muestras de Hymenoptera recolectadas semanalmente entre 2014 y 2017 como parte del proyecto ForestGeo®, gestionado por el Instituto Smithsonian de Investigaciones Tropicales. Mi estudio se centró en especímenes de la familia Ichneumonidae, los cuales clasifiqué por subfamilias y estrategias reproductivas. Resultados: Los parasitoides idiobiontes fueron más abundantes y se mantuvieron más estables a lo largo del tiempo en comparación con los koinobiontes, cuyos números disminuyeron drásticamente en 2016 y 2017. En la estación seca, los idiobiontes fueron más comunes, mientras que la cantidad de koinobiontes se mantuvo similar entre las estaciones seca y lluviosa. Los idiobiontes también presentaron una mayor riqueza de especies, especialmente durante la estación seca. Sin embargo, ambos grupos comenzaron a disminuir en número y riqueza de especies a partir de 2015. Conclusiones: Los idobiontes fueron más comunes y estables a lo largo de los años que los koinobiontes. Además, presentaron un mayor número de especies en cada año del estudio.
Palabras clave: reguladores biológicos, cambio climático, dinámica poblacional, ecología de poblaciones
Los miembros de la familia Ichneumonidae son las avispas parasitoides con mayor diversidad dentro del orden Hymenoptera (Ruiz et al., 2014). Esta familia posee más de 24 200 especies descritas a nivel mundial, de las cuales más de 7 700 pertenecen a la Región Neártica, y más de 7 400 a la Región Neotropical (Ruíz, 2015). Todas las especies descritas se encuentran agrupadas dentro de 42 subfamilias y más de 465 géneros (Yu, 2005). Estos insectos se encuentran ampliamente distribuidos a nivel mundial; pudiendo ser encontrados en la mayoría de los habitad terrestres, con excepción de las zonas polares (Ruiz et al., 2012).
La mayoría de las subfamilias de Ichneumonidae son parasitoides especializados en insectos holometábolos, en particular en estados inmaduros de los órdenes Coleoptera, Lepidoptera y Diptera. Según su estrategia reproductiva, estos parasitoides se dividen en idiobiontes y koinobiontes: los primeros paralizan permanentemente al hospedero, mientras que los segundos permiten que este recupere su movilidad tras la parasitación (Gauld, 1988; Onody, 2005). En general, el ciclo biológico de Ichneumonidae, igual que los de otros insectos, está determinado principalmente por las condiciones bióticas (p.e disponibilidad de hospederos) y abióticas (p.e. factores climáticos) del medio en donde se desarrollan (Régnière, 2009; López et al, 2009).
Panamá es un país tropical que presenta a lo largo del año dos temporadas climáticas bien definidas (i.e. temporada seca, 308mm de lluvia; temporada lluviosa, 2 329mm de lluvia); la temporada seca generalmente se extiende de enero a abril, y la temporada lluviosa se presenta en los meses de junio a noviembre (Gonzales y Croz, 2007). Asimismo, entre las dos temporadas existe un periodo de transición climático, que ocupa los meses de mayo y diciembre (Cruz y Ramírez, 2012; Paton, 2016).
En Panamá, se ha evaluado la fluctuación de las poblaciones de Ichneumonidae de acuerdo con los cambios de precipitación y temperatura a lo largo del año, evidenciando una mayor abundancia de estos parasitoides en los meses de mayor humedad, presuntamente debido a una mayor presencia de hospederos (Shapiro & Pickering, 2000). Se conoce que los parasitoides más especializados (i.e. koinobiontes) son más susceptibles a los cambios climáticos por ser más dependientes de sus hospederos (Veijalainen et al., 2014), por lo que se esperaría que cualquier cambio extremo en las condiciones climáticas tenga una mayor influencia en sus poblaciones, que en las de los Ichneumonidae menos especializados (i.e idiobiontes) (Quicke, 2014). Con base en lo anterior, evalué la variación estacional de parasitoides idiobiontes y koinobiontes en Barro Colorado, con el fin de conocer su dinámica poblacional durante cuatro años de colecta.
MATERIALES Y MÉTODOS
Sitio de estudio: La presente investigación fue realizada en Isla Barro Colorado (BCI), ubicada en la Provincia de Panamá Oeste, cerca de la frontera de la Provincia de Colón (9°9’N, 79°50’W) a 164msnm. BCI es la isla más grande del lago Gatún, posee una extensión territorial aproximada de 1 642 hectáreas, caracterizadas por la presencia de vegetación típica de un bosque húmedo tropical. Con temperaturas que oscilan entre los 25°C a 30°C y precipitaciones anuales de 2 377mm de lluvia.
Temporadas climáticas: El año meteorológico se subdividió en dos temporadas climáticas, de acuerdo con lo establecido por Eisenmann (1952) y Barone (1998). La temporada seca con una duración aproximada de cinco a seis meses, que van de diciembre a mayo, mientras que la temporada lluviosa abarca los meses de junio a noviembre (6 y 7 meses).
Recolección de especímenes: Las colectas fueron realizadas en una parcela de bosque tropical de 50 hectáreas, establecida como parte del proyecto mundial de estudio de bosques tropicales ForestGeo® (http://www.forestgeo.si.edu/), manejado por personal del Smithsonian Tropical Research Institute. Como parte del monitoreo de insectos, en dicha parcela se encontraban activas diez trampas Malaise de forma permanente, las cuales fueron revisadas cada semana desde el año 2000 hasta inicios del 2018. Para este estudio utilice las muestras obtenidas durante cuatro años (2014-2017), equivalentes a 2 080 muestras, obtenidas de las diez trampas con 52 repeticiones anuales. Durante cada semana, las muestras de insectos de las diez trampas fueron depositadas en bolsas Whirl-Pack® y etiquetadas con los datos de colecta. Posteriormente, fueron trasportadas al edificio del Programa Centroamericano de Maestría de la Universidad de Panamá, para ser divididos en tres submuestras: Coleoptera, Hymenoptera y residuos (otros órdenes). No obstante, para la realización de este estudio únicamente trabaje con las submuestras de Hymenoptera.
Procesamiento e identificación de muestras: Realice la separación de los especímenes de la familia Ichneumonidae, contenidos en las submuestras de Hymenoptera colectadas durante los años 2014, 2015, 2016 y 2017. Cada uno de los ejemplares extraídos de cada submuestra, fue identificado a nivel de subfamilia y morfoespecie, examinando sus características morfológicas externas, utilizando claves taxonómicas (Hanson y Gauld, 2006). Con el fin de disminuir el sesgo por dimorfismo sexual en la determinación de las morfoespecies, realicé esta clasificación con base en las hembras. Posteriormente, asigné a los machos con mayores similitudes a cada morfoespecie.
Conformación de grupos ecológicos: Clasifique las subfamilias de Ichneumonidae, en dos grupos ecológicos de acuerdo con sus estrategias de reproducción (idiobiontes y koinobiontes) utilizando información disponible en literatura actualizada (Shapiro y Pickering, 2000; Hanson y Gauld, 2006) (Fig. 1).
|
|
Estrategia reproductiva |
|
|
Subfamilia |
idiobionte |
koinobionte |
|
Cryptinae |
|
|
|
Ichenumoninae |
|
|
|
Tryphoninae |
|
|
|
Anomaloninae |
|
|
|
Banchinae |
|
|
|
Campopleginae |
|
|
|
Rhyssinae |
|
|
|
Labeninae |
|
|
|
Brachycyrtinae |
|
|
|
Cremastinae |
|
|
|
Mesochorinae |
|
|
|
Metopiinae |
|
|
|
Ophioninae |
|
|
|
Orthocentrinae |
|
|
|
Tersilochinae |
|
|
|
Pimplinae |
|
|
Fig. 1. Subfamilias neotropicales de Ichneumonidae encontradas en Panamá. Nota: El sombreado negro indica la estrategia reproductiva asignada a cada subfamilia.
Análisis de datos: Almacené los datos obtenidos en una base de datos en Excel®, a partir de la cual generé las matrices necesarias para realizar los análisis. Utilicé la prueba de Shapiro-Wilk para comprobar la normalidad de los datos correspondientes a la abundancia de idiobiontes y koinobiontes por año y por temporadas climáticas (i.e., seca, lluviosa) de colecta. Dado que la normalidad de los datos fue rechazada, evalué la abundancia de idiobiontes y koinobiontes mediante la prueba no paramétrica de Wilcoxon para realizar dos comparaciones (i.e., temporadas seca y lluviosa) y Kruskal-Wallis para realizar tres o más comparaciones (i.e., años, meses y temporadas por año). Si era necesario, después del Kruskal-Wallis, realicé una prueba post hoc de comparaciones múltiples de Wilcoxon, con corrección de Bonferroni. Los análisis anteriores se llevaron a cabo en el programa R, versión 3.4.0 (R Core Team, 2017).
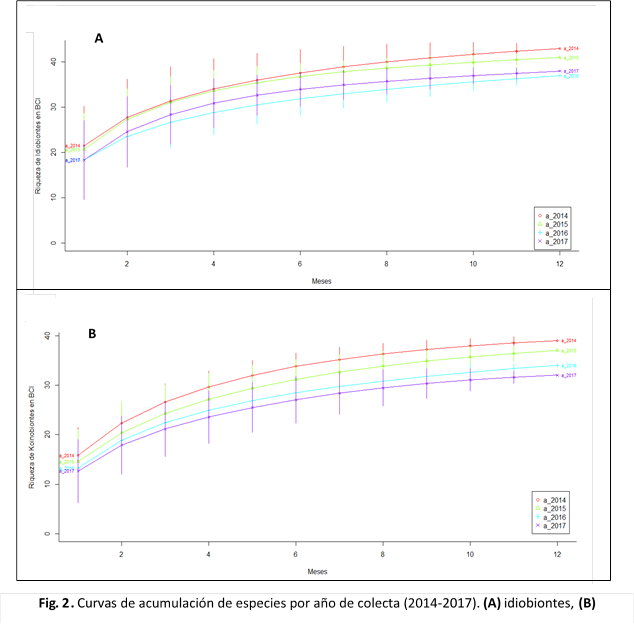
Por otro lado, elaboré una matriz con la abundancia de las morfoespecies obtenidas durante cada temporada de muestreo (i.e., seca, lluviosa) utilizando Microsoft Excel®. A partir de esta matriz, generé tablas para representar la abundancia y riqueza de koinobiontes e idiobiontes a lo largo de los años de muestreo. Además, confeccioné curvas de acumulación de especies por año y temporada climática para cada grupo ecológico (i.e., idiobiontes, koinobiontes), utilizando el programa estadístico R 3.4.0 (R Core Team, 2017) y el paquete BiodiversityR (Kindt, 2018).
RESULTADOS
Los parasitoides idiobiontes presentaron una abundancia significativamente mayor en comparación con los koinobiontes (Tabla 1), además de evidenciar una mayor estabilidad poblacional a lo largo de los años de captura. En contraste, los koinobiontes mostraron una reducción significativa en las capturas reportadas en los años 2016 y 2017.

En cuanto a la abundancia total de parasitoides por temporada climática (Tabla 2), observé un incremento significativo de idiobiontes durante la temporada seca. En cambio, para el grupo de los koinobiontes, no encontré diferencia significativa entre las épocas de colecta.
Al analizar únicamente las temporadas secas, observé que los koinobiontes presentaron una disminución significativa en su abundancia durante los años 2016 y 2017. Este patrón fue similar en el grupo de los idiobiontes, aunque en este caso la reducción no fue significativa. Por otro lado, al evaluar la abundancia de ambos grupos durante las temporadas lluviosas, ninguno de ellos mostró diferencias significativas.
Al evaluar ambas temporadas de un mismo año de colecta (Tabla 2), los años 2014 y 2015 presentaron una abundancia significativamente mayor de idiobiontes en la temporada seca. En cuanto al grupo de los koinobiontes, no se encontraron diferencias significativas entre las temporadas de los años analizados.

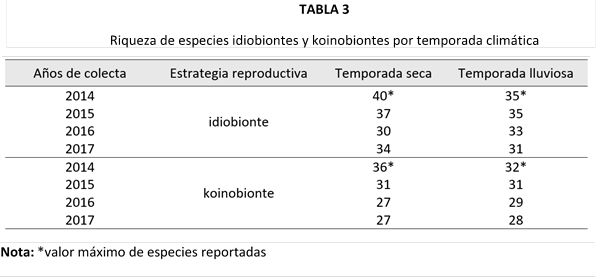
Al igual que la abundancia, la riqueza de especies estuvo dominada por los idiobiontes (Tabla 3). Este grupo alcanzó su mayor número de especies durante la temporada seca, seguido de una notable reducción en la estación lluviosa. De manera similar, los koinobiontes mostraron un patrón comparable en ambas temporadas.
El análisis de la riqueza por años de colecta (Fig. 2), mostró una mayor cantidad de especies idiobiontes y koinobiontes durante los dos primeros años, seguida por una disminución en años posteriores.
DISCUSIÓN
Encontré una mayor abundancia de organismos idiobiontes en comparación con los koinobiontes. Este hallazgo coincide con lo reportado por Shapiro y Pickering (2000), quienes observaron un patrón similar en Barro Colorado. Sin embargo, estudios realizados fuera de Panamá han reportado tendencias opuestas. Por ejemplo, en México, la abundancia de koinobiontes fue un 84% mayor que la de los idiobiontes (Orozco et al., 2019). De manera similar, en un bosque tropical muy húmedo de Costa Rica, se registró una mayor abundancia de koinobiontes (Shapiro y Pickering, 2000). Estos resultados contrastantes pueden interpretarse de dos maneras. La primera sugiere que los idiobiontes podrían verse favorecidos por condiciones de menor humedad, ya que el bosque de Costa Rica presenta el doble de precipitación anual que Barro Colorado (aproximadamente 4000 mm). La segunda interpretación sugiere que los koinobiontes son más sensibles a los bosques con algún grado de intervención, como el caso de Barro Colorado, que es una isla artificial. Esta hipótesis se respalda en el estudio de Shapiro y Pickering (2000), en el cual se reportó una mayor abundancia de koinobiontes en bosques maduros.
Según Rodríguez et al. (2015), la precipitación y temperatura guardan una correlación positiva con la abundancia de ichneumónidos presentes en el sistema. En mi estudio, el comportamiento de los idiobiontes sugiere una preferencia por condiciones de menor humedad y mayor temperatura. Este hallazgo coincide con lo reportado por Mazón et al. (2009) y Mazón et al. (2011b), quienes documentaron un incremento en la actividad idiobionte durante la temporada de otoño. Por otro lado, no encontré un patrón estacional definido para los koinobiontes, cuya abundancia se mantuvo similar en ambas temporadas del año. Este resultado puede deberse a las diferencias en el comportamiento de las subfamilias que integran este grupo. Por ejemplo, la subfamilia Campopleginae presenta una distribución estacional concentrada entre los meses de verano y otoño (Berrío y Bustamante, 2014), mientras que las subfamilias Cremastinae y Tersilochinae prefieren la primavera y finales de verano (Rodríguez et al., 2010). De manera similar, otras subfamilias koinobiontes tienden a concentrarse hacia finales de la primavera y comienzos del verano, bajo condiciones intermedias de transición (Mazón et al., 2011b). Sin duda, cada subfamilia presenta un comportamiento distintivo que afecta la dinámica general del grupo. Por tanto, se sugiere que futuras investigaciones sean orientadas hacia el análisis de grupos más específicos, con el propósito de caracterizar con mayor precisión el comportamiento de los organismos en estudio.
En términos de riqueza, el número de especies colectadas en Barro Colorado fue inferior al reportado en otros bosques tropicales de tierras bajas (Veijalainen et al., 2014). Este resultado podría deberse a una subestimación, consecuente al uso de morfoespecies y agrupaciones visuales, en lugar de identificaciones precisas a nivel de especie mediante claves taxonómicas. Por ejemplo, en Barro Colorado, informé de la presencia de una sola especie de Orthocentrinae (subfamilia koinobionte), mientras que Mazón et al. (2011b) la identificaron como la subfamilia más rica del grupo, con 14 especies. De manera similar, para la subfamilia Cryptinae (idiobionte), reporté 15 morfoespecies, mientras que Mazón et al. (2011a) documentaron 86 especies. Otros estudios han reportado hasta un 90% más de morfoespecies que las encontradas en mi investigación (Veijalainen et al., 2014).
Por otra parte, la baja riqueza de especies encontrada en Barro Colorado podría estar asociada al factor altitudinal. Veijalainen et al. (2014) reportaron una correlación positiva entre el gradiente altitudinal y la riqueza de especies de la familia Ichneumonidae. Además, factores como la intervención humana y la madurez del bosque influyen en la cantidad de especies presentes en el sistema (Shapiro y Pickering, 2000). Esto es respaldado por el estudio de Orozco et al. (2019), quienes encontraron una mayor riqueza de géneros en áreas no afectadas por la intervención humana.
Este trabajo representa una contribución significativa al conocimiento de la ecología de Ichneumonidae en Panamá. Además, establece las bases para futuras investigaciones, dado que el único estudio realizado sobre esta familia en el país data de hace más de 24 años.
AGRADECIMIENTOS
Agradezco al Programa Regional de Becas del Servicio Alemán de Intercambio Académico (DAAD), por brindarme la oportunidad de estudiar en el extranjero con una beca completa de estudios. A Héctor Barrios, del Programa Centroamericano de Maestría en Entomología (PCMENT) y al Instituto Smithsonian de Investigaciones Tropicales (STRI), por la colecta y suministro de material biológico. A Paul Hanson, por las claves taxonómicas de suministradas.
Agradezco especialmente a mi gran amiga y compañera Samanta Orellana, por la toda la ayuda brindada durante la investigación.
ETICA, CONFLICTO DE INTERESES Y DECLARACIÓN DE FINANCIAMIENTO
El autor declara que ha cumplido plenamente con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en la producción del manuscrito; que no existen conflictos de interés de ningún tipo; que todas las fuentes financieras están completamente y claramente especificadas en la sección de agradecimientos; y que están de acuerdo con la versión final editada del artículo. Se ha archivado un documento firmado en los archivos de la revista.
REFERENCIAS
Barone, J. (1998). Effects of light availability and rainfall on leaf production in a moist tropical forest in central Panama. Journal of Tropical Ecology, 14(3), 309–321.
Berrío, A. R., & Bustamante, S. G. (2014). Diversidad de la subfamilia Campopleginae–Ichneumonidae (Hymenoptera) en la cuenca del río Cañete–lunahuaná, Perú. Ecología Aplicada, 13(1-2), 147-152.
Cruz, C., & Ramírez, A. (2012). Caracterización climática para los distritos de Panamá y San Miguelito, según los datos suministrados por la estación meteorológica Tocumen. Instituto de Meteorología e Hidrología de Panamá (IMHPA). https://www.imhpa.gob.pa/uploads/documentos/caracterizacin_del_clima_en_el_distrito_de_panam.pdf
Eisenmann, E. (1952). Annotated list of birds of Barro Colorado Island, Panama Canal Zone. Smithsonian Miscellaneous Collections, 117(5), 1–12.
Gauld, I. (1988). Evolutionary patterns of host utilization by ichneumonoid parasitoids (Hymenoptera: Ichneumonidae and Braconidae). Biological Journal of the Linnean Society, 35(4), 351-377.
Gonzales, L., & Croz, L. (2007). Variabilidad espacial del afloramiento en el golfo de Panamá. Tecnociencia, 9(2), 107-119.
Hanson, P., & Gauld, I. (2006). Hymenoptera de la región Neotropical. Memoirs of the American Entomological Institute, 77, 1–994.
Kindt, R. (2018). Package for community ecology and suitability analysis: Package “BiodiversityR”. https://cran.r-project.org/web/packages/BiodiversityR/BiodiversityR.pdf
Mazón, M., Rodríguez Berrío, A., & Bordera, S. (2009). Estudio de la fauna de Ichneumonidae idiobiontes (Hymenoptera) en un ecosistema de montaña mediterránea. I. Subfamilias Pimplinae y Xoridinae. Boletín - Asociación Española de Entomología, 33(1-2), 123–137.
Mazón, M., Bordera, S., & Rodríguez Berrío, A. (2011a). Estudio de la fauna de Ichneumonidae idiobiontes (Insecta: Hymenoptera) en un ecosistema de montaña mediterránea, II. Subfamilia Cryptinae. Boletín - Asociación Española de Entomología, 35(1-2), 183–222
Mazón, M., Rodríguez Berrío, A., & Bordera, S. (2011b). Estudio de la fauna de Ichneumonidae cenobiontes (Insecta: Hymenoptera) en un ecosistema de montaña mediterranea, III. Subfamilias Acaenitinae, Anomaloninae, Collyriinae, Diplazontinae, Metopiinae, Ophioninae, Orthocentrinae, Orthopelmatinae y Tryphoninae. Boletín - Asociación Española de Entomología, 35(1-2), 113–155.
López-Gómez, V., Jiménez-Cedillo, L. Y., Blanco-Becerril, M. Á., & Cano-Santana, Z. (2009). Ecología de la comunidad de artrópodos asociada a Muhlenbergia robusta (Poaceae). Biodiversidad del ecosistema del Pedregal de San Ángel. Universidad Nacional Autónoma de México, 441–451.
Onody, C. (2005). Estudio de los Campopleginae (Hymenoptera: Ichneumonidae) neotropicales con énfasis en la fauna de la Mata Atlántica, Brasil. Universidad General de San Carlos, Centro de Ciencias Biológicas de Salud. pp. 3-5.
Orozco-Peón, O., González-Moreno, A., Ruíz-Sánchez, E., & Tun-Suárez, J. M. (2019). Comunidades y gremios de parasitoides (Hymenoptera: Ichneumonidae) en cultivo de maíz y selva baja caducifolia circundante. Ecosistemas y Recursos Agropecuarios, 6(17), 195–205. https://doi.org/10.19136/era.a6n17.1977
Paton, S. (2016). Meteorological and hydrological summary for Barro Colorado Island (pp. 1–41). Smithsonian Tropical Research Institute. Recuperado de https://biogeodb.stri.si.edu/physical_monitoring/pdf/BCI%20Met&Hyd%20Report%202016.pdf
Quicke, D. L. J. (2014). The braconid and ichneumonid parasitoid wasps: Biology, systematics, evolution and ecology. John Wiley & Sons. https://doi.org/10.1002/9781118907085
R Core Team. (2017). R: A language and environment for statistical computing. The R Foundation for Statistical Computing. https://www.R-project.org
Régnière, J. (2009). Predicción de la distribución continental de insectos a partir de la fisiología de las especies. Canadá. Recuperado el 8 de junio de 2024, de http://www.fao.org/docrep/011/i0670s/i0670s09.htm
Rodríguez-Mota, A. J., Ruíz-Cancino, E., Ivanovich-Khalaim, A., Coronado-Blanco, J. M., & Treviño-Carreón, J. (2015). Diversidad de Ichneumonidae (Hymenoptera) en un bosque de Pinus spp. y Juniperus flaccida en Jaumave, Tamaulipas, México. Revista Mexicana de Biodiversidad, 86(4), 972–980. https://doi.org/10.1016/j.rmb.2015.08.003
Rodríguez Berrío, A., Mazón, M., & Bordera, S. (2010). Estudio de la fauna de Ichneumonidae cenobiontes (Hymenoptera) en un ecosistema de montaña mediterránea, II. Subfamilias Cremastinae y Tersilochinae. Boletín - Asociación Española de Entomología, 34(1-2), 39–66
Ruíz, E., Coronado, J., Ivanovich, A., Toledo, V., Flores, A., Tovar, E., & García, J. (2012). Ichneumonidae (Hymenoptera) en el control natural y biológico de insectos en México. Universidad Autónoma del Estado de Morelos. Recursos Naturales, 244- 252.
Ruiz, E., Rafaelevich, D., Gonzales, A., Ivanovich, A., & Coronado, J. (2014). Biodiversidad de Ichneumonidae (Hymenoptera) en México. Revista Mexicana de Biodiversidad, 85, 385-391.
https://doi.org/10.7550/rmb.32448
Ruiz, E. (2015). La familia Ichneumonidae (Hymenoptera) en México. Entomología Mexicana, 2, 1–13.
Shapiro, B., & Pickering, J. (2000). Rainfall and parasitic wasp (Hymenoptera: Ichneumonoidea) activity in successional forest stages at Barro Colorado Nature Monument, Panama, and Selva Biological Station, Costa Rica. Agricultural and Forest Entomology, 2, 39-47.
Veijalainen, A., Saaksjarvi, I., Tuomisto, G., Bordera, S., & Jussila, R. (2014). Altitudinal trends in species richness and diversity of Mesoamerican parasitoid wasps (Hymenoptera: Ichneumonidae). Insect Conservation and Diversity, 7, 496–507.
Yu, D. S. (2005). Taxapad Ichneumonoidea. In Catalogue of Life (version May 2009). Consultado el 24 de marzo de 2025, en http://www.taxapad.com




 |
