Índice biológico de lodos como bioindicador en dos sistemas de tratamiento de agua residual hospitalaria en Costa Rica
Margarita Loría Naranjo1![]() & Wilson Beita Sandí2
& Wilson Beita Sandí2![]()
1. Universidad Estatal a Distancia, Maestría Académica en Manejo de Recursos Naturales. Mercerdes de Montes de Oca, de la rotonda de Betania 500 m este, carretera a Sabanilla, San José, Costa Rica; maggie.loria@gmail.com
2. Universidad de Costa Rica, Centro de Investigación en Contaminación Ambiental. San Pedro, San José, Costa Rica; wilson.beita@ucr.ac.cr
Recibido 07-VI-2024 ● Corregido 02-VIII-2024 ● Aceptado 13-VIII-2024
DOI: https://doi.org/10.22458/urj.v16i1.5334
|
ABSTRACT. “Sludge biological index as operational bioindicator of two hospital wastewater treatments in Costa Rica”. Introduction: Biological monitoring in activated sludge wastewater treatment systems provides comprehensive results and serves as a complementary tool in operational control decisions. One such tool is the Sludge Biological Index (SBI), which is based on protozoa. However, there is limited data on this topic in Costa Rica. Objective: To evaluate the SBI as a bioindication tool in hospital wastewater. Methods: From February to April 2022, we collected a total of 36 samples from a Conventional Activated Sludge Treatment system and a Membrane Bioreactor (MBR) at a Costa Rican hospital. Results: The removal efficiency of BOD and COD was higher in the MBR; however, in both cases, the efficiency was high (greater than 85%), and this is related to the high SBI values. Nitrogen removal efficiency did not exceed 50% (MBR). No environmental parameter correlated with SBI values, but sludge age affected the SBI value. Conclusion: In both the conventional treatment system and the MBR, the average SBI values indicate good performance and high-quality activated sludge.
Keywords: Protozoa, metazoa, bioindication, activated sludge, MBR, ciliates, flagellates, SBI.
|
RESUMEN. Introducción: El monitoreo biológico en los sistemas de tratamiento de aguas residuales por lodos activados ofrece resultados integrales y es una herramienta complementaria en las decisiones de control operacional. Una herramienta para ello es el Índice Biológico de Lodos (IBL), basado en protozoos, pero en Costa Rica hay pocos datos sobre este tema. Objetivo: Evaluar el IBL como herramienta de bioindicación en agua residual hospitalaria. Métodos: De febrero a abril de 2022 tomamos, en un hospital costarricense, un total 36 muestras de un sistema de tratamiento por lodos activados Convencional y de un Biorreactor de Membrana (MBR). Resultados: La eficiencia de remoción del DBO y DQO fue mayor en el MBR, sin embargo, en ambos casos la eficiencia fue alta (mayor al 85%), y esto se relaciona con los altos valores de IBL. La eficiencia de remoción nitrógeno no superó el 50% (MBR). Ningún parámetro ambiental tuvo correlación con los valores de IBL, pero la edad del lodo afectó el valor de IBL. Conclusión: Tanto en el sistema de tratamiento convencional como en el MBR, los valores promedio de IBL demuestran un buen desempeño y una alta calidad de los lodos activados.
Palabras clave: protozoos, metazoos, bioindicación, lodos activados, MBR, ciliados, flagelados, IBL.
|
Las plantas de tratamiento de aguas residuales con procesos de lodos activados son los sistemas más extendidos en el mundo (Leal et al., 2013; Rodríguez et al., 2019; Zornoza et al., 2010; Zornoza, 2015). Dentro del proceso de tratamiento por lodos activados existen múltiples variaciones, y entre las más importantes se pueden mencionar a la aireación convencional y la extendida. La principal diferencia entre ambas variaciones radica en los valores operacionales que se espera obtener a través del cálculo de la relación Alimento / Microorganismo (A/M) y la edad de lodo (Von Sperling, 2007).
Un proceso modificado del tratamiento con lodos activados, y que a su vez utiliza una tecnología más avanzada, es el biorreactor de membrana (MBR). En un MBR el lodo activado crece en suspensión, pero se utilizan membranas con microporos que generan una separación entre la interfaz líquida y sólida, prescindiendo del uso de sedimentadores secundarios. Según el tamaño de los microporos contenidos en las membranas, los MBR pueden llevar a cabo procesos de microfiltración, ultrafiltración o nanofiltración (Marín & Osés, 2013; Radjenović et al., 2008).
La masa microbiana involucrada en la formación del lodo activado es conformada principalmente por bacterias y protozoos (Bento et al., 2005; Madoni, 2011; Von Sperling, 2007). Los protozoos son organismos eucariotas que comprenden un tamaño de entre 2 a 2 000µm (Sowinska et al., 2017). En los lodos activados se han registrado un total de 228 especies de protozoos (Curds, 1975), de los cuales 160 pertenecen al filo Ciliophora (Madoni, 2011). Aunque en menor medida, además de los protozoos, existen metazoos como los rotíferos, gastrotricos y nematodos que llegan a colonizar el lodo activado (Arregui et al., 2013; Madoni, 1994; Sowinska et al., 2017).
Como cualquier comunidad biológica, la comunidad de protozoos y metazoos presentes en los lodos activados puede verse limitada por distintos factores ambientales y operacionales de los sistemas de tratamiento. Los factores que más suelen limitar la abundancia y composición de estas comunidades son la falta de aireación, la temperatura, el exceso del lodo, la edad del lodo, y la presencia de sustancias tóxicas o choques de cargas contaminantes (Madoni, 2011; Zornoza et al., 2010).
Conocer la abundancia, diversidad y estructura de la comunidad de microorganismos que habitan los lodos activados sirve como guía para evaluar el nivel de funcionamiento del sistema y la calidad del efluente que genera (Rodríguez et al., 2019). Existen tres índices biológicos utilizados para identificar y cuantificar la microfauna que se encuentra en el lodo activado de las plantas de tratamiento de aguas residuales: el Índice de Shannon (H), el Índice de lodos (IL) y el Índice biológico de lodos (IBL) (Arregui et al., 2013).
La desventaja del Índice de Shannon (H) radica en que se trata de un índice que no es específico para lodos activados; sin embargo, se apoya en fundamentos ecológicos universales (Arregui et al., 2013; Rodríguez et al., 2019). Por otra parte, el Índice de lodos (IL) fue desarrollado por Jiménez et al. (2001) y consiste en una evaluación integral preliminar del lodo activado utilizando parámetros macroscópicos, tales como la turbiedad, suspensión y olor; así como parámetros microscópicos como la morfología del flóculo, la estructura del flóculo, la cantidad de bacterias filamentosas y la diversidad de especies protozoos. Por último, el Índice Biológico de lodos (IBL), desarrollado por Madoni (1994), se enfoca en el componente biológico del lodo y se dedica a la cuantificación y distribución de los principales grupos de protozoos encontrados en el lodo activado. Este índice hace posible obtener un valor numérico asociado a la calidad del lodo a través de la determinación del número total de protozoos y metazoos, así como su dominancia y diversidad (Arregui et al., 2013; Madoni, 1994; Rodríguez et al., 2019).
Tanto el IL como el IBL han resultado ser idóneos para la evaluación del desempeño de plantas de tratamiento por lodos activados (Pedrazzani et al.,2016). Para Costa Rica, únicamente se ha aplicado el IL en la caracterización de dos plantas de tratamiento de agua municipal (Alfaro-Arrieta, 2020).
El IBL es el índice que utilizamos en esta investigación. Este índice es uno de los más usados en el control biológico de plantas de tratamiento (Foissner, 2016; Zornoza et al., 2010); además, ha demostrado ser un índice robusto en el control y la bioindicación del lodo activado debido a la baja variabilidad de sus resultados entre distintos laboratorios (Arregui et al., 2012). Con el IBL, Madoni (1994, 2011) propone un índice objetivo para el análisis de la calidad biológica de los lodos activados, el cual se basa en dos postulados fundamentales:
a) La presencia y dominancia de algunos grupos de microfauna se relaciona con ciertas características fisicoquímicas y operacionales presentes en los sistemas de tratamiento.
b) El número de especies de microfauna se reduce conforme el desempeño del sistema de tratamiento empeora.
Algunos de los factores particulares que se han relacionado directamente con los postulados del IBL, y, por lo tanto, han constatado la funcionalidad de este índice, son: los patrones de aireación en el sistema de tratamiento y la concentración de los lodos en el tanque de aireación (derivando a la edad del lodo) (Sowinska et al., 2017).
A través del uso del IBL en la evaluación de sistemas de tratamiento de lodos activados, se ha podido comprobar la existencia de una relación entre la abundancia de flagelados y la baja calidad del agua tratada obtenida. Al mismo tiempo, esa alta abundancia y densidad de flagelados se encuentra relacionada con una sobrecarga orgánica entrante al sistema, así como una baja sedimentabilidad del lodo (Bento et al., 2005; Jordão et al., 1997). Por otro lado, también se ha corroborado que ciertas especies de ciliados son los mejores indicadores de la calidad del efluente tratado (Colorado et al., 2012). Los cambios en las condiciones operacionales pueden llegar a alterar la composición de las comunidades de microfauna, así como la red trófica que éstas sostienen en los lodos activados; por lo tanto, una estructura determinada de la comunidad de protozoos y metazoos es indicadora de las condiciones de funcionamiento de la planta de tratamiento de aguas residuales (Nicolau et al., 2001; Rodríguez et al., 2019; Zhou et al., 2006).
El control del proceso de tratamiento de las aguas residuales se da a través de la estimación de múltiples parámetros operacionales. Entre los más importantes y ampliamente utilizados en un proceso de tratamiento por lodos activados podemos mencionar a la relación Alimento / Microorganismos (A/M) que se utiliza para expresar la carga de materia orgánica presente en el reactor de aireación por unidad de biomasa (Marín & Osés, 2013; Von Sperling, 2007) y la edad del lodo. La edad del lodo es un parámetro fundamental, no solo para las condiciones operativas, sino también para el diseño de cualquier sistema de tratamiento en general (Von Sperling, 2007).
La relación A/M y la edad del lodo resultan ser factores particularmente importantes para las comunidades de protozoos y metazoos, ya que determinan la cantidad de alimento o materia orgánica disponible y el tiempo con el que cuentan estos microorganismos para reproducirse. Adicionalmente, ambos parámetros se relacionan con la abundancia de protozoos y metazoos en los lodos activados (Al-Shahwani & Horan, 1991; Marín & Osés, 2013).
Además, ciertas condiciones ambientales que se dan en el reactor de aireación, como la concentración de oxígeno disuelto, el pH y la temperatura, resultan determinantes en la abundancia y diversidad de especies de protozoos y metazoos que colonizan los lodos activados (Babko et al., 2014; Parada-Albarracín et al., 2010). Sin embargo, también se ha identificado que la concentración de nitrógeno, fósforo, DQO y DBO en el agua cruda que ingresa a las plantas de tratamiento son parámetros para considerar como influyentes en la estructura de los flóculos y las relaciones tróficas que pueden desarrollarse en el reactor de aireación.
La implementación de un monitoreo biológico de rutina que permita obtener un valor de IBL, ofrece resultados de manera inmediata e integral, siendo una herramienta complementaria de análisis para la toma de decisiones de control operacional en los sistemas de tratamiento por lodos activados. Por lo tanto, con esta investigación buscamos evaluar el funcionamiento del Índice Biológico de Lodos (IBL) como herramienta de bioindicación para reflejar la calidad del agua tratada que generan los sistemas de tratamiento de agua residual hospitalaria. Al mismo tiempo, analizamos las relaciones existentes entre el IBL y los parámetros fisicoquímicos, ambientales y operacionales en estos sistemas.
MATERIALES Y MÉTODOS
Sitio de muestreo: Evaluamos dos sistemas de tratamiento de aguas residuales: una planta de tratamiento de aguas residuales de lodos activados convencional (Convencional) y un sistema de tratamiento piloto de Biorreactor de Membrana (MBR). Ambos sistemas se alimentan de la misma agua residual cruda que genera el Hospital San Vicente de Paul (HSVP) de la Caja Costarricense del Seguro Social (CCSS), un hospital regional del cantón central de la provincia de Heredia, Costa Rica.
El HSVP (9°59’30,6’’N, 84°07´19,5’’W) brinda servicios médicos en todas las especialidades, además de consulta externa, hospitalización y atención de emergencias durante 24 horas, los siete días de la semana. La población adscrita a este hospital es de aproximadamente 560 000 personas (Caja Costarricense del Seguro Social [CCSS], 2021).
El sistema Convencional del HSVP opera desde el año 2010 con un caudal de diseño de 300m3/día que trabaja de manera estable. Este sistema cuenta con dos módulos de tratamiento secundario, y se compone de las siguientes unidades de tratamiento: rejillas, desarenador, tanque de homogenización, dos tanques de aireación, dos sedimentadores secundarios, digestor de lodos, prensa deshidratadora del lodo, tanque de contacto con cloro y vertedero de salida (Fig. 1).
El sistema piloto MBR se instaló durante el año 2021 e inició su puesta en marcha y ejecución durante el mes de febrero del 2022. El sistema piloto de MBR está diseñado para recibir un caudal diario de 15m3/día. La membrana se da con disposición sumergida, con un tamaño de poro que permite la ultrafiltración (Fig. 1).

Fig. 1. Sitio de muestreo: A. Sistema de tratamiento de aguas residuales de lodos activados convencional (Convencional) y B. Sistema piloto de tratamiento de Biorreactor de Membrana (MBR).
Muestreos: Llevamos a cabo muestreos en cada uno de los sistemas (Convencional y MBR) dos veces a la semana durante un periodo de dos meses, para un total de 36 muestreos. Las fechas de los muestreos fueron: 15, 17,22 y 24 de febrero, 08, 10, 15, 17, 22, 24, 29, 31 de marzo y 05, 07, 19 y 21 de abril del 2022.
Paralelamente, en estos muestreos tomamos datos de los parámetros fisicoquímicos, los parámetros ambientales y las muestras biológicas para el análisis de los protozoos y metazoos presentes en el lodo activado. La toma y análisis de las muestras biológicas nos permitió realizar el cálculo del IBL a través del tiempo para ambos sistemas, según Madoni (1994).
Toma de muestras y análisis de los parámetros fisicoquímicos: Un laboratorio acreditado y especializado en aguas residuales tomó muestras compuestas de los parámetros fisicoquímicos en: a) el agua cruda que ingresa (afluente) y, b) el agua tratada que sale del sistema (efluente); esto con el fin de evaluar la calidad del agua cruda que ingresa, así como la eficiencia de remoción de los parámetros analizados en cada uno de los sistemas bajo estudio. La fórmula mediante la cual estimamos el porcentaje de remoción para cada parámetro fisicoquímico analizado es la siguiente:
|
|
Ecuación 1 |
Donde
E = Eficiencia de remoción (%)
Co = concentración del contaminante en el afluente (agua cruda) (mg/L)
Ce: concentración del contaminante en el efluente (agua tratada) (mg/L)
El punto a) fue el mismo para ambos sistemas (Convencional y MBR), ya que el origen del agua residual con que se alimentan es el mismo; mientras que existen dos puntos b), uno para el sistema Convencional y otro para el MBR. Los parámetros fisicoquímicos que muestreamos en ambos puntos fueron: Demanda Bioquímica de Oxígeno (DBO), Demanda Química de Oxígeno (DQO), Sólidos Suspendidos Totales (SST), Nitrógeno (N) y Fósforo (P).
El muestreo fue compuesto de seis horas, y basado en los métodos de referencia del manual Standard Methods for the Examination of Water and Wastewater (Baird, et al., 2017). Un laboratorio acreditado tomó una submuestra por hora con un volumen de 1 400mL cada una, y posteriormente se mezclan estas seis submuestras para formar una muestra cada día por parámetro. El análisis de estos parámetros fue llevado a cabo por un laboratorio acreditado por el Ente Costarricense de Acreditación (ECA).
Una vez con los resultados para cada parámetro, pudimos calcular el porcentaje de remoción (%) de cada uno de los parámetros (DBO, DQO, SST, N y P), lo cual nos permitió comparar los resultados, y por lo tanto el desempeño, entre sistemas de tratamiento.
Toma de muestras de los parámetros ambientales: En cada uno de los sistemas de tratamiento llevamos a cabo el análisis de los siguientes parámetros ambientales: pH, temperatura y oxígeno disuelto. Los datos los obtuvimos mediante el uso de un medidor de pH HI 9813-6 marca Hanna (pH y temperatura), mientras que para obtener la concentración de oxígeno disuelto en el tanque de aireación utilizamos un medidor portátil HI 9146 marca Hanna. La toma de los parámetros ambientales la realizamos dos veces a la semana, los mismos días de la toma de las muestras fisicoquímicas y biológicas. La toma de estas muestras la llevamos a cabo en el reactor de aireación de cada sistema de tratamiento, cerca de superficie y en un punto que contara con suficiente agitación (que no fuera una zona muerta).
Toma de muestras y cálculo de los parámetros operacionales: En este estudio consideramos los siguientes parámetros operacionales: relación Alimento/Microorganismos (A/M) y edad del lodo. Para poder calcular el valor del A/M y edad del lodo, es necesario contar con el dato de la concentración de Sólidos Suspendidos en el Licor de Mezcla (SSLM) y de Sólidos Suspendidos Volátiles en el Licor de Mezcla (SSVLM) en cada tanque de aireación.
Para esto, el mismo laboratorio acreditado que realizó los muestreos de parámetros fisicoquímicos tomó una muestra compuesta en cada tanque de aireación, con el fin de determinar la concentración de SSLM y SSVLM. Esto significa que se tomó una muestra compuesta de seis horas dos veces a la semana. El muestreo y análisis de estos parámetros se realizó utilizando como referencia el manual Standard Methods for the Examination of Water and Wastewaters (Baird, et al., 2017).
Los valores de la relación A/M y de la edad del lodo lo determiné mediante las siguientes ecuaciones:
|
|
Ecuación 2 |
Donde,
A/M = Relación Alimento / Microorganismos
Qa = Caudal de ingreso del agua cruda al sistema (afluente).
kg DBO= Kilogramos de Demanda Bioquímica de Oxígeno (DBO)
Vr = Volumen del reactor de aireación.
SSVLM = Sólidos Suspendidos Volátiles en Lodo Activado.
|
|
Ecuación 3 |
Donde,
ϴc= Tiempo medio de retención celular (edad del lodo)
Vr = Volumen del reactor de aireación.
SSVLM = Sólidos Suspendidos Volátiles en Lodo Activado
SSVLd = Sólidos Suspendidos Volátiles del lodo de purga.
SSVe = Sólidos Suspendidos Volátiles en el efluente.
Qd = Caudal de purga.
Qe = Caudal del agua tratada (efluente).
Toma de muestras biológicas: Aplicamos el protocolo para la toma de muestras biológicas, así como su transporte y análisis, según Rodríguez et al. (2019). La toma de muestras para el análisis biológico la llevamos a cabo en el tanque de aireación (lodo activado) de cada sistema de tratamiento, mediante el uso de un muestreador con vara larga. La toma de estas muestras la realizamos los mismos días que los muestreos fisicoquímicos, dos veces a la semana.
Durante cada muestreo, recolectamos en botellas plásticas de un litro una muestra compuesta por dos puntos distintos de cada tanque de aireación, en donde la agitación era homogénea. Transportamos las muestras hasta el laboratorio en hielera con oxigenación mediante un motor de pecera que transmite el oxígeno por una manguera hasta una piedra porosa. Durante el transporte procuramos la mayor estabilidad de la muestra, evitando la refrigeración y la agitación excesiva. Es ideal que la observación de la muestra al microscopio las realizamos en las próximas cinco horas después de su recolecta. Sin embargo, es aceptable el análisis de una muestra bajo aireación incluso 48 horas después de que ha sido recolectada (Rodríguez et al., 2019). Utilizamos un microscopio de contraste a 40x y 100x para observar tres réplicas de 25µL. Para el conteo de flagelados, observamos tres réplicas de 3,5µL de cada muestra utilizando una placa Neubauer mejorada.
A partir del análisis de cada muestra analizamos los siguientes aspectos: grupo dominante, densidad total de organismos, número de taxones identificados y recuento de flagelados (Madoni, 1994, Rodríguez et al., 2019).
Índice Biológico de Lodos (IBL): Calculamos el índice Biológico de Lodos (IBL) para cada muestra biológica en el tanque de aireación basados en el procedimiento establecido por Madoni (1994). Estimar la abundancia de la microfauna (protozoos y metazoos), tal y como se describe en la sección anterior (Toma de muestras biológicas), nos permitió asignarle un valor del 1 al 10 al IBL calculado, y a su vez clasificar este valor en Clases del I al IV. Estas Clases se asocian al desempeño del sistema de tratamiento.
La interpretación del IBL la obtuvimos a partir de dos matrices elaboradas por Madoni (1994) y que se presentan en la Tabla 1 y Tabla 2.
TABLA 1
Matriz para la determinación del Índice Biológico de Lodos (IBL)
|
Grupo dominante y densidad de la microfauna que define la línea horizontal de entrada en tabla |
Número de unidades taxonómicas totales que constituyen la microfauna presente en el lodo activado, y número de flagelados (F) contados en la cámara Fuchs-Rosenthal |
|||||||||
|
Grupo dominante |
Densidad |
>10 |
8-10 |
5-7 |
<5 |
|||||
|
F< 10 |
10< F < 100 |
F< 10 |
10< F < 100 |
F< 10 |
10< F < 100 |
F< 10 |
10< F < 100 |
|||
|
Ciliados y/o amebas testáceas (rastreras + sésiles) * |
≥ 106 |
10 |
8 |
9 |
7 |
8 |
6 |
7 |
5 |
|
|
< 106 |
9 |
7 |
8 |
6 |
7 |
5 |
6 |
4 |
||
|
Ciliados sésiles (>80%) * |
≥ 106 |
9 |
7 |
8 |
6 |
7 |
5 |
6 |
4 |
|
|
< 106 |
8 |
6 |
7 |
5 |
6 |
4 |
5 |
3 |
||
|
Opercularia spp. |
≥ 106 |
7 |
5 |
6 |
4 |
5 |
3 |
4 |
2 |
|
|
< 106 |
6 |
4 |
5 |
3 |
4 |
2 |
3 |
1 |
||
|
Vorticella microstoma |
≥ 106 |
6 |
4 |
5 |
3 |
4 |
2 |
3 |
1 |
|
|
< 106 |
5 |
3 |
4 |
2 |
3 |
1 |
2 |
0 |
||
|
Ciliados bacterívoros nadadores |
≥ 106 |
5 |
3 |
4 |
2 |
3 |
1 |
2 |
0 |
|
|
< 106 |
4 |
2 |
3 |
1 |
2 |
0 |
1 |
0 |
||
|
Flagelados nadadores pequeños + |
≥ 106 |
4 |
3 |
2 |
1 |
|||||
|
< 106 |
3 |
2 |
1 |
0 |
||||||
|
*Opercularia y Vorticella no son abundantes |
||||||||||
|
+En la placa Fuchs-Rosenthal |
||||||||||
TABLA 2
Conversión de los valores del Índice Biológico de Lodos (IBL) a clases de calidad, así como el criterio respectivo
|
Valor del IBL |
Clase |
Criterio |
|
8-10 |
I |
Lodo estable y muy bien colonizado, excelente actividad biológica. Muy buen desempeño |
|
6-7 |
II |
Lodo estable y bien colonizado, actividad biológica decaída. Buen desempeño |
|
4-5 |
III |
Depuración biológica insuficiente en el tanque de aireación. Desempeño mediocre. |
|
0-3 |
IV |
Depuración biológica pobre en el tanque de aireación. Bajo desempeño. |
Para el resultado obtenido del IBL debimos de considerar únicamente los organismos cuya frecuencia relativa de aparición en las muestras biológicas sea superior a 20% (Zornoza, 2015).
Análisis de datos: El programa estadístico que utilizamos para el análisis de los resultados fue Rstudio en su versión 4,2,3.
Utilizamos la prueba de Shapiro-Wilk para comprobar la normalidad de los datos obtenidos. En caso de que los datos no se ajustaran a la normalidad, procedimos a llevar a cabo las transformaciones necesarias para evaluar si es posible que los datos presenten un comportamiento normal.
Con pruebas T Student (t) comprobamos si existían diferencias significativas entre los valores promedio obtenidos de un parámetro particular entre sistemas de tratamiento. En caso de que los datos no cumplieran el supuesto de normalidad, los analizamos mediante la prueba U de Mann Whitney (W) para comparación de medianas.
El análisis estadístico para verificar las correlaciones entre el IBL y los parámetros (fisicoquímicos, ambientales y operacionales) fue un ANCOVA. De esta forma, nos fue posible determinar si existe una interacción entre cada parámetro y los dos sistemas de tratamiento respecto a su respuesta como valor de IBL. O bien, si se da una relación similar del IBL con el parámetro en ambos sistemas. Es importante mencionar que el IBL funciona como una variable respuesta ante los parámetros ambientales y operacionales. Además, realizamos otras pruebas de ANCOVA donde los parámetros fisicoquímicos (eficiencias de remoción de DBO, DQO, SST, Nitrógeno y Fósforo) serían variables respuesta ante el valor del IBL obtenido respecto a los dos sistemas de tratamiento.
Para los valores IBL no nos fue posible obtener la normalidad de los datos. Debido a la no normalidad de los datos de IBL, y a que el IBL representa la variable respuesta para los parámetros ambientales y operacionales, procedimos con la conversión de los datos a rangos, para así poder realizar análisis de ANCOVA adecuados con estos parámetros. El análisis de la ANCOVA en rangos es un método para producir resultados robustos a pesar de que no se cumplan las asunciones para la aplicación de esta prueba (Quinn & Keough, 2002).
Con el programa estadístico R comprobamos los supuestos de la ANCOVA mediante las siguientes pruebas: la prueba Breuch-Pagan para el análisis de la homocedasticidad de las varianzas de la regresión, la prueba Jarque-Bera para el análisis de la normalidad de la regresión, la prueba Barlet para el análisis de la homogeneidad de las varianzas entre los tratamientos, y la prueba de Shapiro Wilk para el análisis de los residuos entre los tratamientos. El resumen de los resultados de estas pruebas se encuentra en el Apéndice 2.
RESULTADOS
Parámetros fisicoquímicos: El sistema de tratamiento Convencional fue un 68,37% más eficiente en la remoción del fósforo (P) y un 10,88% más eficiente en la remoción de nitrógeno (N), en comparación con el sistema MBR. Mientras que el MBR fue un 17,92% más eficiente en la remoción de Sólidos Suspendidos totales, más eficiente en la remoción de Demanda Bioquímica de Oxígeno (DBO) (12,46%) y de Demanda Química de Oxígeno (DQO) (4,24%) que el sistema de tratamiento Convencional (Tabla 3).
TABLA 3
Descriptores de parámetros fisicoquímicos en los tanques de aireación de cada sistema de tratamiento (Convencional y MBR)
|
Parámetro fisicoquímico |
Sistema de tratamiento Convencional |
Sistema de tratamiento por MBR (%) |
|||
|
Promedio (% remoción) (±D.E.) |
Mediana (% remoción) |
Promedio (% remoción) (±D.E.) |
Mediana (% remoción) |
||
|
DBO |
85,36(±12,72) |
86,55 |
98,45(±1,56) |
98,82 |
W=12, p≤0,001 |
|
DQO |
88,10(±9,88) |
92,24 |
94,57(±4,28) |
96,47 |
W=54, p=0,004 |
|
SST |
79,78(±18,32) |
87,67 |
97,70(±1,65) |
98,12 |
W=7, p≤0,001 |
|
Nitrógeno |
61,43(±15,97) |
58,91 |
50,55(±15,41) |
53,91 |
t=1.96 p=0,059 |
|
Fósforo |
49,69(±39,65) |
57,50 |
-12,21(±50,74) |
-10,87 |
W=217, p≤0,001 |
Parámetros ambientales: Con el análisis de los datos ambientales encontramos que, en promedio, el sistema de tratamiento de MBR es levemente más ácido y con mucho más oxígeno disuelto disponible, que el sistema de tratamiento Convencional. Por otro lado, la temperatura es más alta en el sistema de tratamiento Convencional en comparación con el MBR (Tabla 4).
TABLA 4
Descriptores de parámetros ambientales en los tanques de aireación de cada sistema de tratamiento (Convencional y MBR)
|
Parámetro ambiental |
Sistema de tratamiento Convencional |
Sistema de tratamiento por MBR |
Prueba U Mann Whitney o T Student |
||
|
Promedio (± D.E.) |
Mediana |
Promedio (±D.E.) |
Mediana |
|
|
|
pH |
7,09(±0,29) |
7,10 |
6,38(±0,49) |
6,36 |
t=5,02, p≤ 0,001 |
|
Temperatura (ºC) |
27,91(±0,84) |
28,02 |
25,55(±1,53) |
25,40 |
t=5,38, p≤ 0,001 |
|
Oxígeno disuelto (ppm) |
0,30(±0,25) |
0,25 |
2,31(±1,70) |
1,93 |
W=6,5, p≤0,001 |
Parámetros operacionales: El sistema de tratamiento Convencional presentó un promedio de edad del lodo mucho mayor que el MBR. Mientras que el MBR obtuvo un promedio de relación A/M mayor en comparación con el sistema Convencional (Tabla 5).
El valor promedio de los Sólidos Suspendidos Volátiles de Licor de Mezcla (SSVLM) fue de 1 486,12 (±950,02) mg/l en el sistema de tratamiento Convencional y de 1 830,37 (±1 204,79) mg/l en el sistema MBR. El valor de SSVLM en cada reactor de aireación analizado es necesario para el cálculo de la edad del lodo.
TABLA 5
Descriptores de los parámetros operacionales calculados para cada sistema de tratamiento (Convencional y MBR)
|
Parámetro operacional |
Sistema de tratamiento Convencional |
Sistema de tratamiento por MBR |
Prueba U Mann Whitney o T Student |
||
|
Promedio (± D.E.) |
Mediana |
Promedio (± D.E.) |
Mediana |
||
|
Relación A/M |
0,43(±0,87) |
0,18 |
1,04(±1,09) |
0,61 |
W=60, p=0,011 |
|
Edad del lodo (días) |
2329,56(±153,89) |
2336,14 |
86,73(±157,44) |
29,60 |
t=-4,87, p<0,001 |
Índice Biológico de Lodos (IBL): La cantidad promedio de taxones presente en las muestras del sistema de tratamiento Convencional fue de 8,4 taxones, mientras que para el MBR fue de 11,7 taxones. Además, en el sistema de tratamiento Convencional contabilizamos un total de 4 349 protozoos, mientras que en el MBR fueron 15 288 (Tabla 6).
TABLA 6
Cantidad total de protozoos según la clasificación de grupos funcionales del IBL para cada uno de los sistemas de tratamiento
|
Grupo funcional de protozoos |
Sistema Convencional |
Sistema MBR |
|
Ciliados reptantes y/o amebas testáceas |
2 975 |
14 491 |
|
Ciliados sésiles |
85 |
110 |
|
Vorticella sp. |
967 |
389 |
|
Ciliados nadadores |
3 |
46 |
|
Flagelados pequeños |
319 |
252 |
|
Total |
4 349 |
15 288 |
El sistema de tratamiento Convencional por lodos activados se encuentra clasificado entre Clase I y Clase II (Tabla 2; Tabla 7), presentando un buen desempeño y una buena actividad biológica en su tanque de aireación. Mientras que el sistema de tratamiento MBR se clasifica como Clase I, es decir, es un sistema con un desempeño muy bueno y con una actividad biológica excelente y saludable. Además, comprobamos que los valores de mediana para el IBL obtenidos para cada uno de los tratamientos resultaron similares (W=93, p=0,166, Tabla 6), esto quiere decir que ambos sistemas pueden considerarse de Clase I según el IBL. Se presenta el desglose realizado para alcanzar la determinación de este valor. (Apéndice 1)
Encontramos que se asocian al valor IBL, tanto el porcentaje de remoción del DBO (p=0,031) como el del DQO (p=0,005). Y a su vez, ambos porcentajes de remoción cambian su valor según el sistema de tratamiento (p ≤0,001). Además, para el porcentaje de remoción del DQO, encontramos una relación entre los tratamientos y el valor de IBL obtenido (p=0,010). Con respecto al porcentaje de remoción del nitrógeno, pudimos comprobar que su valor depende del IBL (p=0,03) (Fig. 2).
TABLA 7
Promedio del Índice Biológico de Lodos (IBL) para cada muestreo según el sistema de tratamiento (Convencional y MBR)
|
Muestreo |
Promedio del IBL para el sistema de tratamiento Convencional |
Promedio del IBL para el sistema de tratamiento MBR |
|
1 |
8 |
10 |
|
2 |
9 |
10 |
|
3 |
9 |
10 |
|
4 |
8 |
8 |
|
5 |
10 |
7 |
|
6 |
9 |
8 |
|
7 |
8 |
8 |
|
8 |
7 |
8 |
|
9 |
8 |
8 |
|
10 |
7 |
10 |
|
11 |
7 |
8 |
|
12 |
7 |
8 |
|
13 |
7 |
8 |
|
14 |
7 |
8 |
|
15 |
10 |
8 |
|
16 |
1 |
8 |
|
PROMEDIO |
7,62 |
8,44 |
|
MEDIANA |
8,00 |
8,00 |
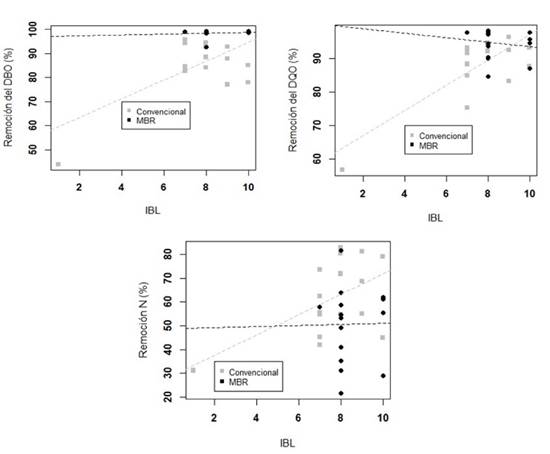
Fig. 2. ANCOVA del porcentaje de remoción del DBO, DQO y Nitrógeno en el sistema de tratamiento Convencional y en el Biorreactor de Membrana (MBR)
Para evaluar el efecto que pueden tener los parámetros ambientales (pH, temperatura y oxígeno disuelto) sobre los valores de IBL obtenidos, también aplicamos análisis de ANCOVA. Sin embargo, no hubo ninguna relación entre los tratamientos (p>0,05), ni tampoco con el IBL (p>0,05).
Utilizamos el análisis ANCOVA para evaluar el efecto de los parámetros operacionales sobre el resultado del IBL. Para el caso de la relación A/M no encontramos ninguna asociación (p>0,05), mientras que para la edad del lodo sí; una tendencia a una relación entre el IBL y el tipo de sistema de tratamiento (p=0,052). Así como una relación que evidencia cómo los valores de IBL obtenidos dependen de parámetro edad del lodo (p=0,013) (Fig. 3).

Fig. 3. ANCOVA de IBL y su relación con el parámetro operacional Edad del Lodo (días) en el sistema de tratamiento Convencional y en el MBR
DISCUSIÓN
Hay que recordar que el Índice Biológico de Lodos (IBL) es un índice que se basa en la clasificación de los grupos dominantes de la microfauna y sus densidades; y, por lo tanto, asume que, a mayor cantidad y densidad de microorganismos, de mayor calidad será el agua tratada obtenida (Arregui et al., 2013; Madoni, 1994). De hecho, otros investigadores han asociado una mayor eficiencia de remoción de parámetros como la Demanda Bioquímica de Oxígeno (DBO) y la Demanda Química de Oxígeno (DQO), con una mayor densidad de protozoos en el lodo activado de los sistemas de tratamiento de agua residual (Bento et al., 2005; Martín-Cerceda et al., 1996). Esto es congruente con los resultados de esta investigación, en donde observamos que el porcentaje de remoción del DBO y del DQO se asocia con los valores del IBL.
Por otro lado, se ha observado que sucede lo contrario con la eficiencia de remoción de los Sólidos Suspendidos Totales (SST), ya que, al existir una mayor densidad de microorganismos, sobre todo de microflagelados, se incrementa la turbidez de la muestra del efluente (Bento et al., 2005; Madoni, 1994; Salvadó et al., 1995). En este estudio no observamos asociación entre el porcentaje de remoción de los SST y el valor del IBL. Sin embargo, encontramos un valor de remoción de SST 17,92% menor en el sistema de tratamiento Convencional en comparación con el MBR; debido probablemente a la naturaleza semipermeable de los sistemas de membrana, que a la vez permiten retener todos los sólidos suspendidos con tamaño mayor al tamaño de su poro (Radjenović et al., 2008).
Además, en contraposición a lo que reporta Wen et al. (2004), el porcentaje de remoción de nitrógeno en el biorreactor de membrana (MBR) no fue eficiente, al no superar el 50,55% en promedio, y siendo un valor incluso menor al promedio del porcentaje de remoción promedio obtenido por el sistema Convencional (61,43%). Más bien, estos resultados muestran estar acorde a otras investigaciones científicas que han indicado que las eficiencias de remoción del nitrógeno amoniacal son similares entre ambos tipos de tratamiento (Yin & Xagoraraki, 2014). Esto a pesar de que en este estudio el MBR cuenta con un sistema de desnitrificación, ya que presenta un mecanismo para propiciar la remoción de nitrógeno mediante la recirculación del lodo activado hacia un tanque contactor anóxico ubicado al inicio del sistema.
Otras investigaciones afirman que la composición de la comunidad de protozoos (cantidad y diversidad) presente en sistemas de tratamiento avanzado para la eliminación de nitrógeno es distinta a la de otros sistemas de tratamiento de agua residual (Arregui et al., 2013; Pérez-Uz et al., 2010). Estos estudios asocian una buena eficiencia de nitrificación, con alta presencia de amebas y flagelados como Bodo saltans. Sin embargo, para el sistema de tratamiento de MBR en este estudio, al igual que para el sistema de tratamiento Convencional, el grupo dominante según el IBL fueron los ciliados reptantes y/o amebas testáceas, y no los flagelados pequeños. La dominancia de algunas especies de ciliados reptantes como Aspidisca sp. indican que los procesos de nitrificación se dan en el tanque de aireación (Bento et al., 2005). Por otro lado, Radjenović et al. (2008) comenta que para que existan niveles satisfactorios de nitrificación en los sistemas de tratamiento de MBR, es necesario que el oxígeno disuelto sea suficiente, sin disminuir sus niveles óptimos, dado que muchas de las bacterias que participan en el proceso de nitrificación como Nitrosomas sp., necesitan condiciones aerobias para desarrollarse.
Otro nutriente presente en los sistemas de tratamiento de aguas residuales es el fósforo. La eliminación del fósforo en aguas residuales se da hasta cierto punto de forma natural en los lodos activados debido no solo a la presencia de bacterias acumuladoras de fosfato, sino también gracias a los polímeros extracelulares que componen los flóculos (Abzazou et al., 2017; Rodríguez et al., 2019). Así mismo, la eliminación del fósforo en las aguas residuales se potencia mediante condiciones anaerobias y aerobias alternas (Abzazou et al., 2017). Los dos sistemas que estudiamos no contemplaban unidades ni condiciones de tratamiento específicas para la remoción de fósforo, y esto se evidencia con porcentajes de remoción del fósforo bajos o incluso negativos para el caso del MBR. Adicionalmente, no obtuvimos ninguna relación entre el porcentaje de remoción del fósforo y el IBL. Esto concuerda con investigaciones previas que han hecho los mismos análisis entre este parámetro y el IBL (Kepec et al., 2020).
La naturaleza de las actividades que se llevan a cabo en los centros médicos u hospitales implica que las aguas residuales de estos establecimientos contienen cantidades importantes de sustancias químicas, farmacológicas y patogénicas. Estas sustancias son clasificadas como contaminantes emergentes, y muchas de ellas, incluso después del proceso de tratamiento, continúan presentes en el agua tratada (Jirova et al., 2016). Debido a que el sistema de tratamiento Convencional no tiene la capacidad de eliminar este tipo de contaminantes, no evaluamos la eficiencia de los sistemas de tratamiento en términos de remoción de contaminantes emergentes. Al comparar el desempeño del MBR frente a sistemas de tratamiento lodos activados para depurar aguas residuales hospitalarias, Yin y Xagoraraki (2014) han señalado que el MBR funciona mejor para la remoción de patógenos.
Todos los parámetros ambientales analizados (pH, temperatura y oxígeno disuelto) fueron distintos entre sistemas de tratamiento, pero ninguno de estos parámetros mostró tener efecto sobre los valores de IBL obtenidos. Esto no coincide con la afirmación de Drzewicki y Kulikowska (2011) y Foissner (2016), quienes señalan que la dominancia de ciertos grupos tróficos en el lodo activado depende de la concentración de oxígeno. El nivel de oxígeno disuelto pudo haber influido en la diferencia del IBL obtenido entre tratamientos, ya que el promedio del oxígeno disuelto en el tanque de aireación del sistema de tratamiento Convencional fue notoriamente inferior (0,30ppm) al promedio en el MBR (2,31ppm), presentando valores incluso por debajo del valor recomendado para que este tipo de sistemas operen de forma adecuada (Von Sperling, 2007). Adicionalmente, la temperatura es un parámetro que influye en las reacciones metabólicas que se dan en cualquier ecosistema, consumiendo el oxígeno disuelto disponible (Von Sperling, 2007); esto se reflejó en el sistema de tratamiento Convencional, en donde la temperatura fue significativamente mayor que en el MBR, pero los niveles de oxígeno disuelto fueron mucho menores.
Por su parte, Zornoza et al. (2010), indican que la estructura de la comunidad y la densidad de protozoos y metazoos en el lodo activado se ve influenciada por la temperatura, debido a que este parámetro potencia muchas de las reacciones en el agua. Babko et al. (2014) y Bento et al. (2005), durante la aplicación del IBL en distintos sistemas de tratamiento por lodos activados, lograron determinar que, en general, valores de pH altos, así como altas temperaturas, afectan a las comunidades de ciliados reptantes y zooflagelados.
Se ha demostrado que la relación Alimento/Microoganismos (Relación A/M) influye sobre la comunidad de protozoos en el lodo activado ya que determina la cantidad de alimento disponible para ellos (Al-Shahwani & Horan, 1991). En reactores donde la relación A/M es equilibrada, se espera encontrar una mayor diversidad de taxones dominantes (Marín & Osés, 2013). Para el caso de este estudio, la relación A/M no se relacionó de forma clara con los valores de IBL obtenidos. La tendencia de relación entre el IBL y la edad de lodo fue más clara al analizar los parámetros operacionales por rangos.
La edad del lodo fue en promedio mucho más alta en el sistema de tratamiento Convencional (2329,56 días) que en el MBR (86,73 días). Al momento del muestreo, el sistema de tratamiento Convencional tenía varios meses de no ser purgado; además, es de esperar que el MBR, al ser un sistema piloto pequeño y mucho más reciente de operar, maneje valores de edad del lodo menores. De todas formas, la edad del lodo fue relativamente alta para ambos sistemas, lo que puede explicar la baja densidad relativa de flagelados pequeños en las muestras, ya que este grupo de protozoos se espera encontrar de forma abundante en lodos jóvenes (López-Arias et al., 2012; Salvadó, 1994). Al igual que en esta investigación, Salvadó (1994) procedió a hacer el análisis de la correlación entre la edad del lodo y la composición de la microfauna a través de rangos. Los resultados de este estudio confirman lo indicado por investigaciones anteriores, las cuales afirman que la edad del lodo es uno de los parámetros que influye sobre la densidad y la estructura de la comunidad de los microorganismos presentes en el lodo activado (Al-Shahwani & Horan 1991; Martín-Cerceda et al., 1996; Montusiewicz et al., 2010; Zornoza et al., 2010)
Para el control rutinario de un sistema de tratamiento de aguas residuales existen y se utilizan otros parámetros operacionales. Uno de los más utilizados, y que se ha demostrado que puede estar asociado con la comunidad de protozoos (Martín-Cerceda et al., 1996), pero que no consideramos en este estudio, es el Índice Volumétrico del Lodo (IVL). El criterio para no utilizarlo es que se ha demostrado un sesgo en su uso debido a que, dependiendo de la concentración de sólidos suspendidos totales (SST) en el tanque de aireación, sería necesaria la dilución de la muestra para que el índice sea viable (Zornoza et al., 2010). Mientras que el valor óptimo de SST en licor de mezcla de un sistema de tratamiento de lodos activados Convencional es entre 1 500 y 5 000mg/L; en el sistema de tratamiento MBR se manejan concentraciones óptimas de entre 10 000 y hasta 25 000mg/L (Radjenović et al., 2008), lo cual los hace sistemas no comprables en el análisis de este parámetro. Según la referencia anterior, el valor promedio de SSVLM obtenido en el MBR puede considerarse bajo; sin embargo, esto tiene que ver directamente con el caudal de purgas realizado en el sistema y el tamaño del reactor de aireación. Además, debe de tenerse en consideración que, un aumento en los SSVLM disminuye la concentración de oxígeno disuelto disponible en el sistema (Von Sperling, 2007).
Existen estudios que aseguran que cuando la carga orgánica que ingresa a un sistema de tratamiento es muy alta o muy baja, la diversidad de los microorganismos es baja; obteniendo la mayor diversidad con cargas orgánicas intermedias (Al-Shahwani & Horan, 1991; Jenkins et al., 2004; Łagód et al., 2016; Puigagut et al., 2007). Y al respecto, dado que tanto el sistema de tratamiento Convencional como el de MBR se alimentan de la misma agua cruda, este factor no debería ser limitante para la diferencia entre la diversidad de la comunidad de protozoos y metazoos encontrados en el lodo activado de cada uno de los sistemas de tratamiento. Aun así, a pesar de que el promedio del IBL entre tratamientos fue similar, el promedio de la cantidad de taxones encontrada en las muestras del sistema de tratamiento Convencional fue menor que la encontrada para el sistema de tratamiento por MBR. Durante el conteo biológico que llevamos a cabo en el laboratorio observamos una cantidad y densidad mucho mayor de microorganismos en el sistema de tratamiento de biorreactor de membrana (MBR) que en el sistema de tratamiento Convencional. Las densidades promedio contabilizadas se asemejan a las obtenidas en otros estudios similares (Bento et al., 2005; Leal et al., 2013).
El grupo dominante en el sistema de tratamiento Convencional y en el MBR, según la clasificación del IBL, fueron los ciliados reptantes y/o las amebas testáceas. Esta relación tiene que ver con el hecho de que la dominancia de amebas testáceas (como las de los géneros Euglypha y Arcella) en el lodo activado evidencia una buena oxigenación, así como un buen desempeño del sistema de tratamiento y procesos de nitrificación (Arregui et al., 2012; Bento et al., 2005; Madoni, 1994; Rodríguez et al., 2019). A su vez, la dominancia de amebas testáceas puede indicar altas edades del lodo (Bento et al., 2005; Chen et al., 2004).
En general, los ciliados juegan un papel importante en la mineralización de materia orgánica, y en sistemas de tratamiento por lodo activado contribuyen además en la formación de flóculos (López-Arias et al., 2012; Martín-Cerceda et al., 1996; Pérez-Uz et al., 2010; Sobczyk et al. 2020). Cuando los grupos dominantes de protozoos en un lodo activado resultan de una combinación entre ciliados sésiles y reptantes, hay un indicativo de que el sistema de tratamiento de aguas residuales cuenta con un buen desempeño de depuración (Madoni, 1994); esto debido a que normalmente los ciliados sésiles se correlacionan negativamente con las cargas de DBO (Arregui et al., 2013; Bento et al., 2005; Martín-Cerceda et al., 1996). Por otro lado, cuando en el tanque de aireación dominan los ciliados nadadores, se trata de un lodo activado recién colonizado y un sistema de tratamiento con baja eficiencia (Arregui et al., 2013; Martín-Cerceda et al., 1996).
En los sistemas de tratamiento se da una sucesión de los grupos de ciliados que dominan en el lodo activado conforme aumenta la edad del lodo (Bento et al., 2005; Salvadó, 1994). Así, en lodos con edad intermedia, el grupo de ciliados dominante son los pertenecientes al grupo Hipotricos, donde se ubican géneros como Aspidisca y Euplotes; mientras que, en lodos con edades del lodo más avanzadas, el grupo dominante son los Peritricos, siendo uno de sus representantes los ciliados sésiles del género Vorticella (Salvadó, 1994).
Los metazoos, aunque en densidades muy bajas, también se encuentran en muestras de lodo activado; y, de este grupo, lo más común es encontrar rotíferos y nemátodos, pero también suelen encontrarse anélidos, gastrotricos y tardígrados (Arregui et al., 2013). Debe de tenerse en consideración que los grupos de metazoos que encontré en este estudio no fueron contemplados para el cálculo del IBL, ya que el mismo no los incluye como un grupo de microorganismos funcional (Madoni, 1994).
En general, los resultados de esta investigación han demostrado, a través del cálculo del IBL y su relación con parámetros fisicoquímicos, ambientales y operacionales, que la predominancia de amebas testáceas y ciliados reptantes indica un lodo activado estable y maduro, obteniendo una alta calidad de agua tratada. Esto sobre todo para la evaluación del sistema en la eficiencia de remoción del DBO y del DQO. La literatura científica ha afirmado que el IBL resulta ideal para la evaluación de sistemas de tratamiento por lodos activados (Rodríguez et al., 2019); sin embargo, sus resultados no siempre funcionan del mismo modo para sistemas de Biorreactores de Membrana (MBR) (Parada-Albarracín et al., 2010). Esto debido a que la estructura de la comunidad microbiana es distinta entre ambos sistemas de tratamiento (Pérez-Uz et al., 2010; Yin & Xagoraraki, 2014).
Para hacer uso del IBL como parte de un monitoreo rutinario existen limitaciones respecto a la identificación al microscopio de los microorganismos, ya que pueden existir especies con características morfológicas muy similares, y, además, no todos los investigadores utilizan las mismas técnicas de tinción para las muestras (Arregui et al., 2013). El IBL también ha sido criticado por su falta de sensibilidad (Drzewicki & Kulikowska, 2011), y por la posibilidad de que exista codominancia entre distintos grupos de microorganismos en la misma muestra (Arregui et al., 2013).
A pesar de sus vacíos, el IBL es uno de los índices biológicos más utilizados en el control rutinario de un sistema de tratamiento de aguas residuales (Zornoza et al., 2010), debido a que puede llegar a ser un método de monitoreo poco costoso y rápido de implementar (Łagód et al., 2016; Montusiewicz et al., 2010). Esto está relacionado con el hecho de que la estructura de la comunidad de protozoos en el lodo activado presenta una respuesta bastante rápida a los cambios operativos; fungiendo el papel de biondicadores en el funcionamiento de un sistema de tratamiento de aguas residuales (Martín-González et al., 2006). Por lo que, caracterizar la estructura de la comunidad de microorganismos que habitan el lodo activado permite determinar el proceso específico que está ocurriendo en el sistema de tratamiento en un momento dado (Colorado et al., 2012; Montusiewicz et al., 2010).
Para progresar en este campo de investigación, es necesario llevar a cabo la identificación de los microorganismos con una visión integrada que considere otros parámetros fisicoquímicos, ambientales y estructurales que ocurren en el tanque de aireación estudiado. Además, el análisis de la microfauna debe de realizarse según sus grupos funcionales, pero también tomando en consideración los requerimientos específicos de cada especie (Foissner, 2016; Kepec et al., 2020; Leal et al., 2013).
AGRADECIMIENTOS
Agradecemos la guía de Jeffrey Sibaja y Roger Valverde; y al personal administrativo y de mantenimiento del HSVP, la Dirección de Administración de Proyectos Especiales (DAPE) de la CCSS y al personal del Hospital de Heredia por hacer posibles los muestreos. También al Centro de Investigación en Ciencias del Mar (CIMAR) de la Universidad de Costa Rica (UCR), y a su director Álvaro Morales el espacio de laboratorio. El comité de tesis ha sido clave para el desarrollo exitoso de este estudio.
Este trabajo es parte de los requisitos de graduación del programa de Maestría Académica en Manejo de Recursos Naturales de la Universidad Estatal a Distancia de Costa Rica.
ÉTICA, CONFLICTO DE INTERESES Y DECLARACIÓN DE FINANCIAMIENTO
Declaramos haber cumplido con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en la preparación de este documento; que no hay conflictos de interés de ningún tipo, y que todas las fuentes financieras se detallan plena y claramente en la sección de agradecimientos.
REFERENCIAS
Abzazou, T., Salvadó, H., Cárdenas-Youngs, Y., Becerril-Rodríguez, A., Cebirán, E. M. C., Huguet, A., & Araujo, R. M. (2018). Characterization of nutrient-removing microbial communities in two full-scale WWTP systems using a new qPCR approach. Science of The Total Environment, 618, 858-865. https://doi.org/10.1016/j.scitotenv.2017.08.241
Alfaro-Arrieta, E. (2020). Caracterización de lodos activados en varias plantas de tratamiento de aguas residuales (PTAR) aeróbicas de Costa Rica. https://tinyurl.com/23d6m9rk
Al-Shahwani, S. M., & Horan, N. J. (1991). The use of protozoa to indicate changes in the performance of activated sludge plants. Water Research, 25(6), 633-638. https://doi.org/10.1016/0043-1354(91)90038-R.
Arregui, L., Liébana, R., Calvo, P., Pérez-Uz, B., Salvadó, H., & Serrano, S. (2013). Bioindication in activated sludge wastewater treatment plants. En J. Cesaro, J. Valdez & E. Maradona (Eds), Handbook of Wastewater Treatment: Biological Methods, Technology and Environmental Impact. Nova Science Publishers.
Arregui, L., Liébana, R., Rodríguez, E., Murciano, A., Conejero, F., Pérez-Uz, C., & Serrano, S. (2012). Analysis of the usefulness of biological parameters for the control of activated sludge wastewater treatment plants in an interlaboratory study context. Journal of Environmental Monitoring, 14, 1444-1452.
Babko, R., Kuzmina, T., Łagód, G. & Jaromin-Gleń, K. (2014). Changes in the Structure of Activated Sludge Protozoa Community at the Different Oxygen Condition. Chemistry-Didactics-Ecology-Metrology, 19(1-2), 87-95. https://doi.org/10.1515/cdem-2014-0008
Baird, R. B., Eaton, A. D. & Rice, E. W., Eds. (2017). Standard Methods for the Examination of Water and Wastewater. (23 ed). American Public Health Association, American Water Works Association, Water Environment Federation
Bento, A. P., Sezerino, P. H., Philippi, L. S., Reginatto, V., & Lapolli, F. R. (2005). Caracterização da microfauna em estação de tratamento de esgotos do tipo lodos ativados: Um instrumento de avaliação e controle do processo. Engenharia Sanitaria e Ambiental, 10(4), 329-338. https://doi.org/10.1590/S1413-41522005000400009
Caja Costarricense del Seguro Social (2021). Estudio integral sobre la gestión de las aguas residuales y lodos en la CCSS con visión innovadora. CCSS.
Chen, S., Xu, M., Cao, H., Zhu, J., Zhou, K., Xu, J., Yang, X.,Gan, Y., Liu, W., Zhai, J., & Shao, Y. (2004). The activated-sludge fauna and performance of five sewage treatment plants in Beijing,China. European Journal of Protistology, 40, 147-152.
Colorado, S. L., Leal, M. T., Castillo, E., & González, A. (2012). Análisis microbiológico en el arranque de una planta de lodos activados. XXII Congreso Nacional de Hidráulica. Acapulco, Guerrero, México.
Curds, C. R. (1975). Protozoa. En: C.R. Curds y H.A. Hawkes (Eds). Ecological aspects of used-water treatment (pp. 203–268). Academic Press.
Drzewicki, A., & Kulikowska, D. (2011). Limitation of sludge biotic index application for control of a wastewater treatment plant working with shock organic and ammonium loadings. European Journal of Protistology, 47(4), 287-294. https://doi.org/10.1016/j.ejop.2011.06.001
Foissner, W. (2016). Protists as bioindicators in activated sludge: Identification, ecology and future needs. European Journal of Protistology, 55(Part A), 75-94. https://doi.org/10.1016/j.ejop.2016.02.004
Jenkins, D., Richard, M. G., & Daigger, G. T. (2004). Manual on the Causes and Control of Activated Sludge Bulking, Foaming, and Other Solids Separation Problems (3 ed). IWA Publishing.
Jiménez, C., Fernández, N., Rodríguez, E., Isac, L., Salas, M.D. & Gómez, E. (2001). Sistema rápido de estimación de los rendimientos en depuración de una EDAR en función de las características macroscópicas y microscópicas del fango activado. Tecnología del Agua, 21(216), 40-44.
Jirova, G., Wittlingerova, Z., Zimova, M., Vlkova, A., Wittlerova, M., Dvorakova, M., & Jirova, D. (2016). Bioindicators of wastewater ecotoxicity. Neuroendocrinology Letters, 37(Suppl. 1), 17-24
Jordão, E. P., Villas Bôas, D. M. F., Conceição, J. R., Silva, T. C. R., & Além Sobrinho, P. (1997) Controle microbiológico na operação de um sistema de lodos ativados: estudo em escala piloto. Trabalhos técnicos.
Kepec, M., Matoničkin Kepčija, R., Vlaičević, B., Kepec, S., & Gulin, V. (2020). The applicability of the Sludge Biotic Index in a facility treating sugar refinery effluents and municipal wastewater. Water Environment Research, 93(7), 1087-1096. https://doi.org/10.1002/wer.1500
Leal, A. L., Dalzochio, M. S., Flores, T. S., De Alves, A. S., Macedo, J. C., & Valiati, V. H. (2013). Implementation of the sludge biotic index in a petrochemical WWTP in Brazil: Improving operational control with traditional methods. Journal of Industrial Microbiology and Biotechnology, 40(12), 1415-1422. https://doi.org/10.1007/s10295-013-1354-7
López-Arias, T., Moretuzzo, C., Ahrens, M., & Ude, R. (2012). Identificación de organismos bioindicadores presente en lodos activos de plantas de tratamiento de aguas residuales. Investigaciones y Estudios de la UNA, 7(1), 61-72.
Łagód, G., Babko, R., Jaromin-Gleń, K., Kuzmina, T., & Bieganowski, A. (2016). Biofilm Communities in Successive Stages of Municipal Wastewater Treatment. Environmental Engineering Science, 33(5), 306-316. https://doi.org/f8qk4m
Madoni, P. (1994). A sludge biotic index (SBI) for the evaluation of the biological performance of activated sludge plants based on the microfauna analysis. Water Research, 28(1), 67-75. https://doi.org/c9n3j8
Madoni, P. (2011). Protozoa in wastewater treatment processes: a minireview. Italian Journal of Zoology, 78(1), 3-11. 10.1080/11250000903373797
Marín, A., & Osés, M. (2013) Operación y mantenimiento de plantas de tratamiento de aguas residuales con el proceso de lodos activados. Tomo 1. Comisión Estatal del Agua de Jalisco. https://tinyurl.com/22ufdo5b
Martín-Cerceda, M., Serrano, S., & Guinea, A. (1996). A comparative study of ciliated protozoa communities in activated-sludge plants. FEMS Microbiology Ecology, 21(4), 267-276. https://doi.org/10.1111/j.1574-6941.1996.tb00123.x
Martín-González, A., Díaz, S., Borniquel, S., Gallego, A., & Gutiérrez, J. C. (2006). Cytotoxicity and bioaccumulation of heavy metals by ciliated protozoa isolated from urban wastewater treatment plants. Research in Microbiology, 157(2), 108-118. https://doi.org/10.1016/j.resmic.2005.06.005
Montusiewicz, A., Chomczynska, M., Malicki, J., & Łagód, G. (2010). Biofilm sampling for bioindication of municipal wastewater treatment. In L. Pawlowski, M. R. Dudzinska & A. Pawlowsk (Eds.), Environmental Engineering III (pp.491-496) Publisher: CRC Press/Balkema, Taylor & Francis Group.
Nicolau, A., Dias, M., Mota, M., & Lima, N. (2001). Trends in the use of protozoa in the assessment of wastewater treatment. Research in Microbiology. 152, 621-630
Parada-Albarracín, J.A., Arévalo, J., Ruiz, L.M., Moreno, B., Pérez, J., & Gómez, J. (2010). Microbiología en la puesta en marcha de un biorreactor de membranas (MBR) para la depuración de aguas residuales urbanas. Tecnología del Agua. 319, 2-8.
Pedrazzani, R., Menoni, L., Nembrini, S., Manili, L. & Bertanza, G. (2016). Suitability of Sludge Biotic Index (SBI), Sludge Index (SI) and filamentous bacteria analysis for assessing activated sludge process performance: The case of piggery slaughterhouse wastewater. Journal of Industrial Microbiology and Biotechnology, 43(7), 953-964. https://doi.org/10.1007/s10295-016-1767-1
Pérez-Uz, B., Arregui, L., Calvo, P., Salvadó, H., Fernández, N., Rodríguez, E., Zornoza, A., & Serrano, S. (2010). Assessment of plausible bioindicators for plant performance in advanced wastewater treatment systems. Water Research, 44(17), 5059-5069. https://doi.org/10.1016/j.watres.2010.07.024
Puigagut, J., Salvadó, H., García, D., Granes, F., & García, J. (2007). Comparison of microfauna communities in full scale subsurface flow constructed wetlands used as secondary and tertiary treatment. Water Research, 41(8), 1645-1652. https://doi.org/10.1016/j.watres.2007.01.036
Quinn, G. P., & Keough, M. J. (2002). Experimental Design and Data Analysis for Biologists. Cambridge University Press. doi:10.1017/CBO9780511806384
Radjenović, J., Matošić, M., Mijatović, I., Petrović, M., & Barceló, D. (2008). Membrane Bioreactor (MBR) as an Advanced Wastewater Treatment Technology. En D. Barceló y M. Petrovic (Eds.). Emerging Contaminants from Industrial and Municipal Waste, (pp.37-101). Springer Berlin Heidelberg. https://doi.org/10.1007/698_5_093
Rodríguez, E., Isac, L., Fernández, N., & Salas, M.D. (2019). Manual de trabajo para análisis biológicos en fangos activados. Grupo Bioindicación Sevilla. ISBN. 608-0189-6
Salvadó, H. (1994). Effect of mean cellular retention time on ciliated protozoan populations in urban wastewater treatment plants based on a proposed model. Water Research, 28(6), 1315-1321. https://doi.org/10.1016/0043-1354(94)90296-8.
Salvadó, H., Gracia, M. P., & Amigó, J. M. (1995). Capability of ciliated protozoa as indicators of effluent quality in activated sludge plants. Water Research, 29 (4), 1041-1050. https://doi.org/10.1016/0043-1354(94)00258-9
Sobczyk, M., Pajdak‐Stós, A., Fiałkowska, E., & Fyda, J. (2020). The influence of Aspidisca cicada on nitrifying bacteria and the morphology of flocs in activated sludge. Water and Environment Journal, 34(S1), 699-709. https://doi.org/10.1111/wej.12571
Sowinska, A., Pawlak, M., Mazurkiewicz, J., & Pacholska, M. (2017). Comparison of the Results from Microscopic Tests Concerning the Quality of Activated Sludge and Effluent. Water, 9(12), 918. https://doi.org/10.3390/w9120918
Von Sperling, M. (2007). Basic principles of wastewater treatment. IWA Publishing. https://tinyurl.com/226hm5yf
Wen, X., Ding, H., Huang, X., & Liu, R. (2004). Treatment of hospital wastewater using a submerged membrane bioreactor. Process Biochemistry, 39(11), 1427-1431. https://doi.org/10.1016/S0032-9592(03)00277-2
Yin, Z., & Xagoraraki, I. (2014). Membrane Bioreactors (MBRs) for Water Reuse in the USA. En: D. Fatta-Kassinos, D. D. Dionysiou y K. Kümmerer (Eds.), Advanced Treatment Technologies for Urban Wastewater Reuse (pp. 223-245). Springer International Publishing. https://doi.org/10.1007/698_2014_324
Zhou, K., Xu, M., Dai, J., & Cao, H. (2006). The microfauna communities and operational monitoring of an activated sludge plant in China. European Journal of Protistology, 42(4), 291-295. https://doi.org/10.1016/j.ejop.2006.07.005
Zornoza, A., Alonso, J. L., Serrano, S., Fajardo, V., Zorrilla, F., Bernácer, I., & Morenilla, J. J. (2010). Estudio integrado del proceso de fangos activados I. Análisis descriptivo de factores fisicoquímicos y biológicos implicados en su dinámica. VII Jornadas de transferencia tecnológica sobre microbiología del Fango Activado. Sevilla, España. Asociación Científica Grupo Bioindicación de Sevilla.
Zornoza, A. (2015). Metodología para la búsqueda de microorganismos bioindicadores en fangos activos: la desesperación en la búsqueda del modelo. Curso teórico-práctico “El papel de los protistas en los procesos de depuración de las aguas residuales. Sevilla. 9-10 septiembre de 2015. ISBN 13-978-84-608-2139-7
