
COMUNICACIÓN CORTA
Papel de los mamíferos silvestres en la dispersión de semillas y en la cadena alimentaria de agroecosistemas de café en Costa Rica
Ronald J.
Sánchez-Brenes1![]() & Javier Monge-Meza2,3
& Javier Monge-Meza2,3![]()
1. Universidad Nacional Costa Rica. Sede Regional Chorotega Campus Liberia, Centro Mesoamericano para el Desarrollo Sostenible del Trópico Seco (CEMEDE), Liberia, Guanacaste. ronald.sanchez.brenes@una.cr
2. Universidad de Costa Rica, Escuela de Agronomía, San Pedro de Montes de Oca, San José, Costa Rica. javier.monge@ucr.ac.cr
3. Universidad de Costa Rica, Instituto de Investigaciones Agrícolas (IIA), San Pedro de Montes de Oca, San José, Costa Rica
Recibido 15-I-2024 Corregido 03-III-2024 Aceptado 13-III-2024
https://doi.org/10.22458/urj.v16i1.5128
|
ABSTRACT. “The role of wild mammals in seed dispersal and food chain in Costa Rican coffee agroecosystems”. Introduction: Shade coffee farms are complex ecosystems and there is a need for better understanding of their function and environmental services. Some of their environmental functions are similar to forest ecosystems and biodiversity is important. Mammals play a crucial role in these agroecosystems, controlling vegetation abundance and composition, contributing to seed dispersal, nutrient recycling and soil maintenance through excavation and aeration. Objective: To identify the role of wild mammals in seed dispersal and food chain in Costa Rican coffee agroecosystems. Methods: We worked in Rincón de Mora, San Ramón, Costa Rica, from March 2019 to January 2022. We used Pixestt and Havahart traps, and camera traps, to examine feces and behavior; depending on species, sample size ranged between 2 and 87. Results: We identified 19 species of mammals. Heteromys salvini had coffee beans in its pockets. Echinosciurus variegatoides, Didelphis marsupialis and Philander melanurus fed on the local vegetation. Dasyprocta punctata had the most diet data; we found a beetle in the feces of Procyon lotor and observed Eira barbara chasing D. punctata. Conclusion: Coffee agroecosystems provide food for wild mammals, which in turn contribute to the coffee ecosystem as seed dispersers and population control.
Keywords: Feeding, coffee crops, vertebrate behavior, mammals as dispersers.
|
RESUMEN. Introducción: Las fincas de café con sombra son ecosistemas complejos y existe una necesidad de comprender mejor su función y servicios ambientales. Algunas de estas funciones son similares a las de los ecosistemas forestales y la biodiversidad es importante. Los mamíferos desempeñan un papel crucial en estos agroecosistemas, controlando la abundancia y composición de la vegetación, contribuyendo a la dispersión de semillas, al reciclaje de nutrientes y al mantenimiento del suelo mediante la excavación y la aireación. Objetivo: Identificar el papel de los mamíferos silvestres en la dispersión de semillas y en la cadena alimentaria en agroecosistemas cafetaleros de Costa Rica. Métodos: Trabajamos en Rincón de Mora, San Ramón, Costa Rica, desde marzo de 2019 hasta enero de 2022. Utilizamos trampas Pixestt y Havahart, y cámaras trampa, para examinar heces y comportamiento; dependiendo de la especie, el tamaño de la muestra osciló entre 2 y 87 individuos. Resultados: Identificamos 19 especies de mamíferos. Heteromys salvini tenía granos de café en sus mejillas. Echinosciurus variegatoides, Didelphis marsupialis y Philander melanurus se alimentaron de la vegetación local. Dasyprocta punctata tuvo la mayor cantidad de datos de dieta; encontramos un escarabajo en las heces de Procyon lotor y observamos un Eira barbara persiguiendo un D. punctata. Conclusión: Los agroecosistemas cafetaleros proporcionan alimento para los mamíferos silvestres, y estos contribuyen al ecosistema cafetalero como dispersores de semillas y controladores de población.
Palabras clave: Alimentación, cafetales, comportamiento de vertebrados, mamíferos dispersores.
|
De igual manera, los mamíferos juegan un papel importante en los ecosistemas en donde están presentes temporal o permanentemente (Redford, 1992), como lo son, en este caso, los agroecosistemas con café de Rincón de Mora, San Ramón, Costa Rica. Los mamíferos grandes, son los principales depredadores en un ecosistema y controlan otros vertebrados, lo cual afecta la abundancia y composición de la vegetación (Terborgh et al., 2001; Sinclair, 2003; Estes et al., 2011).
Asimismo, los mamíferos medianos y pequeños tienen un papel importante como consumidores de frutos y semillas en primera instancia (Silman et al., 2003; Terborgh et al., 2008; Endo et al., 2010) y después como dispersores (Fragoso et al., 2003; Paolucci et al., 2019). En el neotrópico, la mayoría de las especies arbóreas dependen de la fauna para dispersar sus semillas, incluso más del 50% de las especies leñosas son dispersadas por especies vertebradas como los mamíferos (Fleming et al., 1987; Jordano, 2000; Jordano et al., 2006). El consumo y dispersión de frutos es un proceso clave en la transición de semillas a plántulas (Janzen, 1970; Jordano et al., 2007; Schmitz, 2008).
Además, existen mamíferos como marsupiales, xenarthros y carnívoros que se alimentan de animales muertos o moribundos. Con esto, se reduce la acumulación de materia animal en descomposición, se previene la difusión de algunas enfermedades, se interrumpen ciclos de patógenos y parásitos interespecíficos, y así contribuyen con el reciclado de nutrientes. Otro grupo de mamíferos se encargan del transporte de nutrientes entre ambientes acuáticos, como por ejemplo los mapaches (Procyon spp.). Del mismo modo, los roedores y xenarthros cavan, remueven y airean el suelo mediante sus cuevas y túneles, que también sirve como refugio para otras especies de vertebrados (Rumiz, 2010). La presente investigación se orientó a identificar algunos componentes de la dieta de los mamíferos silvestres en un agroecosistema con café en Rincón de Mora, San Ramón, Costa Rica.
El estudio lo realizamos en dos fincas colindantes con un área de 6,2ha, ubicadas en la comunidad de Rincón de Mora (10° 0’ 44’’ N, 84° 7’ 28’’ O, y 10° 0’ 34’’ N, 84° 7’ 28’’ O) a 2,5 kilómetros al sur del distrito de San Rafael, cantón de San Ramón, provincia de Alajuela, Costa Rica. El paisaje que predomina en la zona son los agroecosistemas con café con sombra. Las fincas objeto de estudio se ubican entre los 1,200 y 1,250 m.s.n.m., con pendientes de 15, 30 y 45% (Sánchez & Moya, 2018). El tipo de sombra presente en estos agroecosistemas con café de acuerdo con la clasificación de cafetales de Moguel y Toledo (1999) se denomina policultivo comercial, en el cual los árboles originales del bosque son reemplazados por otras especies útiles de sombrío, como por ejemplo Inga densiflora (Benth, 1875) (guaba), Iochroma arborescens (Shaw) (güitite) y Erythrina poeppigiana (Walp) (poró).
En Rincón de Mora se presenta una precipitación de 3461mm por año, con una temperatura promedio de 20°C y una humedad relativa de 92% (Centro de Investigaciones Geofísicas [CIGEFI], 2019). El uso de suelo de las fincas es de 3,5ha en agroecosistema con café, 1,5ha de bosque en regeneración que colinda con un bosque secundario, 1266m2 de cultivo de Rubus spectabilis (Pursh) (mora), un invernadero de 343m2 y el área restante 1266m2 corresponde a construcciones, entre ellos un estanque (Fig. 1).
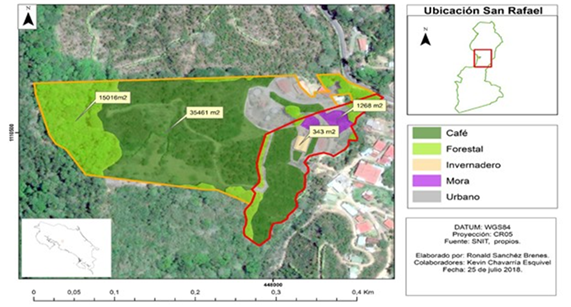
Fig. 1. Ubicación del área de estudio en Rincón de Mora, San Ramón, Alajuela, Costa Rica.
Para los muestreos de mamíferos pequeños utilizamos 73 trampas de captura viva Pixestt, colocadas en línea de acuerdo con la topografía del terreno (Manson et al., 2008; Theuerkauf et al., 2011). Las trampas las ubicamos en forma de cuadrícula en 10 filas con 11 estaciones con distanciamiento de 10m entre trampas. Las trampas las activamos en periodos de 24 horas con revisión una vez por día para marcar y liberar a los animales capturados y cambiar cebos. El cebo que usamos para todos los mamíferos fue una mezcla de avena, mantequilla de maní, vainilla, además de un embutido a la par. La intensidad de muestreo fue de 156 días (3 744 horas) distribuidos a lo largo de dos años.
Para los muestreos de mamíferos medianos empleamos dos métodos de trampeo, el primero mediante trampas Havahart (HH 1085 EZ 1 Puerta 81 x 25,5 x 30,5cm). Colocamos siete trampas Havahart en sitios estratégicos (árboles frutales, madrigueras, musáceas, lugares de paso, cerca de fuentes de agua) (Manson et al., 2008; Caudill et al., 2014; Torre et al., 2016). Las trampas Havahart las colocamos en un total de 156 noches a lo largo de dos años (3 744h). Pusimos el cebo en horas de la tarde (16:00h) y las trampas las revisamos al día siguiente en la mañana (08:00h) para identificar al animal capturado, marcarlo y cambiar el cebo. La carnada que proporcionamos fue la misma de las trampas para mamíferos pequeños, además de algunas frutas y vegetales, las cuales cambiamos en cada revisión de trampa.
El segundo método de muestreo fue mediante cuatro cámaras trampa Bushnell HD modelo 119740 (B&H Foto & Electronics Corp. 420 9th Ave, Nueva York, Estados Unidos), colocadas en sitios estratégicos (Manson et al., 2008; Caudill et al., 2014; Torre et al., 2016). Estos dispositivos los ubicamos a una altura de 20 a 50cm del suelo, y no usamos cebos ni sustancia que atrajeran a los mamíferos en el sitio donde está la cámara (Lizcano, 2018). Las cámaras funcionaron en modo mixto (foto y video) de manera continua durante tres años de muestreo (26280 horas). Solo las desactivamos para obtener los datos almacenados en las tarjetas SD y cambiar las baterías en los momentos requeridos. Seguido de esto, analizamos la totalidad de videos y separamos los eventos en donde se evidenciará alguna acción de alimentación o indicio de depredación. Los mamíferos grandes solo se muestrearon con las cámaras trampa.
En las trampas buscamos excretas de individuos capturados, las colocamos en bolsas con cierre hermético y rotuladas (Rojas et al., 2014). Los componentes alimenticios obtenidos en heces se lavaron con agua destilada con el uso de una piseta para separar las semillas de los demás componentes de la excreta, las secamos a temperatura ambiente y posteriormente, las clasificamos por tamaño y forma, para su identificación.
En el caso de los mamíferos pequeños, si no hallábamos heces en las trampas, extrajimos al individuo, lo depositamos en una bolsa de tela y lo dejamos por una hora para lograr obtener la muestra fecal. Asimismo, revisamos los abazones (bolsas de las mejillas) de algunos roedores de la familia Heteromyidae, para buscar residuos de alimentos. En los mamíferos medianos, también observamos si había excretas dentro de la trampa, en caso de no haber heces se mantuvo al animal encerrado por una hora más para que defecara.
Identificamos 19 especies de mamíferos en el agroecosistema con café, pertenecientes a 6 órdenes y 15 familias (Tabla 1). Los órdenes más representados fueron Carnivora con 7 especies y Rodentia con 6 especies.
TABLA 1. Mamíferos presentes en agroecosistemas con café, Rincón de Mora, San Ramón, Costa Rica
|
Orden |
Especie |
Nombre común |
|
|
Didelphimorphia |
Didelphidae |
Didelphis marsupialis (Linnaeus, 1758) |
Zorro pelón |
|
Philander melanurus (Thomas, 1899) |
Zorro cuatro ojos |
||
|
Cingulata |
Chlamyphoridae |
Cabassous centralis (Miller, 1899) |
Armadillo zopilote |
|
Dasypodidae |
Dasypus novemcinctus (Linnaeus, 1758) |
Armadillo nueve bandas |
|
|
Lagomorpha |
Leporidae |
Sylvilagus gabbi (J. A. Allen, 1877) |
Conejo |
|
Rodentia |
Sciuridae |
Echinosciurus variegatoides (Ogilby, 1839) |
Ardilla |
|
Heteromidae |
Heteromys salvini (O. Thomas, 1893) |
Ratón espinoso |
|
|
Cricetidae |
Melanomys chrysomelas (J. A. Allen, 1897) |
Ratón de campo |
|
|
Dasyproctidae |
Dasyprocta punctata (Gray, 1842) |
Guatusa |
|
|
Muridae |
Mus musculus (Linnaeus, 1758) |
Ratón |
|
|
Rattus rattus (Linnaeus, 1758) |
Rata |
||
|
Eulipotyphla |
Soricidae |
Cryptotis nigrescens (J. A. Allen, 1895) |
Musaraña |
|
Carnivora |
Felidae |
Puma concolor (Linnaeus, 1771) |
Puma |
|
Canidae |
Canis latrans (Say, 1823) |
Coyote |
|
|
Mephitidae |
Conepatus semistriatus (Boddaert, 1785) |
Zorrillo hediondo |
|
|
Mustelidae |
Eira barbara (Linnaeus, 1758) |
Tolomuco |
|
|
Galictis vittata (von Schreber, 1776) |
Grisón |
||
|
Procyonidae |
Nasua narica (Linnaeus, 1766) |
Pizote |
|
|
Procyon lotor (Linnaeus, 1758) |
Mapache |
Entre las especies de las que obtuvimos información relacionada con su dieta, se encuentra Heteromys salvini (ratón espinoso) (N=7) a la que se le halló en un individuo granos de Coffea arabiga (café) en sus abazones (Fig. 2). Echinosciurus variegatoides (ardilla)(N=6) la observamos alimentándose de Musa paradisiaca (Linneus 1753) (plátano, banano y guineo), Psidium guajava (Linneus, 1753) (guayaba) e I. arborescens (Fig. 3) (Tabla 2).
TABLA 2. Consumo de plantas presentes en el agroecosistema con café por parte de mamíferos silvestres muestreados
|
Mamífero |
Plantas consumidas |
||||
|
Especie |
Nombre común |
Familia |
Especie |
Nombre común |
Parte de la planta o animal |
|
Didelphis marsupialis (Linnaeus, 1758) |
Zorro pelón |
Musaceae |
Musa paradisiaca (Linneus 1753) |
Banano, plátano y guineo |
Fruto |
|
Philander melanurus (Thomas, 1899) |
Zorro cuatro ojos |
Piperaceae |
Piper hispidum (Sw.) |
Candelilla |
Fruto y semillas |
|
Melastomataceae |
Conostegia xalapensis (Bonpl, 1825) |
Capulín |
Fruto y semillas |
||
|
Echinosciurus variegatoides (Ogilby, 1839) |
Ardilla |
Musaceae |
Musa paradisiaca (Linneus 1753) |
Banano, plátano y guineo |
Fruto |
|
Myrtaceae |
Psidium guajava (Linneus 1753) |
Guayaba |
Fruto y semillas |
||
|
Solanaceae |
Iochroma arborescens Linneus 1753) |
Güitite |
Fruto y semillas |
||
|
Heteromys salvini (O. Thomas, 1893) |
Ratón espinoso |
Rubiaceae |
Coffea arabiga |
Café |
Grano |
|
Dasyprocta punctata (Gray, 1842) |
Guatusa |
Myrtaceae |
Polyporus sp |
Hongo |
Cuerpo fructífero |
|
Musaceae |
Musa paradisiaca Linneus 1753) |
Banano, plátano y guineo |
Fruto |
||
|
Lauraceae |
Persea americana (Mill, 1768) |
Aguacate |
Fruto |
||
|
Cucurbitaceae |
Sechium edule (Jacq. Sw. 1800) |
Chayote |
Fruto |
||
|
Myrtaceae |
Eugenia stipitata (Mc Vaugh, 1956) |
Arazá |
Fruto |
||
|
Myrtaceae |
Psidium friedrichsthalianum (Berg.) |
Cas |
Fruto y semillas |
||
|
Myrtaceae |
Psidium guajava (Linneus 1753) |
Guayaba |
Fruto y semillas |
||
|
Rutaceae |
Citrus aurantifolia (Christm) |
Limón dulce |
Frutos |
||
|
Citrus reticulata (Blanco, 1837) |
Mandarina |
Frutos |
|||
|
Citrus sinensis (Linneus, 1753) |
Naranja |
Frutos |
|||
|
Fabaceae |
Inga densiflora(Benth, 1875) |
Guaba |
Vaina, pulpa y semillas |
||
|
Cecropia peltata (Linneus, 1759) |
Guarumo |
Vaina, pulpa y semillas |
|||
Dasyprocta punctata (guatusa) (N=87) fue la especie de la cual obtuvimos más información. En cámaras trampa registramos a este roedor consumiendo Polyporus sp (hongo) y M. paradisiaca. Asimismo, la observamos alimentarse de Persea americana (Mill, 1768) (aguacate), Sechium edule (Jacq. Sw. 1800) (chayote), Eugenia stipitata (Mc Vaugh, 1956) (arazá), Psidium friedrichsthalianum (Berg.) (cas), P. guajava, Citrus aurantifolia (Christm) (limón dulce), Citrus reticulata (Blanco, 1837) (mandarina), Citrus sinensis (Linneus, 1753) (naranja), I. densiflora (Benth, 1875) y Cecropia peltata (Linneus, 1759) (guarumo), especies de plantas que potencialmente podría estar dispersando (Fig. 4) (Tabla 2).

Fig. 2. Granos de Coffea arabiga extraídos en las bursas de Heteromys salvini en Rincón de Mora,
San Ramón, Costa Rica.

Fig. 3. Semillas consumidas por Echinosciurus variegatoides, (A) Psidium guajava y (B) Iochroma arborescens. Rincón de Mora, San Ramón, Costa Rica.
Philander melanurus (zorro de cuatro ojos) (N=3) consumió Piper hispidum (Sw.) (candelillas) y Conostegia xalapensis (Bonpl, 1825) (capulín) dada la presencia de estas semillas en sus heces (Fig. 5). Mientras que Didelphis marsupialis (zorro pelón) (N=20) la observamos comiendo M. paradisiaca (Linneus, 1753) (Tabla 2).
En cuanto a los carnívoros Procyon lotor (mapache) (N=13), se alimentó de Oreochromis niloticus (Linnaeus, 1758) (tilapia) y Pangasius hypophthalmus (Sauvage, 1878) (pangasio), elementos presentes en un estanque artificial ubicado en este agroecosistema con café. Igualmente observamos en las heces la presencia de un individuo de la familia Scarabeidae, subfamilia Aphoniinae (escarabajo) (Fig. 6). Por su parte, Eira barbara (tolomuco) (N=2) la observamos mediante un video en las cámaras trampa persiguiendo a un individuo de D. punctata, presa potencial de este depredador.

Fig. 4. Ítems consumidos en el sitio de estudio por Dasyprocta punctata (A) Polyporus sp, (B) Inga densiflora, (C) Cecropia peltata (D) Musa paradisiaca (E) Citrus sinensis. Rincón de Mora, San Ramón, Costa Rica.

Fig. 5. Ítems consumidos presentes en el área de estudio por Philander melanurus (A) Conostegia xalapensis y (B) Piper hispidum. Rincón de Mora, San Ramón, Costa Rica.

Fig. 6. Ítems consumidos en el área de estudio por Procyon lotor (A) Scarabeidae subfamilia Aphoniinae y (B) Pangasius hypophthalmus. Rincón de Mora, San Ramón, Costa Rica.
Hetoromys salvini es omnívoro (Reid, 2009) presentó granos de café en sus abazones, lo cual es característico para esta especie por ser dispersor de semillas. En cuanto a E. variegatoides, tiene una dieta que consiste en frutos, nueces y semillas de diversas especies de plantas (Monge & Hilje, 2006) aunque Medina-Fitoria et al. (2018) reportaron a esta especie alimentándose de polluelos de Zenaida asiatica (Linnaeus, 1758) (paloma aliblanca) en lugares urbanos. Esta ave fue registrada por Sánchez y Moya (2018) en cafetales de Rincón de Mora, por lo que podría ser una fuente de alimentación alternativa, lo que cambiaría el hábito alimentario de E. variegatoides a especie omnívora.
Además, en los agroecosistemas con café investigados, E. variegatoides se observó comiendo en árboles de P. guajava lo que concuerda con lo dicho por Monge y Hilje (2006), lo que indica que el comportamiento de E. variegatoides es arbóreo y asimismo que esta fruta es parte de su dieta. Otro de los árboles en los que se vio esta especie fue en I. arborescens que de acuerdo con Wainwright (2002) es otra fuente de alimentación. Asimismo, parte de la flora que está presente en el cafetal estudiado que se reporta como parte de la dieta de E. variegatoides es Carica papaya (Linneus, 1753) (papaya), Cecropia spp, C. aurantifolia, Ficus spp, Inga spectabilis (Vahl.), Mangifera indica (Linneus, 1753) (mango), M. paradisiaca, P. americana, S. edule, Sechium tacaco (Pittier, 1978) (tacaco), Spondias purpurea (Linneus, 1753) (jocote), Theobroma cacao (Linneus, 1753) (cacao) y Zea mays (Linneus, 1753) (maíz) (Best, 1995; Wainwright 2002; Reid, 2009; Mencía, 2021), de las cuales algunas semillas podrían ser potencialmente dispersadas.
Dasyprocta punctata, D. marsupialis, P. melanurus y P. lotor observados en el área de estudio, catalogados de acuerdo con sus hábitos alimentario como omnívoros (Carrillo et al., 1999; Reid, 2009). D. punctata es una especie prácticamente frugívora, ya que comen principalmente partes blandas de frutas y semillas (Smythe, 1978) aunque también se ha reportado comiendo cotiledones de plántulas, flores, hojas, insectos, hongos (Carrillo et al., 1999) y aves (Ramírez et al., 2018). Las cámaras trampa permitieron reportar a D. punctata en Rincón de Mora alimentarse de Cecropia spp., C. sinensis, M. paradisiaca, Polyporus sp. e I. densiflora (Sánchez-Brenes & Monge, 2021). Incluso con I. densiflora se observó a D. punctata eliminar la cáscara del fruto para comerse la pulpa y posteriormente enterrar la semilla, dicho comportamiento es característico en las guatusas y lo potencia como dispersor de semillas grandes (Smythe, 1978; Janzen, 1991). Asimismo, mediante observación directa, otros alimentos presentes en el agroecosistema con café y aprovechados por este mamífero son C. aurantifolia, E. stipitata, P. friedrichsthalianum, P. guajava y S. edule. Además, se conoce que D. punctata también se alimenta de Saccharum officinarum (Linneus, 1753) (caña de azúcar), Manihot esculenta (Crantz, 1766) (yuca) y pichones de Turdus grayi (yigüirro) (Bonaparte, 1838) elementos presentes en los cafetales investigados y que han sido reportados como parte de su dieta (Walker, 1968; Smythe, 1978; Ramírez et al., 2018).
Didelphis marsupialis se observó alimentándose de M. paradisiaca, una de las especies de plantas más abundantes en el cafetal. Asimismo, otra vegetación presente en este agroecosistema como M. indica, Sizygium malaccense (Linneus, 1753) (manzana de agua) también es parte de su dieta (Barros & Azevedo, 2014). Al mismo tiempo, este mamífero puede depredar algunos murciélagos como Artibeus jamaicensis y Carollia perspicillata (Cloutier & Thomas, 1992; Ortega & Castro-Arellano, 2001), registrados en la investigación de Sánchez y Moya (2018) en estos cafetales. D. marsupialis puede consumir estas presas mencionadas, al compartir el mismo espacio dentro del hábitat del café.
Philander melanurus, al igual que D. marsupialis se alimenta de murciélagos A. jamaicensis y C. perspicillata (Cloutier & Thomas 1992; Reid, 2009). Conjuntamente su dieta se compone de insectos Scarabeidae y Blattidae (Cloutier & Thomas, 1992) al igual que plantas como Piper spp y C. xalapensis cuyas semillas fueron recolectadas e identificadas en esta investigación, así como Cecropia spp, S. purpurea y Z. mays (Cloutier & Thomas, 1992), presentes en el agroecosistema con café objeto de estudio. Del mismo modo, este mamífero depreda serpientes Micrurus nigrocinctus (Girard, 1854) (coral) (Gómez-Martínez et al., 2008), que algunas veces puede representar un peligro para los productores y recolectores de café.
Guerrero et al. (2000) indican que P. lotor consume insectos de la familia Scarabeidae (escarabajos), como el ejemplar de la subfamilia Aphoniidae percibido en este estudio. Además de Acrididae, Buprestidae, Curculionidae, Grillidae, Formicidae, Pentatomidae y Tenebrionidae, además de Crustaceae. En cuanto a las plantas, además de M. paradisiaca observada como alimento de este mamífero, también consume otra vegetación encontrada en estos cafetales como Inga sp (Carrillo et al., 2001), C. papaya S. purpurea, Ficus spp, M. indica, Solanum lycopersicum (tomate), Z. mays. Asimismo, este mamífero puede alimentarse de algunos vertebrados, en específico aves de las familias Columbidae, Caprimulgidae, Emberizidae y Fringillidae, de las cuales algunas especies están presentes en Rincón de Mora, tal y como lo reportaron Sánchez y Moya (2018).
Eira barbara vista en los videos de las cámaras trampa persiguiendo a D. punctata tiene como presa a este (Carrillo et al., 1999) y otros mamíferos como D. marsupialis, Ratus rattus (rata) (Presley, 2000) y Sylvilagus gabbi (conejo) (Saenz-Bolaños et al., 2018). Además, consume miel producida por Trigonna spp (abejas) (Wainwright, 2002). También se alimenta de Ficus spp., Cecropia spp., P. guajava (Carrillo et al., 1999; Wainwright, 2002; Villafañe-Trujillo et al., 2018) y el ave Herpetotheres cachinnans (Linnaeus, 1758) (guaco) (Skutch, 1971) registrada en Rincón de Mora (Sánchez & Moya, 2018). Por lo que se concluye que los agroecosistemas con café colaboran con la dieta de los mamíferos silvestres mediante algunas fuentes de alimentación. De igual manera, los mamíferos contribuyen al cafetal como dispersores de semillas, manejo de poblaciones de animales no deseados para el cafetal y aireación de macroporos y microporos en el suelo.
AGRADECIMIENTOS
Se les agradece a los productores Olman Ramírez y Gerardo Quirós propietarios de las fincas de estudio por su anuencia y apoyo para realizar la presente investigación. Asimismo, al SEP, al Doctorado en Ciencias Agrícolas de la Universidad de Costa Rica, CIPROC, PIRENA y UNA-JAGUAR por las facilidades ofrecidas para este estudio.
ÉTICA, CONFLICTO DE INTERESES Y DECLARACIÓN DE FINANCIAMIENTO
Declaramos haber cumplido con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en la preparación de este documento; que no hay conflictos de interés de ningún tipo, y que todas las fuentes financieras se detallan plena y claramente en la sección de agradecimientos. Asimismo, estamos de acuerdo con la versión editada final de esta publicación. El respectivo documento legal firmado se encuentra en los archivos de la revista. La declaración de contribución de cada autor es la siguiente: R.S.B y J.M.: Diseño de la investigación, colección y análisis de datos, redacción del artículo.
REFERENCIAS
Altieri, M. (1999). The ecological role of biodiversity in agroecosystems. Agriculture, Ecosystems and Environment, 74(1-3), 19-31. https://doi.org/10.1016/S0167-8809(99)00028-6
Barros, F., & Azevedo, P. (2014). Common opposum (Didelphis marsupialis Linnaeus, 1758): food and medicine for people in Amazon. Journal of Ethnobiology and Ethnomedicine, 10,65-78. https://doi.org/10.1186/1746-4269-10-65
Best, T. (1995). Sciurus variegatoides. Mammalian Species (500), 1-6.
Carrillo, E., Wong, G., & Saenz, J. (1999). Mamíferos de Costa Rica. Instituto Nacional de Biodiversidad.
Carrillo, E., Wong, G., & Saenz, J. (2001). Hábitos alimentarios del mapachin (Procyon lotor) (Carnivora: Procyonidae) en un bosque muy húmedo tropical costero de Costa Rica. Revista Biología Tropical, 49(3-4), 1193-1197.
Caudill, A., DeClerck, F., & Husband, T. (2014). Connecting sustainable agriculture and wildlife conservation: Does shade coffee provide habitat for mammals? Agriculture, Ecosystems and Enviroment 199: 85-93. https://doi.org/10.1016/j.agee.2014.08.023
Centro de Investigaciones Geofísicas (CIGEFI). (2019). Datos de la Estación Meteorológica de la Sede de Occidente. Universidad de Costa Rica. San Ramón, Alajuela.
Cloutier, D., & Thomas, D. (1992). Carollia perspicillata. Mammalian Species, (417), 1-9. https://doi.org/10.2307/3504157
Endo, W., Peres A., Salas E., Mori S., Sánchez-Vega J., Shepard G., Pacheco, V., Yu, D. W. (2010). Game vertebrate densities in hunted and nonhunted forest sites in Manu National Park, Peru. Biotropica 42(2):251-261. https://doi.org/10.1111/j.1744-7429.2009.00546.x
Escobar-Anleu, B. I., Shoender, J. R. S., Romero, J. R., & Montes, N. (2023). More trees with your coffee? Diversity and habitat associations of terrestrial medium-and large-sized mammals in shade-grown coffee plantations of the highlands of Guatemala. Acta zoológica mexicana, 39, 1-20.
Estes, J., Terborgh, J., Brashares, J., Power M., Berger J., Bond W., Carpenter, S. R., Essington, T., Holt, R. D., Jackson, J. B. C., Marquis, R. J., Oksanen, L., Oksanen, T., Paine, R. T., Pikitch, E. K., Ripple, W. J., Sandin, S. A., Scheffer, M., Schoener, T. W., Shurin, J., Sinclair, A. R. E., Soulé, M. E., Virtanen, R., & Wardle, D. A. (2011). Trophic downgrading of planet earth. Science, 333(6040),301-307. https://doi.org/10.1126/science.1205106
Fleming, T., Breitwisch, R., & Whitesides, G. (1987) Patterns of tropical vertebrate frugivore diversity. Annual Review of Ecology and Systematics, 18, 91-109. https://doi.org/www.jstor.org/stable/2097126
Fragoso, J., Silvius, K., & Correa, J. (2003). Long-distance seed dispersal by tapirs increases seed survival and aggregates tropical trees. Ecology, 84(8),1998–2006. https://doi.org/10.1890/01-0621
Gliessman, S. (2000). Agroecology. CRC Press.
Gómez-Martínez, M., Gutierrez, A.,& DeClerck, F. (2008). Four-eyed opossum (Philander opossum) predation on a coral snake (Micrurus nigrocinctus). Mammalia, 72(4), 350-351. . https://doi.org/10.1515/MAMM.2008.031
Guerrero, S., Sandoval, M., & Zalapa, S. (2000). Determinación de la dieta del mapache (Procyon lotor hernandezii Wagler, 1831) en la costa sur de Jalisco, México. Acta Zoológica Mexicana, (80), 211-221. https://doi.org/10.21829/azm.2000.80801901
Janzen, D. H. (1970). Herbivores and the number of tree species in tropical forest. The American Naturalist, 104(940), 501-528. https://doi.org/10.1086/282687
Janzen, D. H. (1991). Historia natural de Costa Rica. Universidad de Costa Rica.
Jordano, P. (2000). Fruits and frugivory. En M. Fenner (Ed.), Seeds: The Ecology of Regeneration in Plant Communities (2ed., pp. 125-166). CAB International. https://doi.org/10.1079/9780851994321.0125
Jordano, P., Galetti, M., Pizo, M., & Silva, W. (2006). Ligando frugivoria e dispersão de sementes à biologia da conservação. En C. F. Duarte, H. G. Bergallo, M. A. Dos Santos and M. Van Sluys (Eds.), Biologia da conservação: essências (pp 411-436) Editorial Rima.
Jordano, P., García, C., Godoy, J., & García-Castaño, J. (2007). Differential contribution of frugivores to complex seed dispersal patterns. Proceedings of the National Academy of Sciences, 104, 3278-3282. https://doi.org/10.1073/pnas.0606793104
Lizcano, D. (2018). Trampas cámara como herramienta para estudiar mamíferos silvestres: algunas recomendaciones sobre su uso, programas disponibles para manejar archivos y posibilidades adicionales con los datos. Notas Mastozoológicas, 5, 31-35. https://doi.org/10.47603/manovol5n1.31-35
Manson, R., Hernández-Ortiz, V., Gallina, S., & Mehltreter, K. (2008). Agroecosistemas cafetaleros de Veracruz; Biodiversidad, Manejo y Conservación. Instituto Nacional de Ecología.
Manson, R., López, F., Sosa, V., & Ortega, A. (2018). Biodiversidad en cafetales y otros servicios ambientales en cafetales manual de mejores prácticas. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO).
Medina-Fitoria A., Martínez-Fonseca J., Gutiérrez A., van den Berghe E., Jarquín O., Aguirre Y., Salazar M., Robleto S., Toval N., Tórrez M., & Díaz F. (2018). Las ardillas de Nicaragua (Rodentia, Sciuridae): una actualización basada en análisis fenotipíco. Revista Mexicana de Mastozoología, nueva época, 8(2), 48-80.
Mencía, D. (2021). Las ardillas mis vecinas, ¿Cómo se han adaptado a las ciudades? Desde el Herbario CICY, (13), 91-95.
Moguel, P., & Toledo, V. (1999). Conservación de la biodiversidad en sistemas tradicionales de México. Biología de la conservación, 13, 11-21.
Monge, J., & Hilje, L. (2006). Hábitos alimenticios de la ardilla Sciurus variegatoides atrirufus en la Península de Nicoya, Costa Rica. Revista Biología Tropical, 54(2), 681-686.
Ortega, J., & Castro-Arellano, I. (2001). Artibeus jamaicensis. Mammalian Species (662) 1-9. https://doi.org/mp47
Paolucci, L., Pereira, R., Rattis, L., Silvério, D., Marques, N., Macedo, M., & Brando, P. M. (2019). Lowland tapirs facilitate seed dispersal in degraded Amazonian forests. Biotropica, 51(2),245-252.https://doi.org/10.1111/btp.12627
Presley, S. (2000). Eira barbara. Mammalian Species, (636), 1-6. https://doi.org/10.2307/0.636.1
Ramírez, D., Rivero, A., Villalobos, H., Marín, M., Valverde, L., & Acosta, V. (2018). Depredación oportunista sobre Turdus grayi (Passeriformes: Turdidae) por Dasyprocta punctata (Rodentia: Dasyproctidae) en San Vito, Costa Rica. Notas Mastozoológicas, 4(2), 11–12. https://doi.org/10.47603/manovol4n2.11-12
Redford, K. (1992). The Empty Forest. BioScience, 42(6), 412-422. http://www.jstor.org/stable/1311860
Reid, F. (2009). A Field Guide to the Mammals of Central America and Southeast Mexico. Oxford University Press.
Rojas, A., Dávila, A., & Castaño, J. (2014). Morfometría de excretas de cuatro especies de roedores en una plantación forestal en la cuenca del río Cauca. Boletín Científico Centro de Museos de Historia Natural, 18(2),138-143. https://tinyurl.com/25ee48p2
Rumiz, D. (2010). Roles ecologicos de los mamiferos medianos y grandes. En R. B. Wallace, H. Gómez, Z. R. Porcel, D. I. Rumiz (Eds.), Distribución, ecología y conservación de los mamíferos medianos y grandes de Bolivia (pp. 53-73). Centro de Ecología Difusión Simón I. Patiño.
Sáenz-Bolaños, C., Montalvo, V., Carrillo, E., & Fuller, T. (2018). Tayra (Eira barbara) predation of a brown-throated three-toed sloth (Bradypus variegatus) in Costa Rica. Edentata, 19, 70-73.
Sánchez, R., & Moya, M. (2018). Biodiversidad en fincas cafetaleras de Rincón de Mora, San Ramón, Alajuela, Costa Rica. Revista Pensamiento Actual, 18(31), 68-86. https://doi.org/10.15517/PA.V18I31.35666
Sánchez-Brenes, R., & Monge, J. (2021). Períodos de actividad y dieta de Dasyprocta punctata (Gray, 1842) (Rodentia; Dasyproctidae) en agroecosistemas con café, San Ramón, Costa Rica. Acta Zoológica Mexicana, 37, 1-15. https://doi.org/10.21829/azm.2021.3712346
Schmitz, O., Grabowski, J., Peckarsky, B., Preisser, E., Trussell, G., & Vonesh, J. R. (2008). From individuals to ecosystems: toward an integration of evolutionary and ecosystem ecology. Ecology, 89(9), 2436-2445. https://doi.org/10.1890/07-1030.1
Silman, M., Terborgh, J., & Kiltie R. (2003). Population regulation of a dominant rain forest tree by a major seed predator. Ecology, 84(2), 431-438. https://www.jstor.org/stable/3107898
Sinclair, A. (2003). The role of mammals as ecosystem landscapers. Alces: A Journal Devoted to the Biology and Management of Moose, 39, 161-176.
Skutch, A. (1971). A Naturalist in Costa Rica. University Florida Press.
Smythe, N. (1978). The natural history of the Central American Agouti (Dasyprocta punctata). Smithsonian contributions to Zoology, 257, 1-60. https://doi.org/10.5479/si.00810282.257
Terborgh, J., Lopez, L., Nuñez V., Rao, M., Shahabuddin, G., Orihuela, G., Riveros, M., Ascanio, R., Adler, G., Lambert, T., & Balbas, L. (2001). Ecological meltdown inpredator-free forest fragments. Science 294 (5548): 1923-1926. https://doi.org/10.1126/science.1064397
Terborgh, J., Nuñez-Iturri, G., Pitman, A., Valverde, F., Alvarez, P., & Swamy, V. (2008). Tree recruitment in an empty forest. Ecology, 89 (6),1757-1768. https://doi.org/10.1890/07-0479.1
Tilman, D., Cassman, G., Matson, A., Naylor, R., & Polasky, S. (2002). Agricultural sustainability and intensive production practices. Nature, 418, 671-677. https://doi.org/10.1038/nature01014
Theuerkaur, J., Rouys, S., Jourdan, H., & Gula, R. (2011). Efficiency of a new reverse bait trigger snap trap for invasive rats and new standardized abundance index. Ann Zool Fennici, 48, 308-318. https://doi.org/10.5735/086.048.0505
Torre, I., Freixas, L., Arrizabalaga, A., & Díaz, M. (2016). The efficiency of two widely used commercial live traps to develop monitoring protocols for small mammal biodiversity. Ecological Indicators, 66, 481-487. https://doi.org/10.1016/j.ecolind.2016.02.017
Vandermeer, J. (1995). The ecological basis of alternative agriculture. Annual Review of Ecology and Systematics, 26, 201-224. https://doi.org/10.1146/annurev.es.26.110195.001221
Villafañe-Trujillo, A., López-González, C., Kolowski, J. (2018). Throat patch variation in Tayra (Eira barbara) and the potential for individual identification in the field. Diversity, 10(7), 1-23. https://doi.org/10.3390/d10010007
Wainwright, M. (2002). The natural history of Costa Rican Mammals. Zona Tropical Publications.
Walker, E. P. (1968) Mammals of the world. Johns Hopkins University Press.