
COMUNICACIÓN CORTA
Parásitos gastrointestinales zoonóticos y no zoonóticos en ranas de un río urbano tropical de Costa Rica
Gabriela
Pérez-Gómez1![]() & Ana Eugenia Jiménez-Rocha2
& Ana Eugenia Jiménez-Rocha2![]()
1. Universidad Estatal a Distancia, Vicerrectoría de Investigación, Laboratorio de Vida Silvestre y Salud, 2050 Sabanilla, San José, Costa Rica; gabrielaper@uned.ac.cr
2. Universidad Nacional, Escuela de Medicina Veterinaria, Laboratorio de Parasitología, 86-3000 Heredia, Costa Rica; ana.jimenez.rocha@una.ac.cr
Recibido 30-VI-2023 Corregido 29-X-2023 Aceptado 31-X-2023
https://doi.org/10.22458/urj.v16i1.4803
|
ABSTRACT. “Zoonotic and non-zoonotic gastrointestinal parasites in frogs from an urban tropical river of Costa Rica”. Introduction: The urban ecosystems of Costa Rica are home to several anuran species that coexist with still poorly studied parasites. Objective: To report the presence of zoonotic and non-zoonotic gastrointestinal parasites in Hyalinobatrachium fleischmanni, Espadarana prosoblepon, Smilisca sordida, in urban river habtat in San José, Costa Rica. Methods: We analyzed 30 fecal samples, from specimens kept in the laboratory for ten months, with three diagnostic techniques. Results: We detected for the first time in Costa Rica the presence of Giardia duodenalis and Cryptosporidium parvum in H. fleischmanni, E. prosoblepon and S. sordida (with antigen detection tests); in addition, nematodes (Strongylidae and Rhabdias spp.), intestinal ciliates and cestode eggs with other diagnostic techniques. Conclusion: These urban frogs carried at least six types of parasites, some of them, first reports.
Keywords: Endoparasites, parasitology, ecosystem health, zoonoses, urban frogs.
|
RESUMEN. Introducción: Los ecosistemas urbanos de Costa Rica albergan varias especies de anuros que coexisten con parásitos aún poco estudiados. Objetivo: Informar sobre la presencia de parásitos gastrointestinales zoonóticos y no zoonóticos en Hyalinobatrachium fleischmanni, Espadarana prosoblepon y Smilisca sordida, en hábitats fluviales urbanos en San José, Costa Rica. Métodos: Analizamos 30 muestras de heces de ejemplares mantenidos en el laboratorio durante diez meses, utilizando tres técnicas de diagnóstico. Resultados: Detectamos por primera vez en Costa Rica la presencia de Giardia duodenalis y Cryptosporidium parvum en H. fleischmanni, E. prosoblepon y S. sordida (mediante pruebas de detección de antígeno); además, encontramos nematodos (Strongylidae y Rhabdias spp.), ciliados intestinales y huevos de céstodos con otras técnicas de diagnóstico. Conclusión: Estas ranas urbanas tenían al menos seis tipos de parásitos, algunos de ellos primeros registros.
Palabras clave: Endoparásitos, parasitología, salud ecosistémica, zoonosis, ranas urbanas.
|
Los anfibios son uno de los grupos de vertebrados más afectados por la contaminación del recurso hídrico, porque tienen una relación directa con el agua y poseen una piel permeable y sensible a los contaminantes (Santos-Barrera, 2004; Flores et al., 2022). Se ha descrito que estas características biológicas les permiten ser excelentes bioindicadores de contaminación ambiental, especialmente en zonas urbanas (Santos-Barrera, 2004; Palacio et al., 2006; Flores et al., 2022).
Las poblaciones de anfibios urbanos se encuentran expuestas a la contaminación ambiental y a la destrucción de sus hábitats, debido a las actividades desarrolladas por los seres humanos (Homola et al., 2019). El crecimiento urbano y la invasión de la zona de protección de los ríos, provocan cambios estructurales en el curso natural del río, reducen las zonas de reproducción de anuros y aumentan el nivel de la contaminación hídrica con materia fecal (Basanta, 2019; Díaz-García, 2019; Aguilar-López et al., 2020; Flores et al., 2022).
En los ecosistemas urbanos de Costa Rica habitan anuros de las familias Centrolenidae (Hyalinobatrachium fleischmanni, Espadarana prosoblepon), Hylidae (Smilisca sordida) entre otras, que coexisten en ambientes alterados por actividades antrópicas (Kubicki, 2007; Acosta, 2013; Rojas-Morales et al., 2014; Gutiérrez-Vannucchi et al., 2019).
En zonas urbanas los parásitos zoonóticos circulan en la vida silvestre con mayor frecuencia debido a su posible contacto con el ser humano (Santos-Barrera, 2004; Pérez-Gómez et al., 2018). Por ejemplo, Giardia spp. y Cryptosporidium spp., protozoarios comunes en el intestino de la mayoría de los vertebrados y que han sido asociados a fuentes de agua contaminada con heces humanas (Domenech, 2003; Serrano-Martínez et al., 2017). Giardia es un género de protozoario intestinal con al menos ocho especies; en anfibios la especie no zoonótica común es G. agilis reportada por primera vez en el intestino de renacuajos (Lyu et al., 2020). En el caso del protozoario Cryptosporidium fue detectado en ranas en cautiverio utilizadas para consumo humano en Perú (Serrano-Martínez et al., 2017).
Los endoparásitos que afectan a las ranas son similares a los que afectan a otros vertebrados ectotérmicos (peces, reptiles, entre otros) y se ha reportado protozoarios como: Trichodina spp. e Ichthyobodo spp. (Hallinger et al., 2020). Bosch (2003) menciona que el trematodo Ribeiroia ondatrae es causante de malformaciones fenotípicas en ranas, como por ejemplo miembros supernumerarios o incluso faltantes, piel membranosa, entre otros. Los endoparásitos de anfibios reportados en cautiverio por Hallinger et al. (2020) fueron 12 especies en los que predominaban Rhabdias y Strongyloides, con efectos graves en pulmones e infecciones bacterianas en el hígado, pero enfatizan en la necesidad de investigaciones en la biología, epidemiología y patogénesis para poder comprender las diferentes parasitosis en los anfibios. También, Juan-Sallés et al. (2020) demostraron que los Strongyloides son frecuentes en las heces de anfibios.
Con esta investigación buscamos detectar la presencia de parásitos gastrointestinales zoonóticos y no zoonóticos en H. fleischmanni, E. prosoblepon y S. sordida, en un río urbano de San José, Costa Rica.
Realizamos la investigación en la microcuenca del río Torres en San José, Costa Rica, y utilizamos muestras de heces de ranas de la familia Centrolenidae e Hylidae que fueron recolectadas en 2019 y 2021 como parte de un proyecto de investigación desarrollado en conjunto por la Universidad Estatal a Distancia y la Universidad Nacional, de Costa Rica.
Las muestras de heces pertenecen a ranas que provienen de la parte alta-media de la microcuenca del río Torres, una de las más contaminadas de San José. Este río atraviesa tres cantones urbanos: Goicoechea, San José y La Carpio, posee una altitud máxima de 2040m.s.n.m. y la mínima de 900m.s.n.m (Espinoza & Villalta 2004; Pérez-Gómez et al., 2018). Visitamos tres sitios de muestreo con diferentes características fisicoquímicas, microbiológicas y paisajísticas. Los sitios de estudio se describen cualitativamente a continuación: 1- Barrio El Roblar en Guadalupe de Goicoechea, una zona donde el río Torres que concentra una considerable contaminación hídrica, tanto de coliformes fecales como desechos sólidos no reciclables. 2- El Parque del Este en San Rafael de Montes de Oca, el cual es medianamente conservado, posee vegetación en crecimiento secundario y la contaminación hídrica es menor que en el sitio uno. 3- Finca de la Municipalidad de La Unión de Tres Ríos, muy conservado y con poca contaminación hídrica (Alvarado-García et al., 2020).
Para la recolecta de las muestras de heces de las ranas, las mantuvimos en cautiverio por diez meses en terrarios separadas para evitar la contaminación cruzada de muestras y obtener un volumen mayor de heces que permitiera la aplicación de las técnicas de análisis utilizadas. Para el proyecto contamos con los respectivos permisos de investigación, tenencia en cautiverio y las medidas de bioseguridad necesarias para el bienestar de los animales (número de permiso de investigación R-015-2019-OT-CONAGEBIO). Colectamos muestras de heces de cada terrario diariamente, durante el tiempo que se mantuvieron en cautiverio y se conservaron en refrigeración a 4°C.
Para los análisis de las muestras de heces aplicamos tres técnicas estandarizadas para detectar parásitos en anfibios (Serrano-Martínez et al., 2017; Hallinger et al., 2020), así como una prueba rápida para la detección de antígeno, que fue una prueba comercial descrita a continuación:
1. Kit FASTest® CRYPTO-GIARDIA Strip con una sensibilidad del 100% y una especificidad del 92% (Papini et al., 2018), la corrimos al obtener la muestra de heces, durante y después de la captura. Utilizamos 2mg de heces, siguiendo las instrucciones del fabricante (Diagnostik Megacor, 2021). Dicho kit sólo detecta Cryptosporidium parvum y Giardia duodenalis.
2. Examen directo con solución salina al 0,85%, lo realizamos con heces refrigeradas y agregamos una gota de solución salina al 0,85% a 2mg de muestra de heces en un portaobjetos. Luego observamos al microscopio a 40x (Hallinger et al., 2020).
3. Sheather (Sibaja-Morales et al., 2009) modificado. Utilizamos menos de 2mg de heces con 18ml de solución hipersaturada de azúcar.
Calculamos un índice de calidad de agua con el que caracterizamos los grados de contaminación orgánica y fisicoquímica del agua de forma descriptiva de cada sitio de estudio. El índice utilizado fue el de la Fundación Nacional de Saneamiento (NSF: National Sanitation Foundation) (Oram, 2013). Para la aplicación de este índice usamos un medidor multiparamétrico Hanna Instruments HI98194, y se midió: temperatura (°C), pH, oxígeno disuelto (mg/L), saturación de oxígeno (%) y sólidos sedimentables totales (mg/L). Recolectamos dos muestras de agua por sitio (una muestra para análisis de coliformes fecales y la otra muestra para los fisicoquímicos), las conservamos a 4°C y las trasladamos al laboratorio especializado para el análisis de: Coliformes fecales (N.M.P/100mL), Turbidez (NTU), Demanda Biológica de Oxígeno (DBO, mg/L), Nitratos (mg/L) y Fosfatos (mg/L).
Analizamos 30 muestras de heces: 13 de H. fleischmanni, 14 de E. prosoblepon y 3 de S. sordida. Del total de muestras que analizamos, 13 muestras fueron positivas a G. duodenalis (43,3%) y 9 muestras positivas a C. parvum (30%). Encontramos infecciones mixtas en el 30% de las muestras analizadas; mientras que las infecciones simples se detectaron únicamente con G. duodenalis (10%) (tabla 1).
TABLA 1
Porcentaje de infección de C. parvum y G. duodenalis en ranas del río Torres, San José, Costa Rica.
|
Especie de rana |
Sitio de muestreo |
Número de individuos |
% de infección * |
Tipo de infección (S, M) ** |
|
|
C. parvum |
G. duodenalis |
||||
|
S. sordida |
Finca |
3 |
33.3 (1/3) |
33.3 (1/3) |
M |
|
H. fleischmanni |
Guadalupe |
3 |
33.3 (1/3) |
66.6 (2/3) |
S, M |
|
H. fleischmanni |
Parque del Este |
10 |
20 (2/10) |
30 (3/10) |
S, M |
|
H. fleischmanni |
Finca |
0 |
0 |
0 |
|
|
E. prosoblepon |
Guadalupe |
3 |
0 (0/3) |
33.3 (1/3) |
S |
|
E. prosoblepon |
Parque del Este |
10 |
40 (4/10) |
50 (5/10) |
S, M |
|
E. prosoblepon |
Finca |
1 |
100 (1/1) |
100 (1/1) |
M |
|
Totales |
30 |
30.0 (9/30) |
43.3 (13/30) |
- |
|
* % de infección: en paréntesis se encuentra el número de positivos y el total de individuos capturados.
** Tipo de infección, S: simple y M: mixta.
Con la técnica directa en salina obtuvimos dos muestras positivas a nemátodos de Strongylidae y Rhabdias spp. (Fig. 1) y en dos muestras detectamos ciliados intestinales de anfibios. Con la técnica de Sheather obtuvimos dos muestras positivas a huevos de cestodos y huevos de Strongylidae (tabla 2; Fig. 2).
TABLA 2
Parásitos gastrointestinales encontrados en las heces de las ranas, por medio de la técnica directa con solución salina y la técnica de Sheather
|
Especie de rana |
Sitio de estudio |
Directo Salina |
Sheather |
|
S. sórdida |
Finca |
Negativo |
Negativo |
|
H. fleischmanni |
Guadalupe |
Negativo |
Negativo |
|
H. fleischmanni |
Parque del Este |
Rhabdias spp. |
Huevos de céstodos y Strongylidae |
|
H. fleischmanni |
Finca |
Sin datos |
Sin datos |
|
E. prosoblepon |
Guadalupe |
Negativo |
Negativo |
|
E. prosoblepon |
Parque del Este |
Ciliados intestinales, Huevos de Strongylidae |
Negativo |
|
E. prosoblepon |
Finca |
Negativo |
Negativo |
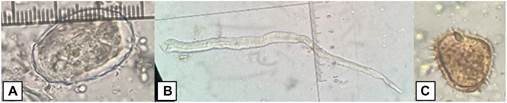
Fig. 1. Parásitos gastrointestinales en heces de las ranas de vidrio, mediante la técnica directa con solución salina. A: Huevo de Strongylidae, B: Rhabdias spp., C: Ciliado intestinal.
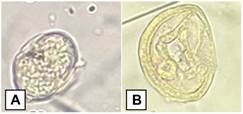
Fig. 2. Parásitos gastrointestinales en heces de ranas de vidrio, mediante la técnica Sheather.
A: Strongylidae, B: Cestodo.
Los análisis microbiológicos del agua en los tres sitios ubican la calidad como clase 4 y 5 según el Reglamento de Evaluación y Clasificación de la Calidad de Cuerpos de Agua Superficiales Nº 33903-MINAE-S de Costa Rica (Decreto Ejecutivo N.º 33903-MINAE-S, 2007); esta es agua no utilizable en la mayoría de las categorías, únicamente con uso limitado para generación hidroeléctrica y navegación (tabla 3).
Este trabajo es el primer reporte de detección de antígenos de G. duodenalis y C. parvum, en H. fleischmanni, E. prosoblepon y S. sordida en heces de ranas recolectadas en zonas urbanas de Costa Rica. Es importante considerar que la detección de parásitos en los anfibios no es un indicativo de enfermedad; muchos parásitos podrían estar en equilibrio con el hospedador por haber sido expuestos anteriormente a estos, o que del todo, no causen efectos patognomónicos (Densmore & Green, 2007).
TABLA 3
Medidas de los parámetros fisicoquímicos y microbiológicos de los tres sitios de estudio en el río Torres,
San José Costa Rica.
|
Parámetro |
Unidades |
Sitio 1* |
Sitio 2* |
Sitio 3* |
|
Oxígeno disuelto |
mg/L |
5,69 |
8,05 |
7,73 |
|
Saturación Oxigeno |
% |
73,63 |
99,07 |
97,83 |
|
Temperatura |
°C |
20,7 |
19,4 |
16,7 |
|
pH |
- |
7,50 |
7,63 |
7,83 |
|
SST |
mg/L |
137,19 |
98,33 |
78,19 |
|
Coliformes fecales |
N.M.P/mL |
2x105 |
2,0 x 103 |
1,8 x 103 |
|
Turbidez |
NTU |
11,6 ± 0,1 |
1,3 ± 0,1 |
4,0 ± 0,1 |
|
DBO |
mg/L |
63 ± 3 |
< 3 |
5 ± 1 |
|
Nitratos |
mg/L |
2,9 ± 0,1 |
7,2 ± 0,1 |
7 ± 0,1 |
|
Fosfatos |
mg/L |
4,3 ± 0,1 |
0,35 ± 0,03 |
0,54 ± 0,03 |
|
Resultado del índice NSF |
49 |
68 |
63 |
|
|
Descripción NSF |
Mala |
Media |
Media |
|
*Sitio 1: Guadalupe, Sitio 2: Parque del Este, 3: Finca de la Municipalidad de la Unión de Tres Ríos.
La detección de G. duodenalis y C. parvum en las tres especies de ranas analizadas, podría sugerir un potencial bioindicador de contaminación antrópica, debido a la exposición del hábitat a los altos contenidos de materia fecal de origen humano, como lo comprobamos con los resultados de coliformes fecales (entre 1800 y 200000 N.M.P/mL, tabla 3) en el río Torres (Santos et al., 2015; Strong et al., 2017).
En el caso de la Giardia, en anfibios se ha reportado G. agilis como un parásito común (Lyu et al., 2020), pero por las características del hábitat urbano en el que se desarrollan estas ranas, y el resultado positivo de las muestras ante la detección por antígeno de G. duodenalis, consideramos importante, realizar más investigación, aumentando el tamaño muestral, hacer pruebas diagnósticas complementarias, como el uso de técnicas moleculares; incluso estudios histopatológicos, para determinar si las infecciones parasitarias en las ranas de vida libre, causan efectos negativos en la salud de estas.
Por otra parte, los anfibios en cautiverio poseen diversos factores de exposición que los hace susceptibles a infecciones y reinfecciones parasitarias, por ejemplo: el estado del sistema inmunológico, el estado etario, condiciones inadecuadas de higiene de los recintos, la temperatura y humedad relativa, así como el hacinamiento y la nutrición, entre otros (van Zanten & Simpson, 2021; Hallinger et al., 2020; Burraco & Gomez-Mestre, 2016), mientras que los anfibios que se encuentran en vida libre poseen múltiples y complejas condiciones ambientales, porque interactúan muchos factores que no pueden ser controlados, y por esto se observan prevalencias de infecciones parasitarias de hasta un 90% (Hallinger et al., 2020; Amin et al., 2012).
En cuanto a los parásitos no zoonóticos como nemátodos, cestodos, ciliados intestinales y Rhabdias spp. detectados en este estudio, encontramos que son comunes en anfibios manejados en cautiverio, principalmente los estrongilidos (Hallinger et al., 2020; Juan-Sallés et al., 2020; Campiao et al., 2014), similar a las ranas de vida libre reportadas en este trabajo. Sin embargo, los datos de parásitos gastrointestinales en centrolénidos e hylidos urbanos son muy escasos.
Los nemátodos del género Rhabdias spp. se encuentran dentro de los endoparásitos más comunes en anfibios y reptiles, tanto de vida libre como en cautiverio, y se sabe que en anfibios de vida libre puede causar neumonía, lesiones cutáneas y condición corporal disminuida (Hallinger et al., 2020; Campiao et al., 2014; Toledo et al., 2013; Eisenberg, & Pantchev, 2009). Así mismo, las infecciones causadas por el género Strongyloides pueden llegar a causar en los anfibios una pérdida considerable de proteínas que les puede ocasionar una enteropatía (Patterson-Kane et al., 2001). Sin embargo, en este estudio sólo reportamos la presencia de estos agentes, se requeriría un estudio adicional para determinar si se presentan o no afectaciones sobre la salud de las ranas.
La primera evidencia por detección de antígenos de los parásitos zoonóticos G. duodenalis y C. parvum en anfibios urbanas del río Torres en San José, Costa Rica; proporciona un importante hallazgo y línea de investigación futura para determinar si existe o no afectación en la salud de estos anuros; además, sugerimos a las ranas como un posible, potencial bioindicador de contaminación ambiental. Además, se requiere de más investigaciones sobre endoparásitos gastrointestinales en anfibios urbanos de Costa Rica.
AGRADECIMIENTOS
Agradecemos a la Universidad Estatal a Distancia de Costa Rica y a la Universidad Nacional de Costa Rica por el financiamiento otorgado para el desarrollo del proyecto. Por el trabajo de campo y de laboratorio agradecemos a Sergio Quesada, Ana Cristina Montoya, Josimar Estrella, Joseph Vargas y Luis Vargas.
ÉTICA, CONFLICTO DE INTERESES Y DECLARACIÓN DE FINANCIAMIENTO
Declaramos haber cumplido con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en la preparación de este documento; que no hay conflictos de interés de ningún tipo, y que todas las fuentes financieras se detallan plena y claramente en la sección de agradecimientos. Asimismo, estamos de acuerdo con la versión editada final de esta publicación. El respectivo documento legal firmado se encuentra en los archivos de la revista.
La declaración de contribución de cada autor es la siguiente: G.P.G.: Diseño del estudio y recolección de datos. G.P.G y A.E.J.R.: análisis de datos. G.P.G.: Recopilación de datos. Todos los coautores.: preparación y aprobación final del manuscrito.
REFERENCIAS
Acosta, V. (2013). Pérdida de hábitats y biodiversidad desvanecida en la ciudad de Heredia (Costa Rica). Ambientico 232-233(10), 64-74.
Aguilar-López, J. L., Ortiz-Lozada, L., Pelayo-Martínez, J., Mota-Vargas, C., Alarcón-Villegas, L. E., & Demeneghi-Calatayud, A. P. (2020). Diversidad y conservación de anfibios y reptiles en un área protegida privada de una región altamente transformada en el sur de Veracruz, México. Acta zoológica mexicana, 36, e3612164. https://doi.org/10.21829/azm.2020.3612164
Alvarado-García, V., Pérez-Gómez, G., & Gastezzi-Arias, P. (2020). Calidad del ecosistema urbano del río Torres, San José, Costa Rica: factores bióticos y abióticos. Cuadernos de Investigación UNED, 12(2), 527-542. https://doi.org/10.22458/urj.v12i2.3016
Amin, O. M., Düşen, S., & Oğuz, M. C. (2012). Review of the helminth parasites of Turkish anurans (Amphibia). Scientia Parasitologica, 13(1), 1-16.
Basanta, M. D. (2019). Ecología y evolución de enfermedades emergentes en anfibios: una revisión de ranavirus y quitridiomicosis. Revista Latinoamericana de Herpetología, 2(1), 9-25.
Bosch, J. (2003). Nuevas amenazas para los anfibios: enfermedades emergentes. Munibe, 16, 56-73.
Burraco, P., & Gomez-Mestre, I. (2016). Physiological stress responses in amphibian larvae to multiple stressors reveal marked anthropogenic effects even below lethal levels. Physiological and Biochemical Zoology, 89(6), 462-472.
Campiao, K. M., Morais, D. H., Dias, O. T., Aguiar, A., Toledo, G., Tavares, L. E., & Da Silva, R. J. (2014). Checklist of helminth parasites of amphibians from South America. Zootaxa, 3843(1), 1-93.
Decreto Ejecutivo Nº 33903-MINAE-S. (2007) Reglamento para la Evaluación y Clasificación de la Calidad de Cuerpo de Agua Superficiales. Diario Oficial La Gaceta, 178. Del 17 de setiembre del 2007. Costa Rica. https://tinyurl.com/yswqjhng
Densmore, C. L., & Green, D. E. (2007). Diseases of amphibians. ILAR journal, 48(3), 235-254.
Diagnostik Megacor. (Versión 11/2021). FASTest® CRYPTO-GIARDIA Strip: Kit de análisis para la detección cualitativa de antígenos de Cryptosporidium parvum y / o Giardia duodenalis en las heces de pequeños, grandes animales y mascotas. Diagnostik Megacor.
Domenech, J. (2003). Cryptosporidium y Giardia, problemas emergentes en el agua de consumo humano. Offarm, 22(11), 112-116.
Díaz-García, J. M. (2019). Servicios ecosistémicos de los anfibios en México: un análisis de diversidad, distribución y conservación. Etnobiología, 17(1), 49-60.
Eisenberg, T., & Pantchev, N. (2009). Infection with Rhabdias tokyoensis (Nematoda: Rhabdiasidae) in European captive-bred swordtail newts, Cynops ensicauda (Amphibia: Salamandridae). Salamandra, 45(2), 91-4.
Espinoza, C. & Villalta, R. (2004). Primera etapa del plan de manejo integral del recurso hídrico: la estrategia nacional para la GIRH en Costa Rica. Estudio de caso sobre la contaminación de la cuenca de los ríos Virilla y Grande de Tárcoles. Ministerio del Ambiente y Energía (MINAE).
Flores, B., Verdezota, M.,Simbaña, J., & Domínguez-Gaibor, I. (2022). Posibles efectos del Cambio Climático en los anfibios de la Amazonía Ecuatoriana. Green World Journal, 5(1/006), 1-25. https://doi.org/10.53313/gwj51006
Gutiérrez-Vannucchi, A. C., Rodríguez-Umaña, P., Sandoval, L., & García-Rodríguez, A. (2019). Variación en la actividad acústica de Hyalinobatrachium fleischmanni (Anura: Centrolenidae) en un ambiente urbano con diferentes niveles de ruido antropogénico. Revista de Biología Tropical, 67(2), 249-258. https://dx.doi.org/10.15517/rbt.v67i2supl.37237
Hallinger, M. J., Taubert, A., & Hermosilla, C. (2020). Endoparasites infecting exotic captive amphibian pet and zoo animals (Anura, Caudata) in Germany. Parasitology Research, 119(11), 3659-3673.
Homola, J. J., Loftin, C. S., & Kinnison, M. T. (2019). Landscape genetics reveals unique and shared effects of urbanization for two sympatric pool-breeding amphibians. Ecology and Evolution, 9(20), 11799-11823. https://doi.org/10.1002/ece3.5685
Juan-Sallés, C., Almagro, V., Carbonell, L., Valls, X., Montesinos, A., & Fernández-Bellon, H. (2020). Enfermedades infecciosas y parasitarias en anfibios en cautividad: estudio retrospectivo de 131 pacientes. Clínica Veterinaria de Pequeños Animales, 40(1), 15-27.
Kubicki, B. (2007). Ranas de vidrio de Costa Rica. Editorial INBio.
Lyu, Z., Cheng, J., Shao, J., Ye, Q., Bai, H., & Wen, J. (2020). An investigation of the prevalence of Giardia agilis in anuran amphibians from fourteen areas in China. International Journal for Parasitology: Parasites and Wildlife, 12, 46-52.
Oram, B. (2013). Online Calculator for Determing A Water Quality Index. http://www.water-research.net/watrqualindex/
Patterson-Kane, J. C., Eckerlin, R. P., Lyons, E. T., & Jewell, M. A. (2001). Strongyloidiasis in a Cope's grey tree frog (Hyla chrysoscelis). Journal of Zoo and Wildlife Medicine, 32(1), 106-110.
Palacio, J. A., Muñoz , E. M., Gallo, S. M., & Rivera, M. (2006). Anfibios y Reptiles del Valle de Aburrá. Editorial Zuluanga.
Papini, R., Bonelli, F., Montagnani, M., & Sgorbini, M. (2018). Evaluation of three commercial rapid kits to detect Cryptosporidium parvum in diarrhoeic calf stool. Italian Journal of Animal Science, 17(4), 1059-1064.
Pérez-Gómez, G., Jiménez-Rocha, A. E., & Bermúdez-Rojas, T. (2018). Parásitos gastrointestinales de aves silvestres en un ecosistema urbano tropical en Heredia, Costa Rica. Revista de Biología Tropical, 66(2), 788-798.
Rojas-Morales, J. A., Castro-Gómez, A., & Escobar-Lasso, S. (2014). Joyas de los Andes tropicales: Colombia tierra de Ranas de Cristal. Bioma, 19(2), 1-38.
Santos, T., Melo, R., Costa-Silva, D., Nunes, M., Rodrigues, N., & Franco, J. (2015). Assessment of water pollution in the Brazilian Pampa biome by means of stress biomarkers in tadpoles of the leaf frog Phyllomedusa iheringii (Anura: Hylidae) PeerJ, 3, e1016. https://doi.org/10.7717/peerj.1016
Santos-Barrera, G. (2004). Enfermedades infecciosas en poblaciones de anfibios. Biodiversitas, 56, 1-6.
Serrano-Martínez, E., Quispe, H. M., Plascencia P. L, & Hinostroza M. E. (2017). Parásitos Zoonóticos en Ranas Destinadas a la Elaboración de Bebidas para el Consumo Humano en Lima, Perú. Revista de Investigaciones Veterinarias del Perú, 28(3), 642-649. https://dx.doi.org/10.15381/rivep.v28i3.13290
Sibaja-Morales, K. D., De Oliveira, J. B., Jiménez, A. E., Hernández, J., Prendas, J., Arroyo, F., Sandí, J., Nuñez, Y., & Baldi, M. (2009). Gastrointestinal parasites and ectoparasites of Bradypus variegatus and Choloepus hoffmanni sloths in captivity from Costa Rica. Journal of Zoo and Wildlife Medicine, 40(1), 86-90.
Strong, R., Martin, F. L., Jones, K. C., Shore, R. F., & Halsall, C. J. (2017). Subtle effects of environmental stress observed in the early life stages of the Common frog, Rana temporaria. Scientific Reports, 7(1), 1-13.
Toledo, G. M., Aguiar, A., Silva, R. J., & Anjos, L. A. (2013). Helminth fauna of two species of Physalaemus (Anura: Leiuperidae) from an undisturbed fragment of the Atlantic Rainforest, Southeastern Brazil. The Journal of Parasitology, 99(5), 919-922.
van Zanten, T. C., & Simpson, S. C. (2021). Managing the health of captive groups of reptiles and amphibians. Veterinary Clinics: Exotic Animal Practice, 24(3), 609-645.