
UNED Research Journal (e-ISSN 1659-441X), Vol.15(1): e4584, June, 2023
Diversidad de ictiofauna y calidad del agua en ríos de la zona sur de Costa Rica donde se construyeron diques y canales para contención de inundaciones
Juan
Carlos Villegas-Arguedas1![]()
1. Universidad Nacional de Costa Rica, Doctorado en Ciencias Naturales para el Desarrollo, Heredia, Costa Rica; jcvilleg@gmail.com
Recibido 02-II-2023 □ Corregido 17-III-2023 □ Aceptado 28-III-2023
DOI: https://doi.org/10.22458/urj.v15i1.4584
|
ABSTRACT. “Ichthyofauna diversity and water quality in rivers in the southern zone of Costa Rica where dikes and channels were built to contain floods”. Introduction: Freshwater fish can be negatively affected by human disturbances like infrastructure, dikes or canals, and extensive agriculture, which affect forest cover and promote sedimentation. Objetive: To evaluate the spatio-temporal composition of freshwater fish and its relationship with some physical-chemical water variables in three tropical rivers. Methods: I worked in the Grande de Térraba y Esquinas basins, Costa Rica, in three control sites and three sites with dike and channel influence. I sampled twice a month at the end of the rainy season (October-December, 2010) and the beginning of the dry season (January-March, 2011). I measured water quality variables and determined the type of environment or substrate, speed and altitude. Results: I captured 742 fish (24 species, 12 families). The most representative were Astyanax aeneus (44%), Poeciliopsis retropinna (14%), Dormitator latifrons (8%), Priapichthys panamensis (7%), Cryptotheros sajica (6%) and Brachyrhaphis roseni (4%). There were no statistically significant differences among sites. Conclusion: The fluctuations of environmental variables, and the trends in fish abundance, richness, and distribution, did not differ among control sites and anthropologically affected sites.
Keywords: Fish, infrastructure, biodiversity, abundance, richness, Osa.
|
RESUMEN. Introducción: Los peces de agua dulce pueden verse afectados negativamente por perturbaciones humanas como infraestructura, diques o canales y agricultura extensiva, que afectan la cubierta forestal y promueven la sedimentación. Objetivo: Evaluar la composición espacio-temporal de los peces de agua dulce y su relación con algunas variables físico-químicas del agua en tres ríos tropicales. Métodos: Trabajé en las cuencas Grande de Térraba y Esquinas, Costa Rica, en tres sitios de control y tres sitios con influencia de diques y canales. Tomé muestras dos veces al mes al final de la temporada de lluvias (octubre-diciembre de 2010) y el comienzo de la temporada seca (enero-marzo de 2011). Medí variables de calidad del agua y determiné el tipo de ambiente o sustrato, velocidad y altitud. Resultados: Capturé 742 peces (24 especies, 12 familias). Los más representativos fueron Astyanax aeneus (44%), Poeciliopsis retropinna (14%), Dormitator latifrons (8%), Priapichthys panamensis (7%), Cryptotheros sajica (6%) y Brachyrhaphis roseni (4%). No hubo diferencias estadísticamente significativas entre los sitios. Conclusión: Las fluctuaciones de las variables ambientales y las tendencias en la abundancia, riqueza y distribución de peces no difirieron entre los sitios de control y los sitios afectados antropológicamente.
Palabras clave: Peces, infraestructura, biodiversidad, abundancia, riqueza, Osa.
|
Los ecosistemas acuáticos están condicionados por una complicada red de factores ambientales, en la que las variables abióticas (pH, oxígeno disuelto, demanda bioquímica de oxígeno, temperatura, nitratos, fosfatos, sedimentos, temperatura, penetración de luz, tamaño, disponibilidad y profundidad de hábitat, cobertura forestal de riveras, nivel del agua, velocidad, gradientes, altitud, tipo de sustrato, etc.) así como las bióticas, (depredación, oferta alimentaria y competencia tanto intra como interespecífica) son algunos de los principales factores que condicionan la dinámica poblacional de los organismos que allí se encuentren (Pérez-Castillo & Rodríguez, 2008).
Las variaciones de los ensamblajes taxonómicos en peces de agua dulce, responden a patrones de la variación físico-química o calidad del agua (Díaz-Ruiz et al., 2004), aunque también pueden verse influenciadas por alteraciones climáticas o por las condiciones de heterogeneidad ecosistémica y disponibilidad de hábitat (Bussing, 2002).
Los peces han demostrado ser buenos indicadores ambientales en la identificación de ecosistemas contaminados o alterados por influencia humana (Torres-Castro et al., 2009), pues presentan variaciones en sus asociaciones de especies cuando algunas condiciones ambientales como el oxígeno disuelto, la salinidad o la temperatura varían (González et al., 2009); así como el impacto negativo que sobre las poblaciones de peces generan altas concentraciones de sólidos, particularmente los suspendidos (Wilber & Clarke, 2001).
Esta investigación procuró evaluar la composición espacio-temporal de las comunidades de peces de agua dulce y su relación con algunas variables físico-químicas del agua en ríos que discurren o no, por comunidades humanas en la zona sur de Costa Rica donde se han construido diques o canales para contención de inundaciones, construcciones que hipotéticamente alteran la ictiodiversidad y la calidad del agua, durante el periodo final de la época lluviosa e inicio de la estación seca.
MATERIALES Y MÉTODOS
La investigación la desarrollé desde finales de la época lluviosa (octubre, noviembre y diciembre de 2010) hasta el inicio de la época seca (enero, febrero y marzo de 2011) seis ríos de las cuencas bajas Grande de Térraba y Esquinas (quebrada Zapatero, río Camaronal, río Coto, quebrada Chiricanos, río Corredores y río Abrojo), en la vertiente pacífico sur de Costa Rica entre los 08°37'20,50" y 08°57'24,55" N y los 082°54'26,42" y 083°31'58,80" W. En esta región de Costa Rica predomina el bosque húmedo tropical, con rangos de lluvia anuales entre 3 050 y 4 820mm y temperaturas medias anuales de 27°C con rangos entre 32 y 22°C (Solano & Villalobos, 2000).
Ubiqué un sitio de muestreo en cada uno de seis ríos seleccionados, tres de estos ríos presentan en los sitios de muestreo la construcción de diques o canales para contención de inundaciones, con alteración de cauces, rompimiento de la loza natural del río y deformación de la sinuosidad natural. Los otros tres ríos son de referencia debido a que son menos alterados o no presentan tales deformaciones (río Camaronal, río Coto y río Abrojo).
En cada uno de los seis sitios elegidos tomé una muestra bimensual de los parámetros físico-químicos del agua y de peces, para un total de 12 muestreos. Para la captura de los peces utilicé la pesca eléctrica (Cowx, 1990, Persat & Copp, 1990), mediante un equipo Samus, modelo 725G configurado a 150-200w (400 voltios aproximadamente), 99Hz.
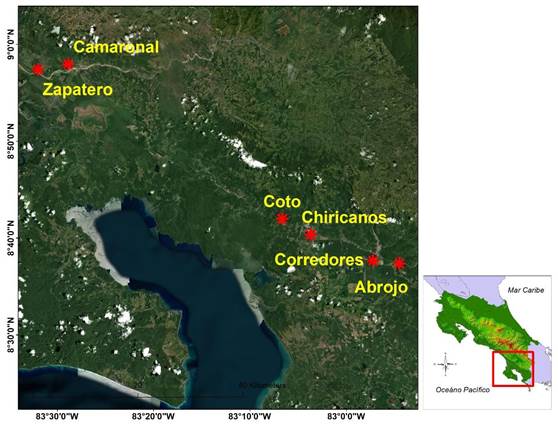
Fig. 1. Ubicación de puntos de muestreo, zona sur, Costa Rica
El muestreo consistió en la recolección de los peces que fueron afectados por las descargas eléctricas en un trayecto de aproximadamente 50m y con frecuencia de una descarga cada 10m, para un total de cinco descargas en cada estación de muestreo, tratándose de incluir los diferentes tipos de hábitat: remansos, pozas, chorros, fondos arenosos, rocosos o arenoso-rocoso en concordancia con los criterios y sugerencias Protti et al. (2007). Para la recolección de la muestra utilicé una red tipo chinchorro de 2,5 x 1,5m y 1,1cm de luz de malla. Todos los muestreos se realizaron a menos de un metro de profundidad.
Los peces recolectados los coloqué en contenedores individualizados para cada sitio de muestreo hasta su traslado a las instalaciones del Ministerio del Ambiente y Energía en Golfito para ser posteriormente cuantificados e identificados al nivel taxonómico específico mediante las claves de Villa (1992) y Bussing (2002). La adscripción taxonómica nomenclatural sigue los criterios de Eschmeyer et al. (2021).
La riqueza de especies está representada por la cantidad total de las especies recolectadas por sitios de muestreo, mismas que también permiten definir el número total de las especies dominantes o con importancia numérica que estimé a partir de las especies que aportaron más del 80% de la abundancia total de captura por sitio de muestreo (Ayala-Pérez et al., 1998).
Para estimar la Beta diversidad, utilicé el índice de disimilitud de Bray -Curtis (Legendre & De Cáceres, 2013) evaluándose el recambio de especies que se muestra en un análisis de conglomerados donde la distancia entre los mismos está definida por la del par de objetos más distantes, conglomerado que determiné tomando el coeficiente de correlación cofenética mayor según Fowler et al. (1998) y un diagrama de Venn donde muestro el número de especies compartidas y exclusivas entre la condición de ambientes alterados y no alterado según presentaron diques y canales en los sitios de muestreo.
La diversidad alfa de la ictiofauna dulceacuícola se estableció mediante el método “Bootstrap” para obtener intervalos de confianza de números de Hill representados en curvas iNEXT de rarefacción y extrapolación según los criterios q=0; q=1 y q=2 de Chao et al. (2014) y Hsieh et al. (2016) y su método de cálculo en línea: https://chao.shinyapps.io/iNEXTOnline/ (Hsieh et al., 2022).
En cada estación de seguimiento, previo a la toma de la muestra de la ictiofauna, determiné el valor in situ de las variables físico-químicas del agua oxígeno disuelto (OD), porcentaje de saturación de oxígeno (Sat), conductividad (Cond.), temperatura (Temp), salinidad (Sal), sólidos disueltos totales (SDT), sólidos sedimentables (Ssed), turbidez (Sech) y concentración ión hidrógeno (pH), además de la altitud, todas mediante un medidor portátil multiparámetro Thermo Scientific, modelo Orion 5-Star. La cuantificación de los Ssed (±1mg/l) la realicé con los conos Imhoff para decantación de una hora de la muestra según el protocolo establecido por el Programa Ambiental Regional para Centroamérica de la Comisión Centroamericana de Ambiente y Desarrollo (Programa Ambiental Regional para Centro América, Comisión Centroamericana de Ambiente y Desarrollo [PROARCA-CCAD], 2004).
Para la determinación de la Secchi del agua utilicé un disco La Motte de 30cm de diámetro, clasificándose arbitrariamente en las tres categorías definidas por Protti et al. (2007): I. turbia (menor de 10cm), II. semi turbia (entre 11 y 20cm) y III. cristalina (mayor de 21cm o mayor que la profundidad de muestreo la cual no superó el metro de profundidad). La estimación consistió en introducir el disco en el agua bajándolo lentamente por medio de una cuerda con marcas indicativas cada 5cm, hasta que el mismo no fuera perceptible a la vista, momento en el cual registré la respectiva profundidad.
Para establecer la relación entre las variables de diversidad, disimilitud y abundancia de las especies y la influencia por la construcción de diques y canales sobre éstas en los ríos muestreados, utilicé la ordenación PCoA de Análisis de Coordenadas Principales con la matriz de disimilitud de Bray-Curtis, utilizando como factor de clasificación "alterado y no alterado" así como el sitio de muestreo.
RESULTADOS
Durante el periodo de estudio logré capturar 742 especímenes pertenecientes a 24 especies de peces y a 12 familias taxonómicas (Tabla 1). Seis de ellas representaron el 83,29 % de la captura total: Astyanax aeneus (44,20%), Poeciliopsis retropinna (14,15%), Dormitator latifrons (8,22%), Priapichthys panamensis (7,28%), Criptotheros sajica (5,53%) y Brachyrhaphis roseni (3,91%). A. aeneus y P. retropinna fueron las especies más abundantes tanto en ríos con diques y canales como en ríos sin esta infraestructura humana.
El sitio de muestreo que aportó la mayor cantidad de especies (n= 14) e individuos (n= 203) fue el río Corredores, río al cual se le construyen diques y canales para contención de inundaciones en la Ciudad Neilly. No obstante, otro río sin esta influencia de modificaciones en su cauce (Camaronal) también registró un número similar de especies (n=13). Las mayores abundancias de capturas se registraron en ríos con este tipo de infraestructura humana río Corredores y río Zapatero (Tabla 2, Fig. 2).
La mayor diversidad se registró en un río sin influencia de infraestructura, el Camaronal (Hill=6,96), seguido de uno con dicha influencia, el río Corredores (Hill=5,42). La diversidad más baja se registró en el río Coto (Hill=2,87), y la menor equidad la registró el río Chiricanos (Hill=1,96); mientras que en general, la mayor diversidad de peces de agua dulce se concentró en ríos que presentan construcción de diques y canales (Hill=7,34) (Fig. 3).
Abundancia numérica, porcentaje individual y acumulado de captura para las especies ícticas registradas entre octubre 2010 y marzo 2011, Zona Sur, Costa Rica (N=742)
|
Familia |
Especie |
Con influencia |
Sin influencia |
Total |
|||
|
n |
% |
n |
% |
n |
% |
||
|
Characidae |
Astyanax aeneus |
163 |
38,81 |
165 |
51,24 |
328 |
44,20 |
|
Poeciliidae |
Poeciliopsis retropinna |
46 |
10,95 |
59 |
18,32 |
105 |
14,15 |
|
Eleotridae |
Dormitator latifrons |
60 |
14,29 |
1 |
0,31 |
61 |
8,22 |
|
Poeciliidae |
Priapichthys panamensis |
50 |
11,90 |
4 |
1,24 |
54 |
7,28 |
|
Cichlidae |
Criptotheros sajica * |
34 |
8,10 |
7 |
2,17 |
41 |
5,53 |
|
Poeciliidae |
Brachyrhaphis roseni |
0 |
0,00 |
29 |
9,01 |
29 |
3,91 |
|
Mugilidae |
Agonostomus monticola |
9 |
2,14 |
16 |
4,97 |
25 |
3,37 |
|
Eleotridae |
Gobiomorus maculatus |
8 |
1,90 |
14 |
4,35 |
22 |
2,96 |
|
Poeciliidae |
Poeciliopsis turrubarensis |
20 |
4,76 |
0 |
0,00 |
20 |
2,70 |
|
Poeciliidae |
Poecilia gillii |
0 |
0,00 |
14 |
4,35 |
14 |
1,89 |
|
Characidae |
Brycon behreae |
5 |
1,19 |
4 |
1,24 |
9 |
1,21 |
|
Eleotridae |
Eleotris picta |
6 |
1,43 |
3 |
0,93 |
9 |
1,21 |
|
Characidae |
Roeboides ilseae * |
6 |
1,43 |
0 |
0,00 |
6 |
0,81 |
|
Heptapteridae |
Rhamdia quelen |
2 |
0,48 |
3 |
0,93 |
5 |
0,67 |
|
Gobiidae |
Awaous transandeanus |
3 |
0,71 |
0 |
0,00 |
3 |
0,40 |
|
Curimatidae |
Cyphocharax magdalenae |
2 |
0,48 |
0 |
0,00 |
2 |
0,27 |
|
Pimelodidae |
Pimelodella chagresi |
1 |
0,24 |
1 |
0,31 |
2 |
0,27 |
|
Cichlidae |
Amphilophus lyonsi |
1 |
0,24 |
0 |
0,00 |
1 |
0,13 |
|
Loricariidae |
Hemiancistrus aspidolepis |
1 |
0,24 |
0 |
0,00 |
1 |
0,13 |
|
Rivulidae |
Rivulus hildebrandi |
1 |
0,24 |
0 |
0,00 |
1 |
0,13 |
|
Characidae |
Hyphessobrycon savagei * |
0 |
0,00 |
1 |
0,31 |
1 |
0,13 |
|
Lebiasinidae |
Piabucina boruca * |
0 |
0,00 |
1 |
0,31 |
1 |
0,13 |
|
Cichlidae |
Andinoacara coeruleopunctatus |
1 |
0,24 |
0 |
0,00 |
1 |
0,13 |
|
Cichlidae |
Amphilophus altifrons |
1 |
0,24 |
0 |
0,00 |
1 |
0,13 |
|
Total |
420 |
100,00 |
322 |
100,00 |
742 |
100,00 |
|
*Especie endémica de la zona de estudio
Tabla 2
Diversidad y equidad según números de Hill por sitios de muestreo, zona sur de Costa Rica, 2011
|
Influencia |
Sitio |
Ind. n |
Sp. n |
Números de Hill |
|||
|
Diversidad |
Equidad |
Diversidad |
Equidad |
||||
|
Con influencia |
Corredores |
203 |
14 |
5,42 |
3,69 |
7,34 |
4,82 |
|
Zapatero |
126 |
8 |
3,23 |
2,57 |
|||
|
Chiricanos |
91 |
11 |
3,34 |
1,96 |
|||
|
Sin influencia |
Abrojo |
116 |
8 |
3,49 |
2,56 |
5,17 |
3,21 |
|
Coto |
116 |
6 |
2,87 |
2,39 |
|||
|
Camaronal |
90 |
13 |
6,96 |
4,84 |
|||
|
Total |
|
742 |
24 |
|
|
|
|
Para la diversidad beta registré la mayor diferencia comunitaria entre dos ríos antagónicos para su influencia antrópica, entre el río Coto y el río Zapatero (Bray-Curtis= 20,90%), mientras que los ríos más similares en su composición de especies fueron Chiricanos y Coto con un 70,26 % de similitud entre sus especies (Tabla 3, Fig. 4).
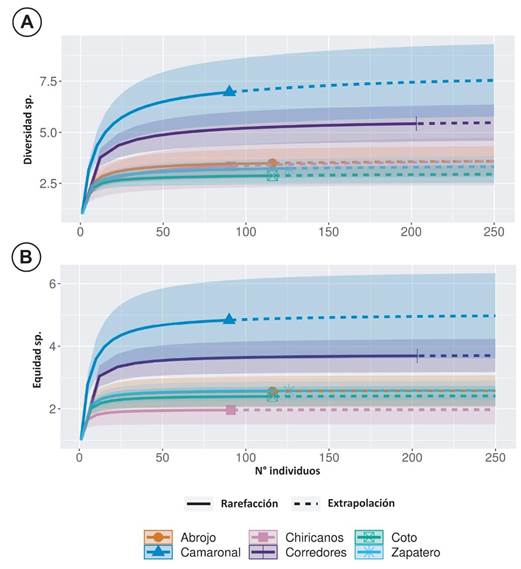
Fig. 2. Diversidad (A) equidad (B) por sitios de muestreo a partir de rarefacción de sus números de Hill, Zona Sur, Costa Rica, 2011.
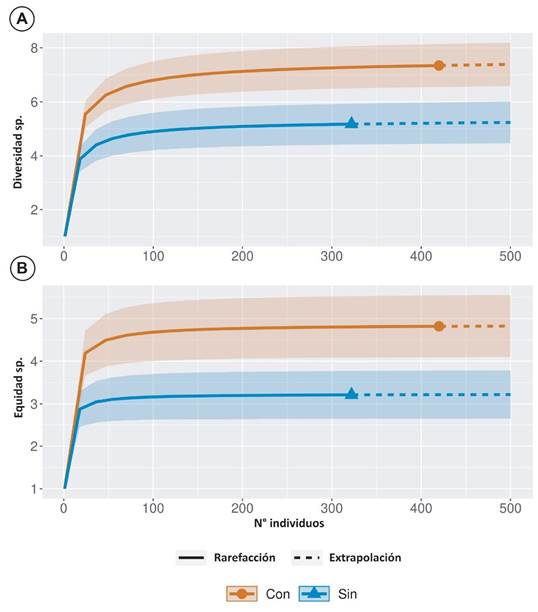
Fig. 3. Diversidad (A) equidad (B) por condición con o sin diques y canales en los sitios de muestreo a partir de rarefacción de sus números de Hill, Zona Sur, Costa Rica, 2011.
Tabla 3
Porcentajes de similitud entre composición comunitaria de especies entre los ríos evaluados, Zona Sur, Costa Rica, 2011
|
Sitios |
% Similitud Bray-Curtis |
|||||
|
Abrojo |
Camaronal |
Chiricanos |
Corredores |
Coto |
Zapatero |
|
|
Abrojo |
|
|
|
|
|
|
|
Camaronal |
57,46 |
|
|
|
|
|
|
Chiricanos* |
68,58 |
57,39 |
|
|
|
|
|
Corredores* |
53,78 |
43,93 |
56,38 |
|
|
|
|
Coto |
68,59 |
44,43 |
70,26 |
57,73 |
|
|
|
Zapatero* |
27,88 |
39,69 |
29,93 |
23,23 |
20,90 |
|
*Con diques y canales
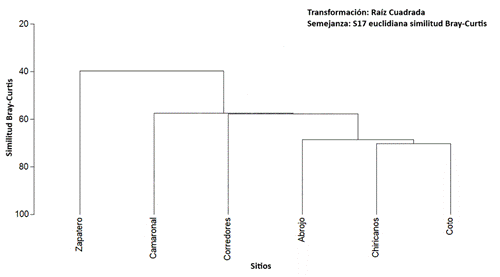
Fig. 4. Análisis de conglomerados para la diversidad beta de ríos evaluados, zona sur, Costa Rica.
De las 24 especies registradas, un total de 11 especies se registraron en ríos tanto con construcción de diques y canales, con en ríos sin esta influencia de infraestructura humana, únicamente cuatro especies son exclusivas de ríos que no tienen la influencia de la infraestructura (Fig. 5).
Las menores fluctuaciones en el oxígeno disuelto se presentaron en las estaciones Coto, Camaronal y Chiricanos en las que se mantuvo aproximadamente entre el ámbito de los 6 y 8mg/l; los valores más altos se registraron en la estación Corredores y los mínimos en Zapatero. La saturación de oxígeno presentó un comportamiento congruente con las concentraciones de oxígeno, tendiendo al alza en el río Corredores y Coto, mientras que en la quebrada Zapatero su tendencia fue siempre a la baja. La mayor saturación se registró en febrero en Corredores (198,4%) y la menor en la quebrada Zapatero (6,3%) en febrero (Tabla 4).
La conductividad del agua presentó los valores más altos en el río Abrojo durante enero (46,00µs/cm) y en la quebrada Zapatero en marzo (45,5µs/cm), tendencia, que como era de esperar, coincidió con los valores de la salinidad. Estas dos variables se comportaron en los análisis de manera colineal. La temperatura se mantuvo en el ámbito de 24,4 (río Coto en octubre) y 32,1ºC (río Abrojo en febrero), estableciéndose en general como una variable con pocas fluctuaciones espacio-temporales; el pH se mantuvo cercano a la neutralidad, con máximo (pH 8,5) y mínimo (pH 6,3) en el río Abrojo (Tabla 4).
En los dos ejes de ordenación del modelo de coordenadas principales, la varianza explicada de la relación entre especies y variables ambientales representó el 100%; mientras que el valor de la inercia total (en desviaciones estándar) de la gradiente ambiental (largo del primer eje canónico) fue de 1. La suma de todos los autovalores canónicos (valores que explican la relación estricta entre especies y las variables ambientales) representó el 63% de la longitud del gradiente ambiental (Tabla 5).
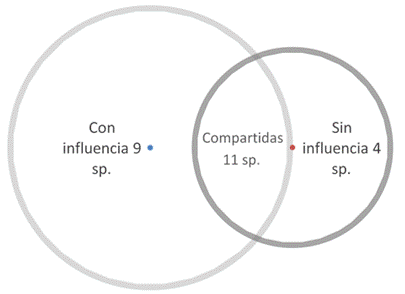
Fig. 5. Especies compartidas según influencia de construcción de diques y canales en los ríos evaluados, zona sur, Costa Rica.
Tabla 4
Variables físico-químicas del agua en los sitios evaluados, Zona Sur, Costa Rica, 2011
|
Variables |
OD (mg/l) |
Sat (%) |
Altitud (msnm) |
pH |
Temp (°C) |
|||||||||||
|
Sitio |
Mín. |
Máx. |
Mín. |
Máx. |
Mín. |
Máx. |
Mín. |
Máx. |
||||||||
|
Abrojo |
3,20 |
10,20 |
44,40 |
140,80 |
30,00 |
14,30 |
29,90 |
24,70 |
32,30 |
|||||||
|
Camaronal |
5,30 |
9,80 |
74,90 |
127,80 |
20,00 |
13,90 |
19,50 |
24,80 |
30,10 |
|||||||
|
Chiricanos |
4,20 |
8,00 |
55,20 |
104,20 |
10,00 |
6,30 |
19,70 |
25,20 |
29,60 |
|||||||
|
Corredores |
7,60 |
14,20 |
85,10 |
211,70 |
10,00 |
12,20 |
23,10 |
24,40 |
32,50 |
|||||||
|
Coto |
7,30 |
8,80 |
92,60 |
181,10 |
70,00 |
11,30 |
18,20 |
24,00 |
28,60 |
|||||||
|
Zapatero |
0,30 |
8,10 |
3,20 |
102,60 |
10,00 |
2,40 |
29,40 |
24,80 |
31,30 |
|||||||
|
Variables |
Sal (ppt) |
SDT (mg/l) |
Cond (ms/cm) |
Ssed (mg/l) |
|
|||||||||||
|
Sitio |
Mín. |
Máx. |
Mín. |
Máx. |
Mín. |
Máx. |
Mín. |
Máx. |
|
|||||||
|
Abrojo |
14,30 |
29,90 |
11472,00 |
19213,00 |
23,71 |
46,00 |
2,40 |
5,00 |
|
|||||||
|
Camaronal |
13,90 |
19,50 |
11269,00 |
15335,00 |
23,00 |
31,30 |
0,40 |
25,00 |
|
|||||||
|
Chiricanos |
6,30 |
19,70 |
5436,00 |
15439,00 |
11,09 |
31,50 |
6,00 |
3,00 |
|
|||||||
|
Corredores |
12,20 |
23,10 |
10020,00 |
17930,00 |
20,45 |
36,60 |
1,20 |
5,00 |
|
|||||||
|
Coto |
11,30 |
18,20 |
9354,00 |
14367,00 |
19,09 |
29,32 |
2,40 |
4,00 |
|
|||||||
|
Zapatero |
2,40 |
29,40 |
2166,00 |
18391,00 |
4,41 |
45,50 |
0,00 |
5,00 |
|
|||||||
Resumen de cálculos de varianza explicada por el modelo de análisis de coordenadas principales entre especies y variables ambientales
|
Ejes CCA |
1 |
2 |
3 |
4 |
Longitud gradiente |
|
Autovalores |
0,57 |
0,05 |
0,28 |
0,05 |
1,00 |
|
Correlaciones especies-ambiente |
0,88 |
0,70 |
0,00 |
0,00 |
|
|
Porcentaje acumulado de varianza |
|||||
|
De las species |
57,50 |
62,60 |
90,60 |
96,00 |
|
|
De la correlación especies-ambiente |
91,80 |
100,00 |
0,00 |
0,00 |
|
|
Suma de todos los autovalores |
|
|
|
|
1,00 |
|
Suma de todos los autovalores canónicos |
|
|
|
|
0,63 |
Según el análisis de coordenadas principales, tomando en consideración los sitios de muestreo, las variables ambientales como factor de ordenación con o sin influencia de infraestructura y la disimilitud de especies, los sitios con infraestructura mostraron una disimilitud con los sitios sin esta influencia, siendo la magnitud de ambas condiciones en disimilitud similares, aunque claramente inversas (Fig. 6).
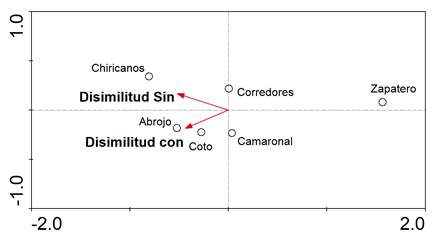
Fig. 6. Diagrama de ordenación para disimilitud Bray-Curtis de especies ícticas dulceacuícolas en los sitios de muestreo, 2011
DISCUSIÓN
A pesar del relativo bajo número de especies reconocidas durante esta investigación (n=24), la composición taxonómica de la ictiofauna del área de estudio no difiere notoriamente de otros reportes para la zona sur del país, entre otros, excluyendo las especies terciarias marinas Constantz et al. (1981) en el río Claro de Corcovado reportó 20sp. de las cuales una es endémica; Winemiller (1983) en Corcovado reportó 15sp. (2 endémicas); Winemiller y Morales (1989) nuevamente en Corcovado reportaron 20sp. con una diversidad Shannon de 1,7 (5sp. endémicas); Lyons y Schneider (1990) también en el río Claro (Corcovado) reportaron 16sp., con una diversidad Shannon de 2,2 y dos especies endémicas; por su parte Rojas et al. (2004) en el río Grande de Térraba reportaron 27sp, con una diversidad Shannon de 2,5 (cuatro especies endémicas); nuevamente Rojas y Rodríguez (2008) también en el río Grande de Térraba registraron 27sp., diversidad de 1,8 con tres especies endémicas; todos estos reportes se generaron en ríos con algún grado de protección como áreas protegidas, por lo que no tienen influencias de infraestructura humana como la evaluada en esta investigación.
Por su parte, Molina-Ureña (2008) en el río Uvita y otros de la Península de Osa registraron 36 especies (cinco endémicas), en este caso estos ríos si han tenido mayor alteración de sus causes por diques o canales, por atravesar comunidades, que requieren de esta infraestructura para mitigar inundaciones, y que similar a la presente investigación no sugirieron que esta influencia aumente o disminuya la ictiodiversidad.
Las condiciones físico-químicas del agua en los ríos influenciados por construcción de diques o canales (Corredores, Chiricanos y Zapatero) con respecto a los sitios de muestreo sin influencia de éstos (Abrojo, Coto y Camaronal), registraron valores similares, condición recurrente respecto a la abundancia, diversidad y distribución de los peces, sugiriéndose que la ictiofauna de la región, presenta algún grado de tolerancia a perturbaciones antropogénicas como lo es estas alteraciones en causes y conformación de diques o canales en los mismos.
Dado todo lo anterior, se sugiere que las variables físico-químicas sólidos disueltos totales, sólidos sedimentables, oxígeno disuelto, temperatura, pH, conductividad, salinidad, turbidez, son similares entre los sitios de muestreo, aun cuando presenten perturbaciones por la construcción de diques y canales que alteran la fisonomía natural de algunos sectores de ríos de la región evaluados, lo cual también coincide con respecto a la abundancia y diversidad íctica, las cuales no sugieren cambios aparentes respecto a estas condiciones.
AGRADECIMIENTOS
Agradezco a la Universidad Nacional y a la Universidad Estatal a Distancia, particularmente su Sistema de Estudios de Posgrado SEP por todo el apoyo durante la realización de esta investigación. A Maurizio Protti por sus recomendaciones y conocimiento, y a todas las personas que se interesaron en el tema.
ÉTICA, CONFLICTO DE INTERESES Y DECLARACIÓN DE FINANCIAMIENTO
Declaro haber cumplido con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en la preparación de este documento; que no hay conflictos de interés de ningún tipo, y que todas las fuentes financieras se detallan plena y claramente en la sección de agradecimientos. Asimismo, estoy/estamos de acuerdo con la versión editada final de esta publicación. El respectivo documento legal firmado se encuentra en los archivos de la revista.
La declaración de contribución de cada autor es la siguiente: J.C.V.A.: Diseño del estudio, recolección y análisis de datos.
REFERENCIAS
Ayala-Perez, L. A., Aviles-Alatriste, O. A., & Rojas-Galaviz, J. L. (1998). Estructura de la comunidad de peces en el sistema Candelaria-Panlau, Campeche, Mexico. Revista de Biología Tropical, 46(3), 763-774. https://bit.ly/3ZEZdGK
Bussing, W. A. (2002). Peces de las aguas continentales de Costa Rica = Freshwater fishes of Costa Rica. Editorial de la Universidad de Costa Rica.
Chao, A., Gotelli, N. J., Hsieh, T. C., Sander, E. L., Ma, K. H., Colwell, R. K., & Ellison, A. M. (2014). Rarefaction and extrapolation with Hill numbers: a framework for sampling and estimation in species diversity studies. Ecological Monographs, 84(1), 45-67.
Constantz, G., Bussing, W., & Saul, W. (1981). Freshwater fishes of Corcovado National Park, Costa Rica. Proceedings of the Academy of Natural Sciences of Philadelphia, 133, 15-19.
Cowx, I.G. (Ed.) (1990). Developments in electric fishing. Fishing News Books.
Díaz-Ruiz, S., Cano-Quiroga, E., Aguirre-León, A., & Ortega-Bernal, R. (2004). Diversidad, abundancia y conjuntos ictiofaunísticos del sistema lagunar-estuarino Chantuto-Panzacola, Chiapas, México. Revista de Biología Tropical, 52(1), 187-189.
Eschmeyer, W. N. & Fricke, R. (eds.). (2021). Catalog of Fishes electronic version. https://bit.ly/3M5Hvsq
Fowler, J., Cohen, L., & Jarvis, P. (1998). Practical statistics for field biology. (2da. ed.). John Wiley & Sons.
González, G., Aguilar C., Hernández, I., Cabrera, Y., Suarez-Montes, N., Bretos, F., & Guggenheim, D. (2009). Natural and human-induced variability in the composition of fish assemblages in the Northwestern Cuban shelf. Revista de Biología Tropical, 57(3), 721-740. https://doi.org/10.15517/rbt.v57i3.5487
Hsieh, T. C., Ma, K. H., & Chao, A. (2016). iNEXT: An R package for interpolation and extrapolation of species diversity (Hill numbers). Methods in Ecology and Evolution, 7(12), 1451-1456. https://doi.org/10.1111/2041-210X.12613
Hsieh, T.C., Ma, K.H. y Chao, A. (2022). A Quick Introduction to iNEXT via Examples. Latest version 3.0.0 (July, 2022). https://cran.r-project.org/web/packages/iNEXT/vignettes/Introduction.pdf
Legendre, P., & De Cáceres, M. (2013). Beta diversity as the variance of community data: dissimilarity coefficients and partitioning. Ecology Letters, 16(8), 951–963.
Lyons, J., & Schneider, D. W. (1990). Factors influencing fish distribution and community structure in a small coastal river in southwestern Costa Rica. Hydrobiologia, 203, 1-14. https://doi.org/10.1007/BF00005608
Molina-Ureña, H. (2008). Estado de población de peces del Sitio Osa. Programa de Monitoreo del Sitio Osa. TNC-INBio. https://bit.ly/40Vujuy
Persat, H. & Copp, G. (1990). Electric fishing and point abundance sampling for the ichthyology of large rivers. En I. J. Cowx (Ed.), Developments in Electric Fishing (pp. 197-209). Fishing News Books.
Pérez-Castillo, A. & Rodríguez, A. (2008). Índice fisicoquímico de la calidad de agua para el manejo de lagunas tropicales de inundación. Revista de Biología Tropical, 56(4), 1905-1918.
Programa Ambiental Regional para Centro América, Comisión Centroamericana de Ambiente y Desarrollo (PROARCA-CCAD) El Salvador (País). (2004). Guía Práctica de Monitoreo de Procesos de Tratamiento de Aguas Residuales. Ciudad de Guatemala, Guatemala.
Protti, M., Sáenz, I., Guevara, M., & Herrera, M. (2007). Costa Rica y Universidad Nacional (Costa Rica). (2007). Evaluación de la ictio y entomofauna acuática en el área de impacto y zonas aledañas al Proyecto Hidroeléctrico Cariblanco. (Informe Científico Técnico Anual: Periodo diciembre 2005-octubre 2006). Laboratorio de Recursos Naturales y Vida Silvestre-UNA. Heredia, Costa Rica. 100 p.
Rojas, R., Rodríguez, O., & Instituto Costarricense de Electricidad. (2004). Importancia ecológica y socioeconómica de las comunidades ictiológicas del río Grande de Térraba, como elemento esencial en la viabilidad ambiental del Proyecto Hidroeléctrico Boruca. (Informe técnico sin publicar). San José, Costa Rica.
Rojas, R., & Rodríguez, O. (2008). Diversidad y abundancia ictiofaunística del río Grande de Térraba, sur de Costa Rica. Revista de Biología Tropical, 56(3), 1429-1447.
Solano, J. & Villalobos, R. (2000). Regiones y subregiones climáticas de Costa Rica. Instituto Meteorológico de Costa Rica. https://bit.ly/2UIByZj
Torres-Castro, I., Vega-Cendeja, M. E., Schmitter-Soío, J. J., Palacio-Aponte, G., & Rodiles-Hernández, R. (2009). Ictiofauna de sistemas cárstico-palustres con impacto antrópico: los petencs de Campeche, México. Revista de Biología Tropical, 57(1-2), 141-157.
Villa, J. (1982). Peces nicaragüenses de agua dulce. Fondo de Promoción Cultural Banco de América. https://bit.ly/3MyC3ir
Wilber, D. & Clarke, D. (2001). Biological effects of suspended sediments: A review of suspended sediment impacts on fish and shellfish with relation to dredging activities in estuaries. North American Journal of Fisheries Management, 21(4), 855-875. https://doi.org/10.1577/1548-8675(2001)021<0855:BEOSSA>2.0.CO;2
Winemiller, K. (1983). An introduction to the freshwater fish communities of Corcovado National Park, Costa Rica. Brenesia. 21, 47-66.
Winemiller, K. O., & Morales, N. E. (1989). Comunidades de peces del Parque Nacional Corcovado luego del cese de las actividades mineras. Brenesia, 31, 75-91.