
UNED Research Journal (e-ISSN 1659-441X), Vol.15(1): e4412, June, 2023
Composición florística de la regeneración natural de un bosque muy húmedo premontano en Poás, Costa Rica
Isler F. Chinchilla1![]() , & Nathalie Goebel-Otárola2
, & Nathalie Goebel-Otárola2![]()
1. Universidad de Costa Rica, Herbario Luis A. Fournier Origgi (USJ), 2060, San Pedro, San José, Costa Rica; isler.chinchilla@ucr.ac.cr
2. Universidad de Costa Rica, Posgrado en Gestión Integrada de Áreas Costeras Tropicales, 2060, San Pedro, San José, Costa Rica; nathalie.goebel@ucr.ac.cr
Recibido 28-X-2022 □ Corregido 17-XI-2022 □ Aceptado 28-XI-2022
DOI: https://doi.org/10.22458/urj.v15i1.4412
|
ABSTRACT. “Floristic composition of the natural regeneration of very wet premontane forest in Poás, Costa Rica”. Introduction: Natural restoration is a low cost and nature-based way to restore part of habitats degraded by deforestation. Objective: To document the floristic composition of a regenerating vegetation fragment of very wet premontane forest. Methods: We did a floristic inventory in 5,59ha through exhaustive walks. Results: We documented 74 families, 144 genera and 170 native species, and 15 families, 21 genera and 22 exotic species, and one hybrid. The families with the highest genera and species riches were Asteraceae, Fabaceae, Solanaceae, Rubiaceae, Euphorbiaceae, Polypodiaceae, Lauraceae, and Pteridaceae. The genera with the highest species richness were Solanum, Pleopeltis, Pteris, Croton, and Piper. We identified two endemic species, Costus montanus and Sechium tacaco. 95% of the species are terrestrial, 4% facultative epiphytes, and 1% holoepiphytes; 30% trees, 29% shrubs, 27% herbs, 9% lianas, and 5% dwarf shrub. About 64% are strictly heliophytes, and 36% of the species may tolerate shade. 148 species have at least one vernacular name. Conclusion: It is relevant to conserve this forest fragment, which is in an early state of regeneration, because its species composition typical of the premontane forests of the Costa Rican Central Valley.
Keywords: Endemic species; native species; flora of the Central Valley; relicts of vegetation; early successional vegeta.
|
RESUMEN. Introducción: La regeneración natural es una solución de bajo costo y basada en la naturaleza para restaurar parte de los hábitats degradados por la deforestación. Objetivo: Documentar la composición florística de un fragmento de vegetación en regeneración de bosque muy húmedo premontano. Métodos: Hicimos un inventario florístico en 5,59ha mediante recorridos exhaustivos. Resultados: Identificamos 74 familias, 144 géneros y 170 especies nativas, y 15 familias, 21 géneros y 22 especies introducidas, y un híbrido. Las familias con mayor riqueza de géneros y especies fueron Asteraceae, Fabaceae, Solanaceae, Rubiaceae, Euphorbiaceae, Polypodiaceae, Lauraceae y Pteridaceae. Los géneros con mayor riqueza de especies fueron Solanum, Pleopeltis, Pteris, Croton y Piper. Hallamos dos especies endémicas, Costus montanus y Sechium tacaco. El 95% de las especies son terrestres, 4% epífitas facultativas y 1% holoepífitas; 30% árboles, 29% arbustos, 27% hierbas, 9% lianas y 5% sufrútices. Cerca del 64% son estrictamente heliófitas, y un 36% de las especies pueden tolerar la sombra. 148 especies tiene al menos nombre común. Conclusión: Este bosque se encuentra en un estado temprano de regeneración, con una composición de especies típica de los bosques premontanos del Valle Central costarricense, por lo que es relevante conservarlo.
Palabras clave: Especies endémicas; especies nativas; flora del Valle Central; relictos de vegetación; vegetación de sucesión temprana.
|
La regeneración natural es una solución de bajo costo y basada en la naturaleza para restaurar parte de los hábitats degradados por la deforestación para conservar la biodiversidad, propiciar el secuestro de carbono y proveer múltiples servicios ecosistémicos (Chazdon et al., 2016b). La deforestación neta anual de bosques húmedos en América Central y del Sur entre 2000 y 2010 fue de 1,92 millones de hectáreas, superior a la década anterior, que se talaron 1,86 millones de hectáreas de bosque por año (Achard et al. 2014; Armenteras et al., 2017). En el siglo XX cerca del 70% de los bosques costarricenses fueron deforestados, entre ellos críticamente diezmados los bosques húmedo tropical y húmedo premontano (Sánchez-Azofeifa, et al., 2001; Barquero & Hernández, 2015). Afortunadamente en las últimas tres décadas la cobertura de bosque en el país aumentó progresivamente gracias a la regeneración natural. Sin embargo, la deforestación sigue siendo uno de los desafíos más críticos para la biodiversidad del país, y el bienestar social (Barquero & Hernández, 2015; Jiménez, 2015). La deforestación provoca pérdida y fragmentación de hábitat, detrimento de la biodiversidad, erosión del suelo, contaminación del agua y degradación de valores escénicos, lo cual, a su vez tiene repercusiones en la productividad económica y calidad de vida de las personas en la región centroamericana, y en el mundo (Castro et al., 2003; Jiménez, 2015).
Durante el proceso de recuperación gradual de complejidad estructural del bosque después de talado, la composición de especies permanece distinta a la del bosque original durante varias décadas o siglos (Chazdon et al., 2016a). En estos ambientes, las plantas pioneras (o inductoras de vegetación) cumplen un rol fundamental para restaurar suelos degradados porque acumulan suelo orgánico producido por la descomposición de tallos, ramas, hojas, flores y frutos, lo que progresivamente favorece hábitats adecuados para el establecimiento de otras especies de plantas tolerantes a la sombra que crecían en el bosque original (Zhu et al., 2016).
Los bosques secundarios jóvenes, los claros de bosque y de vegetación ribereña, los pastizales, los cafetales y las plantaciones forestales abandonadas, y los relictos de vegetación en zonas urbanas y rurales entre otros, albergan un considerable número de especies asociadas o restringidas a estos hábitats (Cascante-Marín & Estrada-Chavarría, 2012; Sandoval et al., 2019; Cedeño-Fonseca et al., 2020). Por tanto, es fundamental conocer las especies de plantas que recolonizan estos hábitats en las diferentes etapas de regeneración hasta convertirse en bosques en estado avanzado de regeneración (Morales, 2009; Cedeño-Fonseca et al., 2020).
Cascante-Marín & Estrada-Chavarría (2012) realizaron un inventario detallado de especies de plantas que habitan en ambientes en distintos estados de regeneración natural en bosques premontanos en la zona de El Rodeo, en el Valle Central de Costa Rica, así como también documentaron la flora presente en bosques maduros. Otros estudios han contribuido al conocimiento de la flora en bosques secundarios o bosques maduros en el territorio costarricense (Di Stéfano & Morales, 1993; Morales, 2009; Maglianesi, 2010; Jiménez et al., 2016; Cedeño-Fonseca et al., 2020). Sin embargo, en Costa Rica se requieren realizar más estudios sobre la composición de plantas presentes en fragmentos de vegetación en regeneración, especialmente aquellos en estado temprano de regeneración, para disponer de conocimiento florístico necesario para establecer propuestas de manejo, restauración y conservación de estos ambientes degradados (Morales, 2009; Sandoval et al., 2019; Cedeño-Fonseca et al., 2020).
Con el propósito de contribuir al conocimiento de la flora de Costa Rica presente en ambientes en regeneración natural, en este estudio se documentamos la composición florística en un fragmento de vegetación en regeneración natural de bosque muy húmedo premontano en San Juan Norte de Poás, Alajuela. Nos enfocamos en tres objetivos específicos: 1) inventariar las familias, géneros y especies de plantas que crecen en el fragmento de vegetación, 2) determinar la condición de sus especies según su distribución natural como nativa, endémica, endémica binacional, introducida naturalizada o introducida no naturalizada, y 3) documentar sus formas de vida según su hábitat y su fisonomía. También determinamos los nombres comunes usados en el país para algunas de las especies, debido a la importancia de esta investigación para la comunidad local.
MATERIALES Y MÉTODOS
Área de estudio: Realizamos el estudio en un fragmento de vegetación en regeneración localizado en la vertiente Pacífico, en San Juan Norte de Poás, Alajuela, Costa Rica, entre las coordenadas geográficas N 10°06'51,34" W 84°13'51,05" - N 10°06'52,97" W 84°13'49,17" y N 10°07'04,22" W 84°14'00,72" - N 10°07'01,07" W 84°14'03,37", y entre 1438–1490m de elevación. En su extremo sureste limita con el río Mastate.
Está ubicado en la zona de vida bosque muy húmedo premontano (Holdridge, 1967). Comprende 5,59 hectáreas, de las cuales el 60,1% muestra un relieve ondulado, allí cuando se taló el bosque se cultivó una plantación de café (Coffea arabica), la cual luego se reemplazó por pastos forrajeros (Brachiaria decumbens y Pennisetum purpureum), y hace aproximadamente 21 años estos pastos se reemplazaron por una plantación de ciprés (Cupressus lusitanica), que fue posteriormente abandonada; el 31,5% tiene un relieve plano a ligeramente ondulado, con árboles remanentes, algunos arbustos, sufrútices, hierbas y gramíneas; y el 8,4% presenta un relieve fuertemente ondulado a escarpado, con bosque secundario joven alrededor de una naciente, y en la ribera del río Mastate (Fig. 1).
Recopilación de datos: En mayo de 2014 hicimos recorridos exhaustivos por toda el área de estudio para identificar las especies de plantas, y recolectar especímenes de herbario para su posterior análisis. Conservamos los especímenes recolectados en el Herbario Nacional de Costa Rica (acrónimo CR), y algunos duplicados en el Herbario Luis A. Fournier Origgi (acrónimo USJ) de la Universidad de Costa Rica, y el Herbario del Jardín Botánico de Missouri (acrónimo MO). Para identificar las especies consultamos literatura publicada en el Manual de Plantas de Costa Rica (MPCR) (Hammel et al., 2003a, 2003b, 2007, 2010, 2014, 2015, 2020a, 2020b), y examinamos los especímenes recolectados. También identificamos algunas especies in situ mediante la observación directa de las plantas.
Obtuvimos los nombres comunes de las especies de plantas usados en Costa Rica a partir de la consulta del MPCR, la base de datos ECOBIOSIS (http://ecobiosis.museocostarica.go.cr), y la entrevista a Desiderio Murillo Murillo (comunicación personal, 19 de mayo de 2014), quien es oriundo de San Juan Norte de Poás.
Análisis de datos: Ordenamos las especies alfabéticamente por familia, género y especie en las divisiones Pteridophyta (helechos y afines) y Spermatophyta (plantas con semilla). La taxonomía de las plantas se basó en la clasificación aceptada por el Jardín Botánico de Missouri en su base de datos Tropicos (21 de agosto de 2022: http://www.tropicos.org), la cual sigue la clasificación de Angiosperm Phylogeny Group et al. (2016), y la clasificación de Christenhusz et al. (2011) para licófitas y helechos. Clasificamos las especies de acuerdo con sus formas de vida, según hábitat en terrestre (T), epífita facultativa (EpF) y holoepífita (HEp), y según su fisonomía en hierba (H), sufrútice (S), arbusto (Ar), árbol (A) y liana (L), de acuerdo con la clasificación de Nivia & Cascante (2008), pero incluyendo la categoría sufrútice, que incluye plantas con tallo basal lignificado con apariencia herbácea, y la consulta del MPCR. Determinamos el número de familias, géneros y especies, sus abundancias, y la condición de las especies según su distribución natural como endémica (EN), endémica binacional (ENB), introducida naturalizada (IN), o introducida no naturalizada (INN). Las plantas introducidas naturalizadas (IN), a diferencia de las introducidas no naturalizadas (INN), han logrado reproducirse y propagarse por sus propios medios.

Fig. 1. Área de estudio. A–B. Bosque secundario joven; C–D. Regeneración de diversas especies bajo el dosel de árboles de Cupressus lusitanica. Fotografías por Isler. F. Chinchilla, 2014.
RESULTADOS
En el área de estudio hallamos 74 familias, 144 géneros y 170 especies de plantas vasculares nativas de Costa Rica, y 15 familias, 21 géneros y 22 especies de plantas vasculares introducidas (nueve IN y 13 INN), y un híbrido, Musa × paradisiaca. Las angiospermas nativas comprenden el 89,4% de las especies, el 91,7% de los géneros y el 89,2% de las familias; y las pteridófitas nativas el 10,6% de las especies, el 8,3% de los géneros y el 10,8% de las familias. No encontramos licófitas (Apéndice 1).
Las plantas terrestres son el grupo más diverso, representan el 95,3% de las especies nativas, seguido de 4,1% epífitas facultativas, y 0,6% holoepífitas. El 30% de las especies nativas son árboles, 28,8% arbustos, 27,1% hierbas, 8,8% lianas, y 5,3% sufrútices. Aproximadamente el 64,1% de las especies nativas son estrictamente heliófitas, y el 35,9% de las especies también pueden tolerar la sombra.
Las familias de plantas nativas con mayor riqueza de géneros y especies fueron Asteraceae (15 gén./18 spp.), Fabaceae (11 gén./13 spp.), Rubiaceae (7 gén./7 spp.), y Solanaceae (4 gén./8 spp.), las cuales representan el 27,1% de total de las especies en el área de estudio (Fig. 2). Los géneros nativos con mayor riqueza de especies fueron Solanum (5 spp.), Pleopeltis, Pteris (4 spp. cada uno), Croton, y Piper (3 pp. cada uno) (ver Apéndice 1).
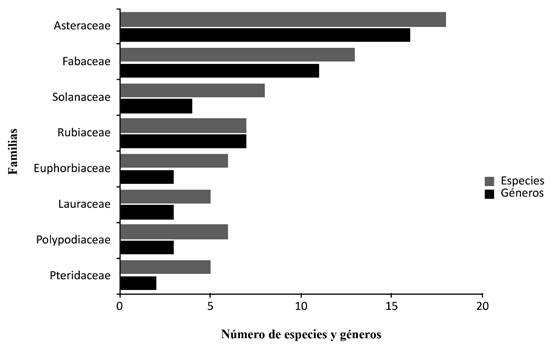
Fig. 2. Familias de plantas vasculares nativas con mayor riqueza de géneros y especies (+4 spp.) en el área de estudio.
Se determinaron dos especies endémicas de Costa Rica, Costus montanus (Costaceae) y Sechium tacaco (Cucurbitaceae). Además, 10 especies endémicas binacionales, cuatro entre Nicaragua y Costa Rica: Marsdenia engleriana (Apocynaceae), Capparidastrum discolor (Capparaceae), Indigofera costaricensis (Fabaceae), y Sarcoglottis smithii (Orchidaceae); y seis entre Costa Rica y Panamá: Pleopeltis complanata (Polypodiaceae), Gonolobus edulis (Apocynaceae), Chamaedorea macrospadix (Arecaceae), Mucuna monticola (Fabaceae), Monnina sylvicola (Polygalaceae), y Panopsis costaricensis (Proteaceae). Determinamos una amplia diversidad de especies típicas de bosque muy húmedo premontano como Mauria heterophylla, Tapirira mexicana (Anacardiaceae), Guatteria dolichopoda (Annonaceae), M. engleriana (Apocynaceae), Tonduzia stenophylla (Apocynaceae), Oreopanax xalapensis (Araliaceae), Montanoa hibiscifolia, Verbesina turbacensis (Asteraceae), Quetzalia occidentalis (Celastraceae), C. montanus (Costaceae), Perrottetia longistylis (Dipentodontaceae), Croton decalobus, Croton draco, Croton niveus, Sapium glandulosum (Euphorbiaceae), Calliandra houstoniana, Erythrina berteroana, Inga punctata, Inga oerstediana, M. monticola (Fabaceae), Molinadendron guatemalense (Hamamelidaceae), Heliconia tortuosa (Heliconiaceae), Tournefortia glabra (Heliotropiaceae), Damburneya salicina, Persea caerulea (Lauraceae), Heterocentron glandulosum (Melastomataceae), Trichilia havanensis (Meliaceae), Eugenia austin-smithii (Myrtaceae), Ficus aurea, Sorocea trophoides (Moraceae), Bocconia frutescens (Papaveraceae), Passiflora apetala (Passifloraceae), Lasiacis nigra (Poaceae), Loeselia glandulosa (Polemoniaceae), Campyloneurum xalapense (Polypodiaceae), Pteris altissima (Pteridaceae), Prunus occidentalis (Rosaceae), Palicourea padifolia, Rogiera amoena, (Rubiaceae), Xylosma flexuosa (Salicaceae), Cupania glabra (Sapindaceae), Solanum umbellatum (Solanaceae), Symplocos limoncillo (Symplocaceae), Ulmus mexicana (Ulmaceae), Cecropia angustifolia (Urticaceae), Citharexylum donnell-smithii (Verbenaceae) entre otras. Además, informamos Chionanthus panamensis (Oleaceae). En los alrededores de la naciente, y a la orilla del río Mastate predominan árboles maduros de Quercus corrugata (Fagaceae). (Figs. 3–8; Apéndice 1).
Identificamos 148 especies que tienen uno o más nombres comunes usados en el país (ver Apéndice 1).

Fig. 3. Especies documentadas en el área de estudio. A. Anemia phyllitidis; B. Dennstaedtia dissecta. C. Diplazium lonchophyllum; D. Dryopteris sp.; E. Mildella intramarginalis; F. Pleopeltis polypodioides; G. Thelypteris dentata; H. Annona cherimola; I. Baccharis pedunculata; J. Calathea crotalifera; K. Calea urticifolia; L. Calliandra houstoniana; M. Chaetogastra ciliaris; N. Cissus verticillata; O–P. Clethra lanata. Fotografías: I. F. Chinchilla..

Fig. 4. Especies documentadas en el área de estudio. A. Chionanthus panamensis; B. Coccocypselum hispidulum; C. Conostegia xalapensis; D. Conyza canadensis; E. Conyza sumatrensis; F–G. Costus montanus; H. Croton decalobus; I. Croton niveus; J. Cuphea appendiculata; K. Cupressus lusitanica; L–M. Damburneya salicina; N. Eriobotrya japonica; O. Ficus pertusa; P. Frangula capreifolia. Fotografías: I. F. Chinchilla..

Fig. 5. Especies documentadas en el área de estudio. A. Gnaphalium attenuatum; B–C. Gonolobus edulis; D. Govenia quadriplicata; E. Hamelia patens; F. Heliconia tortuosa; G. Heterocentron glandulosum; H. Impatiens walleriana; I. Indigofera costaricensis; J. Inga oerstediana; K. Lantana camara; L. Lepidium virginicum; M–N. Loeselia glandulosa; O. Mandevilla veraguasensis; P. Marsdenia engleriana. Fotografías: I. F. Chinchilla..

Fig. 6. Especies documentadas en el área de estudio. A. Mauria heterophylla; B. Melinis repens; C–D. Miconia aeruginosa; E. Mimosa albida; F–G. Molinadendron guatemalense; H. Monnina sylvicola; I. Myrcia neopallens; J. Myrsine coriacea; K. Palicourea padifolia; L. Panopsis costaricensis; M. Passiflora apetala; N. Persea caerulea; O. Phenax rugosus; P. Phoradendron piperoides. Fotografías: I. F. Chinchilla..

Fig. 7. Especies documentadas en el área de estudio. A–B. Phyllanthus niruri; C–E. Pouteria sapota; F. Prunus occidentalis; G–H. Quercus corrugata; I. Quetzalia occidentalis; J. Randia aculeata; K. Rubus eriocarpus; L–M. Rubus niveus; N–O. Rubus rosifolius; P. Rubus urticifolius. Fotografías: I. F. Chinchilla..

Fig. 8. Especies documentadas en el área de estudio. A. Sarcoglottis smithii; B. Solanum torvum; C–D. Solanum wendlandii; E–F. Symplocos limoncillo; G–H. Tonduzia stenophylla; I. Tradescantia zanonia; J. Tripogandra serrulata; K–L. Ulmus mexicana; M. Verbena litoralis; N. Verbesina turbacensis; O. Witheringia asterotricha; P. Xylosma flexuosa. Fotografías: I. F. Chinchilla.
DISCUSIÓN
Hallamos una considerable riqueza de familias, géneros y especies de plantas vasculares nativas, a pesar de tener más de un 60% del área influenciada por la cobertura de árboles de Cupressus lusitanica que han limitado el reclutamiento de especies nativas. En el presente, la diversidad de plantas en dicha área probablemente es mayor porque hace 8 años que realizamos el inventario, y en ese tiempo pueden haberse establecido otras especies diferentes. Las especies nativas son principalmente heliófitas, pero algunas de estas pueden crecer a la sombra en el sotobosque de bosque secundario joven, y debajo de los árboles de ciprés. Lo cual es característico en un proceso de sucesión donde las especies heliófitas, demandantes de luz, son reemplazadas gradualmente por especies mesofíticas, tolerantes a la sombra, debido a características fisiológicas como menor tasa fotosintética máxima (Pmax) en las mesofíticas (Zhu et al., 2016). Por tanto, el fragmento de vegetación en estudio presenta un estado temprano de regeneración natural, ya que tiene una composición florística dominada por especies heliófitas.
Probablemente el relicto de vegetación riparia y el estrecho corredor biológico a través del río Mastate han favorecido la dispersión por zoocoria (aves o mamíferos) o hidrocoria de propágulos como semillas o frutos hacia el fragmento de vegetación en regeneración, ya que los sistemas riparios promueven la conectividad de especies de plantas al favorecer distintos modos de dispersión (Aronson et al., 2017)
Las asteráceas representaron el mayor número de géneros y especies nativas, seguido de las fabáceas. Ambas familias son taxonómicamente diversas, y son un componente primario en la vegetación en estado temprano de regeneración (Zamora, 2010; Rodríguez, 2020). El género Solanum mostró el mayor número de especies, seguido de Pleopeltis y Pteris, esto probablemente debido a la diversidad per se de los géneros, y porque sus especies tienen la capacidad de colonizar ambientes alterados. Es bien sabido que muchos grupos de helechos tienen una excelente capacidad para crecer en suelos desprovistos de vegetación como especies pioneras (Vargas, 1985; Sharpe & Shiels, 2014). También las plantas de Solanum pueden crecer en ambientes perturbados como potreros, bordes y claros de bosque o a la orilla de los ríos. En la flora vascular de la Zona de El Rodeo, Solanum representó el segundo género con mayor número de especies (Cascante-Marín & Estrada-Chavarría, 2012).
Determinamos que el 54,4% de las especies de plantas nativas que crecen en el área de estudio también han sido informadas para los bosques premontanos en la Zona de El Rodeo (Cascante-Marín & Estrada-Chavarría, 2012). Esto sugiere que ambos sitios tienen una relativa afinidad florística, probablemente porque una porción de El Rodeo se ubica en la misma zona de vida que el área de estudio, el bosque muy húmedo premontano, y que El Rodeo también tiene áreas con vegetación en estado temprano de regeneración (Sánchez, 2012; Cascante-Marín & Estrada-Chavarría, 2012). También identificamos algunas especies introducidas que son muestra fidedigna de la reciente intervención antropogénica que modificó la cobertura del uso del suelo. Afortunadamente estas especies introducidas por el momento no se comportan como invasoras. Sin embargo, recomendamos eliminar los árboles de manzana rosa (Syzygium jambos) porque han sido informados como una especie invasora en Costa Rica (Di Stéfano et al., 1998; Ávalos et al., 2006).
Las especies terrestres nativas constituyeron la forma de vida dominante, lo que concuerda con lo documentado para la flora del país (Nivia & Cascante, 2008), y menos frecuente epífitas facultativas, y holoepífitas. La presencia de una única especie holoepífita puede deberse a que no existen suficientes forófitos con características adecuadas para hospedar epífitas, como la presencia de una corteza rugosa con capacidad para retener agua y sustrato, que son materia prima esencial para la colonización de epífitas (Cedeño-Fonseca & Chinchilla, 2021). La proporción similar entre el número de especies de árboles, arbustos y hierbas nativas, probablemente se explica por la presencia de árboles y arbustos remanentes del bosque original y por el estado temprano de regeneración del fragmento de vegetación, ya que las hierbas son la forma de vida fisonómica dominante en la flora costarricense (Nivia & Cascante, 2008).
Hallamos dos especies endémicas de Costa Rica, y 10 especies endémicas binacionales, entre ellas, Mucuna monticola, una especie que fue descrita recientemente como nueva especie para la ciencia (Moura et al., 2012). Además, identificamos árboles de Molinadendron guatemalense, Prunus occidentalis, Quercus corrugata, Quetzalia occidentalis, Symplocos limoncillo y Tonduzia stenophylla, los cuales fueron especies típicas de la flora del Valle Central de Costa Rica, y actualmente están restringidas principalmente a relictos de bosque. Además, Chionanthus panamensis una especie representativa de la flora costarricense. Estos hallazgos realzan la importancia que tiene este fragmento de vegetación, y áreas similares para la conservación de la biodiversidad del país, y que por ser percibida como una pequeña porción de tierra, pero no pequeña en diversidad biológica, con frecuencia pasan desapercibidas de la atención científica y social (Sandoval et al., 2019; Cedeño-Fonseca et al., 2020).
Presentamos los nombres comunes asociados a algunas de las especies documentadas en el área de estudio porque estos tienen importancia histórica y cultural en la sociedad costarricense, y facilitan la divulgación científica (ver Cook, 1908; Fournier & García, 1998; León & Poveda, 2000; Quesada-Monge & Fernández-Vega, 2005). Por otra parte, las personas no familiarizadas a la botánica o la taxonomía usualmente tienen dificultad para interiorizar el nombre científico de una planta, pero en cambio conocen su nombre común o pueden aprenderlo con cierta facilidad, por lo que de éste se puede explicar parte de la biología de una especie, aprender a reconocerla, e identificarla con su correcto nombre científico (Cook, 1908). Sin embargo, los nombres comunes suelen ser utilizados indistintamente para especies diferentes, por tanto es estrictamente necesario contar con la orientación de una persona profesional en florística o taxonomía de plantas para identificar correctamente las especies, y asociarlas con sus respectivos nombres comunes.
Recomendamos ampliar los estudios florísticos, taxonómicos y ecológicos enfocados a fragmentos de vegetación en regeneración natural, especialmente los que presentan estados tempranos de regeneración, porque son sitios que requieren investigación ya que albergan una considerable diversidad de organismos como plantas, hongos, insectos, aves entre otros, y están expuestos a pérdida de biodiversidad (Morales, 2009; Sandoval et al., 2019; Cedeño-Fonseca et al., 2020). El conocimiento que estos estudios pueden generar será de utilidad para promover acciones de conservación como restauración de ambientes degradados, programas de reforestación, establecimiento o fortalecimiento de los correderos biológicos, promoción del turismo, educación ambiental y participación ciudadana.
AGRADECIMIENTOS
Agradecemos a la Asociación de Desarrollo Integral de San Juan Norte de Poás, Cabuyal, Alajuela, por financiar parte de la presente investigación realizada en un área de interés para la ASADA de San Juan Norte de Poás. A Desiderio Murillo Murillo, Mario Porras Alfaro, Milton Castro Murillo y Guillermo Castro Alfaro, por la hospitalidad y el apoyo durante el trabajo de campo. A Rolando Marín León por el apoyo logístico. A Alexander Francisco Rojas Alvarado por la orientación con la identificación de algunas especies de helechos. Al personal del Herbario Nacional de Costa Rica (en especial a Armando Estrada Chavarría, y Silvia Lobo), y del Herbario Luis A. Fournier Origgi, por permitir el acceso a sus colecciones botánicas, equipos y bibliotecas. Al equipo editorial de la revista Cuadernos de Investigación UNED, y a los revisores anónimos, por los comentarios y correcciones para mejorar el manuscrito de esta investigación.
ÉTICA, CONFLICTO DE INTERESES Y DECLARACIÓN DE FINANCIAMIENTO
Declaramos haber cumplido con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en la preparación de este documento; que no hay conflictos de interés de ningún tipo, y que todas las fuentes financieras se detallan plena y claramente en la sección de agradecimientos. Asimismo, estamos de acuerdo con la versión editada final de la publicación. El respectivo documento legal firmado se encuentra en los archivos de la revista.
La declaración de contribución de cada autor es la siguiente: I.F.C.: Diseño del estudio y recolección de datos. I.F.C. y N.G.O.: Análisis de datos, preparación y aprobación final del manuscrito.
REFERENCIAS
Achard, F., Beuchle, R., Mayaux, P., Stibig, H. J., Bodart, C., Brink, A., Carboni, S., Desclée, B., Donnay, F., Eva, H. D., Lupi, A., Raši, R., Seliger, R., & Simonetti, D. (2014). Determination of tropical deforestation rates and related carbon losses from 1990 to 2010. Global Change Biology, 20, 2540-2554. https://doi.org/10.1111/gcb.12605
Angiosperm Phylogeny Group, Chase, M. W., Christenhusz, M. J. M., Fay, M. F., Byng, J. W., Judd, W. S., Soltis, D. E., Mabberley, D. J., Sennikov, A. N., Soltis, P. S., & Stevens, P. F. (2016). An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG IV. Botanical Journal of the Linnean Society, 181, 1-20. https://doi.org/10.1111/boj.12385
Armenteras, D., Espelta, J. M., Rodríguez, N., & Retana, J. (2017). Deforestation dynamics and drivers in different forest types in Latin America: Three decades of studies (1980–2010). Global Environmental Change, 46, 139-147. https://doi.org/10.1016/j.gloenvcha.2017.09.002
Aronson, M. F., Patel, M. V., O’Neill, K. M., & Ehrenfeld, J. G. (2017). Urban riparian systems function as corridors for both native and invasive plant species. Biological Invasions, 19(12), 3645-3657. https://doi.org/10.1007/s10530-017-1583-1
Ávalos, G., Hoell, K., Gardner, J., Anderson, S., & Lee, C. (2006). Impact of the invasive plant Syzigium jambos (Myrtaceae) on patterns of understory seedling abundance in a Tropical Premontane Forest, Costa Rica. Revista de Biología Tropical, 54(2), 415-421. https://doi.org/10.15517/rbt.v54i2.13883
Barquero, A. I., & Hernández, G. (2015). Bosques y Pago de Servicios Ambientales en Costa Rica. Ambientico, 253(2), 12-16.
Cascante-Marín, A., & Estrada-Chavarría, A. (2012). Las plantas vasculares de El Rodeo, Costa Rica. Brenesia, 77, 71-128. https://bit.ly/3k0r6Xw
Castro, K. L., Sanchez-Azofeifa, G. A., & Rivard, B. (2003). Monitoring secondary tropical forests using space-borne data: implications for Central America. International Journal of Remote Sensing, 24(9), 1853-1894. https://doi.org/10.1080/01431160210154056
Cedeño-Fonseca, M., & Chinchilla, I. F. (2021). Rasgos de los forófitos de Guazuma ulmifolia y Samanea saman y su influencia en la distribución espacial, abundancia y diversidad de plantas epífitas. Scientia, 31(2), 68-84. https://bit.ly/3A3TlM9
Cedeño-Fonseca, M., Flores-Leitón, J. M., Quesada-Román, A., & Flores, R. (2020). Inventario florístico en un bosque amenazado por la expansión agrícola en la reserva del Centro Turístico Los Chocuacos, Costa Rica. Revista de Ciencias Ambientales, 54(1), 33-57. https://doi.org/10.15359/rca.54-1.3.
Chazdon, R. L., Brancalion, P. H. S., Laestadius, L., Bennett-Curry, A., Buckingham, K., Kumar, C., Moll-Rocek, J., Guimarães Vieira, I. C., & Wilson, S. J. (2016a). When is a forest a forest? Forest concepts and definitions in the era of forest and landscape restoration. Ambio, 45(5), 538-550. https://doi.org/10.1007/s13280-016-0772-y
Chazdon, R. L., Broadbent, E. N., Rozendaal, D. M., Bongers, F., Zambrano, A. M. A., Aide, T. M., Balvanera, P., Becknell, J. M., Boukili, V., Brancalion, P. H. S., Craven, D., Almeida-Cortez, J. S., Cabral, G. A. L., de Jong, B., Denslow, J. S., Dent, D. H., DeWalt, S. J., Dupuy, J. M., Durán, S. M...& Poorter, L. (2016b). Carbon sequestration potential of second-growth forest regeneration in the Latin American tropics. Science Advances, 2(5), e1501639. http://dx.doi.org/10.1126/sciadv.1501639
Christenhusz, M. J. M., Zhang, X-C., & Schneider, H. (2011). A linear sequence of extant families and genera of lycophytes and ferns. Phytotaxa, 19, 7-54. https://doi.org/10.11646/phytotaxa.19.1.2
Cook, O. F. (1908). Prólogo. En H. Pittier (Ed.), Plantas usuales de Costa Rica (v-vii). H.L. & J.B. McQueen. https://doi.org/10.5962/bhl.title.34633
Di Stéfano, J. F., & Morales, C. O. (1993). Inventario florístico en varias áreas boscosas en Tabarcia de Mora y Palmichal de Acosta, Costa Rica. Revista de Biología Tropical, 41(3), 423-431. https://hdl.handle.net/10669/82944
Di Stéfano, J. F., Fournier, L. A., Carranza, J., Marín, W., & Mora, A. (1998). Potencial invasor de Syzigium jambos (Myrtaceae) en fragmentos boscosos: El caso de Ciudad Colón, Costa Rica. Revista de Biología Tropical, 46(3), 567-573. https://doi.org/10.15517/rbt.v46i3.20109
Fournier, L., & García, E. (1998). Nombres vernaculares y científicos de Costa Rica. Editorial Guayacán.
Hammel, B. E., Grayum, M. H., Herrera, C., & Zamora, N. (Eds.). (2003a). Manual de plantas de Costa Rica. Volumen II. Monocotiledóneas (Agavaceae-Musaceae). Missouri Botanical Garden Press.
Hammel, B. E., Grayum, M. H., Herrera, C. & Zamora, N. (Eds.). (2003b). Manual de plantas de Costa Rica. Volumen III. Monocotiledóneas (Orchidaceae-Zingiberaceae). Missouri Botanical Garden Press.
Hammel, B. E., Grayum, M. H., Herrera, C., & Zamora, N. (Eds.). (2007). Manual de Plantas de Costa Rica. Volumen VI. Dicotiledóneas (Haloragaceae-Phytolaccaceae). Missouri Botanical Garden Press.
Hammel, B. E., Grayum, M. H., Herrera, C., & Zamora, N. (Eds.). (2010). Manual de Plantas de Costa Rica. Volumen V. Dicotiledóneas (Clusiaceae-Gunneraceae). Missouri Botanical Garden Press.
Hammel, B. E., Grayum, M. H., Herrera, C., & Zamora, N. (Eds.). (2014). Manual de Plantas de Costa Rica. Volumen VII. Dicotiledóneas (Picramniaceae-Rutaceae). Missouri Botanical Garden Press.
Hammel, B. E., Grayum, M. H., Herrera, C., & Zamora, N. (Eds.). (2015). Manual de Plantas de Costa Rica. Volumen VIII. Dicotiledóneas (Sabiaceae-Zygophyllaceae). Missouri Botanical Garden Press.
Hammel, B. E., Grayum, M. H., Herrera, C., & Zamora, N. (Eds.). (2020a). Manual de Plantas de Costa Rica. Volumen IV. Parte 1: Dicotiledóneas (Acanthaceae-Asteraceae). Missouri Botanical Garden Press.
Hammel, B. E., Grayum, M. H., Herrera, C., & Zamora, N. (Eds.). (2020b). Manual de Plantas de Costa Rica. Volumen IV. Parte 2: Dicotiledóneas (Balanophoraceae-Clethraceae). Missouri Botanical Garden Press.
Holdridge, L. R. (1967). Life zone ecology. Tropical Science Center.
Jiménez, J. E., Juárez, P., & Díaz, A. (2016). Checklist of the vascular flora of Reserva Biológica San Luis, Costa Rica. Check List, 12(2), 1859. http://dx.doi.org/10.15560/12.2.1859
Jiménez, Q. (2015). El camino a la extinción de los árboles en Costa Rica. Ambientico, 254(4), 23-30.
León, J., & Poveda, L. (2000). Los nombres comunes de las plantas en Costa Rica. Editorial Guayacán.
Maglianesi, M. A. (2010). Caracterización de la comunidad vegetal en áreas de bosque nativo y plantaciones de coníferas en la Reserva Forestal Grecia (Alajuela, Costa Rica). Cuadernos de Investigación UNED, 2(2), 245-253. https://doi.org/10.22458/urj.v2i2.161
Morales, C. O. (2009). Caracterización florística y estructural de tres fragmentos boscosos secundarios en Cartago, Costa Rica. Revista de Biología Tropical, 57(1), 69-82. https://hdl.handle.net/10669/27069
Moura, T., Zamora, N., Torke, B. M., Mansano, V. F., & Tozzi, A. M. G. A. (2012). A new species of Mucuna (Leguminosae-Papilionoideae-Phaseoleae) from Costa Rica and Panama. Phytotaxa, 60, 1-8. https://doi.org/10.11646/phytotaxa.60.1.1
Nivia, A., & Cascante, A. (2008). Distribución de las formas de vida en la flora costarricense. Brenesia, 69, 1-17. https://bit.ly/3pULjSB
Quesada-Monge, R., & Fernández-Vega, J. (2005). Actualización de listado de especies arbóreas de uso forestal y otros usos en Costa Rica. Revista Forestal Mesoamericana Kurú, 2(4), 1-45. https://hdl.handle.net/2238/5390
Rodríguez, A. (2020). Asteraceae. En B. E. Hammel, M. H. Grayum, C. Herrera & N. Zamora (Eds.), Plantas de Costa Rica. Volumen IV. Parte 1: Dicotiledóneas (Acanthaceae-Asteraceae) (pp. 516-878). Missouri Botanical Garden Press.
Sandoval, L., Morales, C. O., Ramírez-Fernández, J. D., Hanson, P., Murillo-Hiller, L. R., & Barrantes, G. (2019). The forgotten habitats in conservation: early successional vegetation. Revista de Biología Tropical, 67(2), S36-S52. https://doi.org/10.15517/rbt.v67i2SUPL.37202
Sánchez-Azofeifa, G. A., Harris, R. C., & Skole, D. L. (2001). Deforestation in Costa Rica: A quantitative analysis using remote sensing imagery. Biotropica, 33(3), 378-384. https://doi.org/10.1111/j.1744-7429.2001.tb00192.x
Sánchez, J. (2012). Caracterización de los ecosistemas vegetales y uso del suelo en El Rodeo, Costa Rica. Brenesia, 77, 1-524. https://bit.ly/3GB3Ysm
Sharpea, J. M., & Shiels, A. B. (2014). Understory fern community structure, growth and spore production responses to a large-scale hurricane experiment in a Puerto Rico rainforest. Forest Ecology and Management, 332, 75-86. https://doi.org/10.1016/j.foreco.2014.01.023
Vargas, G. (1985). La sucesión vegetal primaria en una región de vulcanismo reciente en el Volcán Arenal y sus alrededores, Costa Rica. Revista de Biología Tropical, 33(2), 171-183. https://bit.ly/3HMhdsY
Zamora, N. (2010). Fabaceae. En B. E. Hammel, M. H. Grayum, C. Herrera & N. Zamora (Eds.), Manual de Plantas de Costa Rica. Volumen V. Dicotiledóneas (Clusiaceae-Gunneraceae) (pp. 395–775). Missouri Botanical Garden Press.
Zhu, H., Zhang, T. J., Zhang, P., & Peng, C. L. (2016). Pigment patterns and photoprotection of anthocyanins in the young leaves of four dominant subtropical forest tree species in two successional stages under contrasting light conditions. Tree physiology, 36(9), 1092-1104. http://dx.doi.org/10.1093/treephys/tpw047
APÉNDICE 1
Listado de plantas vasculares del área de estudio.
|
Táxones |
Nombre común |
F. Háb / F. Fis |
Especímenes |
|
PTERIDOPHYTA |
|||
|
Anemiaceae |
|||
|
Anemia phyllitidis (L.) Sw. |
|
T/H |
IC-1690 (CR, USJ) |
|
Athyriaceae |
|||
|
Diplazium lonchophyllum Kunze |
|
T/H |
IC-1685 (CR, US) |
|
Blechnaceae |
|||
|
Blechnum appendiculatum Willd. |
|
T/H |
IC-1674 (CR, USJ) |
|
Dennstaedtiaceae |
|||
|
Dennstaedtia dissecta (Sw.) T. Moore |
|
T/H |
IC-1671 (CR) |
|
Dryopteridaceae |
|||
|
Dryopteris Adans. sp. |
|
T/H |
IC-1675 (CR, USJ) |
|
Polypodiaceae |
|||
|
Campyloneurum xalapense Fée |
|
EpF/H |
IC-1788 (CR, MO, USJ) |
|
Pleopeltis complanata (Weath.) E.A.HooperENB |
|
EpF/H |
IC-1683 (CR) |
|
Pleopeltis friedrichsthaliana (Kunze) A.R. Sm. & Tejero |
|
EpF/H |
IC-1679 (CR, MO, USJ) |
|
Pleopeltis furfuracea (Schltdl. & Cham.) A.R. Sm. & Tejero |
|
EpF/H |
IC-1678 (CR, USJ) |
|
Pleopeltis polypodioides (L.) E.G. Andrews & Windham |
Siempre viva |
EpF/H |
IC-1672 (CR, US) |
|
Serpocaulon triseriale (Sw.) A.R. Sm. |
|
EpF/H |
IC-1673 (CR) |
|
Pteridaceae |
|||
|
Adiantum raddianum C. Pres |
|
T/H |
IC-1684 (CR) |
|
Mildella intramarginalis (Kaulf. ex Link) Trevis. |
|
T/H |
IC-1682 (CR) |
|
Pteris altissima Poir. |
|
T/H |
IC-1676 (CR) |
|
Pteris muricella Fée |
|
T/H |
IC-1675 (CR) |
|
Pteris quadriaurita Retz. |
|
T/H |
IC-1677 (CR, USJ) |
|
Pteris cretica L. |
|
T/H |
IC-1800 (CR) |
|
Thelypteridaceae |
|||
|
Thelypteris dentata (Forssk.) E.P. St. JohnIN |
|
T/H |
IC-1689 (CR) |
|
Thelypteris Schmidel sp. |
|
T/H |
IC-1790 (CR, USJ) |
|
|
|||
|
SPERMATOPHYTA |
|
|
|
|
Acanthaceae |
|||
|
Dicliptera unguiculata Nees |
Olotillo, sornia |
T/H |
IC-1700 (CR) |
|
Odontonema tubaeforme (Bertol.) Kuntze |
Coral |
T/Ar |
Obs. |
|
Pseuderanthemum cuspidatum (Nees) Radlk. |
|
T/S |
Obs. |
|
Actinidiaceae |
|||
|
Saurauia yasicae Loes. |
Moco, moquillo |
T/A |
IC-1692 (CR, MO, USJ) |
|
Amaranthaceae |
|||
|
Iresine diffusa Humb. & Bonpl. ex Willd. |
Camarón |
T/H |
IC-1736 (CR) |
|
Anacardiaceae |
|||
|
Mangifera indica L. INN |
Mango |
T/A |
Obs. |
|
Mauria heterophylla Kunth |
Cirrí, cirrí amarillo, cirrí colorado, dantisco de montaña, jiñocuabe, lentisco |
T/A |
IC-1778 (CR) |
|
Spondias purpurea L. |
Bala karbö, bolá, braa, ciruelo, jocote, jocote ácido, jocote cimarrón, jocote corona, jocote corriente, jocote de garrobo, jocote de iguana, jocote iguanero, jocote inviernero, jocote jimoyo, jocote nica, jocote pequeñito, jocote tronador, jocote veranero, sismoyo |
T/A |
Obs. |
|
Tapirira mexicana Marchand |
Cirrí, cirrí blanco, ciruelo de montaña, manteco |
T/A |
Obs. |
|
Annonaceae |
|||
|
Annona cherimola Mill. |
Anona |
T/A |
Obs. |
|
Guatteria dolichopoda Donn. Sm. |
Cirricillo |
T/A |
Obs. |
|
Apocynaceae |
|||
|
Gonolobus edulis Hemsl.ENB |
Cuajayote, cuayote |
T/L |
IC-1760 (CR, USJ) |
|
Mandevilla veraguasensis (Seem.) Hemsl. |
|
T/L |
IC-1753 (CR) |
|
Marsdenia engleriana W. RotheENB |
|
T/L |
Obs. |
|
Tonduzia stenophylla (Donn. Sm.) Pittier |
Chirca de montaña |
T/A |
IC-1737 (CR, MO, USJ) |
|
Araceae |
|||
|
Philodendron tripartitum (Jacq.) Schott |
Pitaya |
EpF/H |
IC-1704 (CR) |
|
Araliaceae |
|||
|
Oreopanax xalapensis (Kunth) Decne. & Planch. |
Cacho venado, higuera, matagente, matapalo, papayillo |
T/A |
Obs. |
|
Arecaceae |
|||
|
Chamaedorea macrospadix Oerst.ENB |
Pacaya |
T/Ar |
IC-1713 (CR) |
|
Asparagaceae |
|||
|
Dracaena fragrans (L.) Ker Gawl.INN |
Caña india |
T/Ar |
Obs. |
|
Yucca guatemalensis BakerINN |
Hitavo, itabo |
T/Ar |
Obs. |
|
Asteraceae |
|||
|
Ageratum conyzoides L. |
Santa Lucía, Santalucía |
T/S |
Obs. |
|
Baccharis pedunculata (Mill.) Cabrera |
|
T/Ar |
IC-1720 (CR, USJ) |
|
Bidens pilosa L. |
Moriseco, mozote, mozotillo, muriseco |
T/H |
IC-1715 (CR) |
|
Calea urticifolia (Mill.) DC. |
Jacalate, jalacate, jaral |
T/Ar |
IC-1776 (CR) |
|
Conyza sumatrensis (Retz.) E. Walker |
|
T/H |
IC-1768 (CR) |
|
Conyza canadensis (L.) Cronquist |
|
T/H |
IC-1765 (CR) |
|
Critonia daleoides DC. |
|
T/Ar |
IC-1745 (CR) |
|
Decachaeta thieleana (Klatt) R. M. King & H. Rob. |
|
T/Ar |
Obs. |
|
Fleischmannia pratensis (Klatt) R.M. King & H. Rob. |
Azulillo, Santa Lucía, Santalucía |
T/H |
IC-1709 (CR) |
|
Gnaphalium attenuatum DC. |
|
T/H |
IC-1764 (CR) |
|
Hypochaeris radicata L.IN |
Margarita amarilla |
T/H |
IC-1738 (CR) |
|
Lepidaploa canescens (Kunth) H. Rob. |
Tuete, tuetillo |
T/Ar |
IC-1702 (CR) |
|
Lepidaploa salzmannii (DC.) H. Rob. |
Dawaska, tuete, tuete blanco, tuetillo |
T/Ar |
IC-1721 (CR, USJ) |
|
Melanthera nivea (L.) Small |
Padra, paira, totolquelite, yerba de cabra |
T/H |
Obs. |
|
Montanoa atriplicifolia (Pers.) Sch. Bip. |
Margarita |
T/Ar |
IC-1746 (CR) |
|
Montanoa hibiscifolia Benth. |
Tora |
T/Ar |
IC-1694 (CR) |
|
Sphagneticola trilobata (L.) Pruski |
Margarita rastrera |
T/H |
Obs. |
|
Verbesina turbacensis Kunth |
Tora |
T/Ar |
IC-1716 (CR, MO, USJ) |
|
Vernonanthura patens (Kunth) H. Rob. |
Dowás, dawaska, tuete, tuete blanco, tuetillo |
T/Ar |
Obs. |
|
Balsaminaceae |
|||
|
Impatiens walleriana Hook. f. INN |
China |
T/H |
Obs. |
|
Bignoniaceae |
|||
|
Tecoma stans (L.) Juss. ex Kunth. |
Candelillo, carboncillo, serrecillo, vainilla, vainillo |
T/Ar |
Obs. |
|
Brassicaceae |
|||
|
Lepidium virginicum L.IN |
Mastuerzo |
T/H |
IC-1791 (CR) |
|
Campanulaceae |
|||
|
Lobelia laxiflora Kunth |
Caragallo, ceragallo, pastorcillo, yuquilla |
T/H |
IC-1733 (CR) |
|
Cannabaceae |
|||
|
Trema micrantha (L.) Blume |
Capulín, capulín blanco, capulín negro, jucó, vara blanca |
T/A |
Obs. |
|
Capparaceae |
|||
|
Capparidastrum discolor (Donn. Sm.) Cornejo & IltisENB |
Cacao de mico, granadilla de árbol |
T/A |
IC-1742 (CR) |
|
Celastraceae |
|||
|
Quetzalia occidentalis (Loes. ex Donn. Sm.) Lundell |
Corroncho |
T/A |
IC-1748 (CR) |
|
Clethraceae |
|
|
|
|
Clethra lanata M. Martens & Galeotti |
Nance macho |
T/A |
IC-1771 (CR, MO, USJ) |
|
Commelinaceae |
|
|
|
|
Tradescantia zanonia (L.) Sw. |
Cañutillo, Matalomoyo |
T/H |
Obs. |
|
Tripogandra serrulata (Vahl) |
|
T/H |
IC-1717 (CR) |
|
Convolvulaceae |
|||
|
Ipomoea batatas (L.) Lam. |
Camote |
T/L |
Obs. |
|
Ipomoea lindenii M. Martens & Galeotti |
Churristate |
T/L |
Obs. |
|
Costaceae |
|||
|
Costus montanus MaasEN |
Caña agria, cañagria |
T/H |
IC-1728 (CR) |
|
Cucurbitaceae |
|||
|
Cucumis sativus L.INN |
Pepino |
T/L |
Obs. |
|
Sechium edule (Jacq.) Sw.INN |
Chayote |
T/L |
Obs. |
|
Sechium tacaco (Pittier) C. JeffreyEN |
Tacaco |
T/L |
Obs. |
|
Cupressaceae |
|||
|
Cupressus lusitanica Mill.INN |
Ciprés |
T/A |
IC-1770 (CR, USJ) |
|
Dipentodontaceae |
|
|
|
|
Perrottetia longistylis Rose |
|
T/A |
IC-1787 (CR) |
|
Euphorbiaceae |
|||
|
Acalypha ferdinandii K. Hoffm. |
|
T/Ar |
Obs. |
|
Acalypha macrostachya Jacq. |
Ortiga |
T/Ar |
Obs. |
|
Croton decalobus Müll. Arg. |
Carré, copalchí |
T/Ar |
IC-1727 (CR, MO, USJ) |
|
Croton draco Schltdl. & Cham. |
Balsayú, targuá, Ttataraguá |
T/A |
Obs. |
|
Croton niveus Jacq. |
Colpachí, copalchí |
T/A |
IC-1763 (CR, USJ) |
|
Sapium glandulosum (L.) Morong |
Palo de leche, yos |
T/A |
Obs. |
|
Fabaceae |
|||
|
Calliandra houstoniana (Mill.) Standl. |
Cabellos de Ángel, carboncillo rojo |
T/Ar |
IC-1756 (CR, USJ) |
|
Crotalaria vitellina Ker Gawl. |
Cascabel, chipilín, quiebraplato, sonajero |
T/Ar |
Obs. |
|
Desmodium intortum (Mill.) Urb. |
Pegapega |
T/H |
Obs. |
|
Diphysa americana (Mill.) M. Sousa |
Guachipelín, guachipilín |
T/A |
Obs. |
|
Erythrina berteroana Urb. |
Poró, poró de montaña, poró espinoso |
T/A |
Obs. |
|
Gliricidia sepium (Jacq.) Kunth ex Walp. |
Madera negra, madero negro, madero de cacao |
T/A |
Obs. |
|
Indigofera costaricensis Benth.ENB |
|
T/Ar |
Obs. |
|
Inga punctata Willd. |
Cuajiniquil, guaba, guabo, juaniquil, juaniquil breñero, puraa, surrí |
T/A |
IC-1714 (CR) |
|
Inga oerstediana Benth. ex Seem. |
Cuajiniquil colorado, cuajiniquil peludo, guaba, guaba chilillo, guaba peluda, guabo |
T/A |
IC-1786 (CR) |
|
Mimosa albida Humb. & Bonpl. ex Willd. |
Dormilona |
T/H |
Obs. |
|
Mimosa pudica L. |
Dormilona, naupate, puta vieja |
T/H |
Obs. |
|
Mucuna monticola N. Zamora, T.M. Moura & A.M.G. AzevedoENB |
Ojo de buey, ojo de venado |
T/L |
IC-1703 (CR) |
|
Phaseolus lunatus L. |
Frijol Lima, frijolillo |
T/L |
Obs. |
|
Fagaceae |
|||
|
Quercus corrugata Hook. |
Roble, encino, roble encino |
T/A |
IC-1755 (CR, MO, USJ) |
|
Hamamelidaceae |
|||
|
Molinadendron guatemalense (Radlk. ex Harms) P.K. Endress |
Mangle |
T/A |
IC-1695 (CR, MO, USJ) |
|
Heliconiaceae |
|||
|
Heliconia tortuosa Griggs |
Heliconia |
T/H |
IC-1697 (CR, MO, USJ) |
|
Heliotropiaceae |
|||
|
Tournefortia glabra L. |
Maicillo, maíz de gallo |
T/Ar |
IC-1710 (CR, MO, USJ) |
|
Lamiaceae |
|||
|
Hyptis pectinata (L.) Poit. |
Chan, chian |
T/S |
IC-1729 (CR) |
|
Lauraceae |
|||
|
Damburneya salicina (C.K. Allen) Trofimov & Rohwer |
Aguacatillo, ira, ira coralillo |
T/A |
IC-1781 (CR, USJ) |
|
Ocotea laetevirens Standl. & Steyerm. |
Ira amarillo |
T/A |
IC-1747 (CR) |
|
Ocotea floribunda (Sw.) Mez |
|
T/A |
IC-1740 (CR) |
|
Persea americana Mill. |
Aguacate, palta |
T/A |
Obs. |
|
Persea caerulea (Ruiz & Pav.) Mez |
Aguacatillo, ira café |
T/A |
IC-1780 (CR, USJ) |
|
Lythraceae |
|||
|
Cuphea appendiculata Benth. |
|
T/Ar |
IC-1712 (CR, MO, USJ) |
|
Malvaceae |
|||
|
Heliocarpus appendiculatus Turcz. |
Burío, burío colorado |
T/A |
Obs. |
|
Malvaviscus arboreus Cav. |
Amapola, amapolita, mapola, quesito |
T/Ar |
IC-1750 (CR) |
|
Triumfetta bogotensis DC. |
Mozote, mozote de caballo |
T/Ar |
IC-1735 (CR) |
|
Sida haenkeana C. Presl |
Escobilla |
T/Ar |
Obs. |
|
Marantaceae |
|||
|
Calathea crotalifera S. Watson |
Bijagua, cascabel, platanilla |
T/H |
IC-1707 (CR, USJ) |
|
Melastomataceae |
|||
|
Chaetogastra ciliaris (Vent.) DC. |
|
T/Ar |
IC-1719 (CR) |
|
Conostegia xalapensis (Bonpl.) D. Don ex DC. |
Escobilla, escobillo, lengua de gato, lengua de vaca, purré, purrá, uña de gato |
T/Ar |
IC-1718 (CR, MO, USJ) |
|
Heterocentron glandulosum Schenk |
Quebradizo |
T/Ar |
IC-1767 (CR, USJ) |
|
Miconia aeruginosa Naudin |
Lengua de vaca, terciopelo |
T/Ar |
IC-1691 (CR, MO, USJ) |
|
Meliaceae |
|||
|
Trichilia havanensis Jacq. |
Uruca |
T/A |
Obs. |
|
Moraceae |
|||
|
Ficus aurea Nutt. |
Higuerón |
T/A |
Obs. |
|
Ficus pertusa L. f. |
Higuerón |
T/A |
IC-1772 (CR, MO, USJ) |
|
Sorocea trophoides W.C. Burger |
|
T/A |
Obs. |
|
Musaceae |
|
|
|
|
Musa acuminata CollaINN |
Banano |
T/H |
Obs. |
|
Musa ×paradisiaca L. ‘Bluggoe’INN |
Cuadrada, guineo cuadrado |
T/H |
Obs. |
|
Musa ×paradisiaca L. ‘Pelipita’INN |
Felipa, felipita, gelipa, gelipita, guineo pilipita |
T/H |
Obs. |
|
Myrtaceae |
|||
|
Myrcia neopallens A.R. Lourenço & E. Lucas |
Murta |
T/A |
IC-1706 (CR, MO, USJ) |
|
Psidium guajava L. |
Guayaba, guayabo |
T/A |
Obs. |
|
Psidium guineense Sw. |
Güísaro |
T/A |
Obs. |
|
Syzygium jambos (L.) AlstonIN |
Manzana rosa |
T/A |
Obs. |
|
Oleaceae |
|||
|
Chionanthus panamensis (Standl.) Stearn. |
Chorriado, comenegro |
T/A |
Obs. |
|
Ligustrum lucidum W.T. AitonIN |
Aligustre, ligustro, siempreverde, trueno |
T/A |
Obs. |
|
Orchidaceae |
|||
|
Govenia quadriplicata Rchb. f. |
|
T/H |
Obs. |
|
Sarcoglottis smithii (Rchb. f.) Schltr.ENB |
|
T/H |
Obs. |
|
Oxalidaceae |
|||
|
Oxalis corniculata L. |
Acedera, trébol |
T/H |
Obs. |
|
Papaveraceae |
|||
|
Bocconia frutescens L. |
Cacho de venado, cola de gallo, guacamaya, guacamayo, pavo, papayillo, papayo, tabaquillo, tora, uña de león |
T/Ar |
Obs. |
|
Passifloraceae |
|||
|
Passiflora apetala Killip |
Calzoncillo |
T/L |
IC-1762 (CR) |
|
Passiflora miniata Vanderpl.INN |
Ala de murciélago, flor de pasión escarlata |
T/L |
IC-1734 (CR) |
|
Petiveriaceae |
|||
|
Rivina humilis L. |
Carmín |
T/S |
IC-1711 (CR) |
|
Picramniaceae |
|||
|
Picramnia antidesma Sw. |
Cafecillo, caragre, caregre, corteza amarga, palo de arco, quina, sartalillo |
T/Ar |
Obs. |
|
Piperaceae |
|||
|
Piper aequale Vahl |
|
T/Ar |
IC-1699 (CR, MO, USJ) |
|
Piper hispidum Sw. |
Cigarrillo |
T/Ar |
Obs. |
|
Piper obliquum Ruiz & Pav. |
|
T/Ar |
Obs. |
|
Poaceae |
|||
|
Brachiaria decumbens Stapf ‘Basilisk’INN |
Pasto Braquiaria |
T/H |
Obs. |
|
Ichnanthus pallens (Sw.) Munro ex Benth. |
|
T/H |
Obs. |
|
Lasiacis nigra Davidse |
Carrizo |
T/H |
Obs. |
|
Melinis repens (Willd.) ZizkaIN |
Pasto carretero, pasto rosado, zacate de seda, zacate ilusión |
T/H |
IC-1782 (CR, USJ) |
|
Pennisetum purpureum Schumach.INN |
Gigante, pasto elefante, pasto gigante, pasto azul |
T/H |
Obs. |
|
Pennisetum purpureum Schumach. ‘King Grass’INN |
Pasto Kingra |
T/H |
Obs. |
|
Phyllanthaceae |
|||
|
Phyllanthus niruri L. |
Niruri, quebra-pedra, riñoncillo |
T/H |
IC-1766 (CR, USJ) |
|
Polemoniaceae |
|||
|
Loeselia glandulosa (Cav.) G. Don |
Azulilla, espinosilla, pegarropa |
T/Ar |
IC-1722 (CR, USJ) |
|
Polygalaceae |
|||
|
Monnina sylvicola ChodatENB |
|
T/H, Ar |
IC-1705 (CR) |
|
Primulaceae |
|||
|
Ardisia compressa Kunth |
Huesillo, madurillo, murta, tucuico |
T/Ar |
Obs. |
|
Myrsine coriacea (Sw.) R. Br. ex Roem. & Schult. |
Hojalarga, ratón, ratón blanco, ratoncillo |
T/A |
IC-1726 (CR, MO, USJ) |
|
Proteaceae |
|||
|
Panopsis costaricensis Standl.ENB |
Coquillo, Coquito, palo de papa, papa, papa de monte |
T/A |
IC-1784 (CR) |
|
Rhamnaceae |
|||
|
Gouania lupuloides (L.) Urb. |
Bejuco leñatero |
T/L |
Obs. |
|
Ranunculaceae |
|||
|
Clematis grossa Benth. |
Barba de viejo |
T/L |
Obs. |
|
Frangula capreifolia (Schltdl.) Grubov |
Duraznillo |
T/A |
IC-1769 (CR, MO, USJ) |
|
Rosaceae |
|||
|
Eriobotrya japonica (Thunb.) Lindl.IN |
Níspero, níspero del Japón |
T/A |
IC1773 (CR, MO, USJ) |
|
Prunus occidentalis Sw. |
Maicillo |
T/A |
IC-1741 (CR, USJ) |
|
Rubus eriocarpus Liebm. |
Mora, mora blanca, mora de caballo |
T/S |
IC-1779 (CR, USJ) |
|
Rubus niveus Thunb.IN |
Frambuesa de Ceilán |
T/S |
IC-1758 (CR) |
|
Rubus rosifolius Sm.IN |
Frambuesa, mora, mora extranjera |
T/S |
IC-1759 (CR) |
|
Rubus urticifolius Poir. |
Mora, mora de montaña |
T/S |
IC-1757 (CR) |
|
Rubiaceae |
|||
|
Arachnothryx buddleioides (Benth.) Planch. |
Algodoncillo |
T/A |
Obs. |
|
Coccocypselum hispidulum (Standl.) Standl. |
|
T/H |
IC-1761 (CR, USJ) |
|
Coffea arabica L.INN |
Café, café arábico, cafeto |
T/Ar |
Obs. |
|
Hamelia patens Jacq. |
Añilito, arrocillo, azulillo, canela, clavillo, coralillo, palo camarón, pisí, zorrillo, zorrillo colorado, zorrillo real |
T/Ar |
IC-1701 (CR, USJ) |
|
Palicourea padifolia (Humb. & Bonpl. ex Roem. & Schult.) C.M. Taylor & Lorence |
Cafecillo |
T/Ar |
IC-1743 (CR, MO, USJ) |
|
Psychotria pubescens Sw. |
|
T/Ar |
IC-1732 (CR, USJ) |
|
Randia aculeata L. |
Espino, espino blanco, horquetilla |
T/Ar |
Obs. |
|
Rogiera amoena Planch. |
Quina, Teresa |
T/Ar |
IC-1754 (CR) |
|
Rutaceae |
|||
|
Citrus reticulata BlancoINN |
Limón mandarina, mandarino, naranjilla |
T/Ar |
Obs. |
|
Salicaceae |
|||
|
Xylosma flexuosa (Kunth) Hemsl. |
Malacahüite, matacartago, peipute |
T/A |
Obs. |
|
Santalanaceae |
|||
|
Phoradendron piperoides (Kunth) Trel. |
Matapalo |
HEp/H |
IC-1696 (CR, MO, USJ) |
|
Sapindaceae |
|||
|
Cupania glabra Sw. |
Carne asada, cascuá, güesillo, tres huevos |
T/Ar, A |
Obs. |
|
Paullinia costaricensis Radlk. |
Junco, ojo de pájaro |
T/L |
Obs. |
|
Smilacaceae |
|||
|
Smilax domingensis Willd. |
Bejuco de canastos, culculmeca |
T/L |
Obs. |
|
Sapotaceae |
|||
|
Pouteria sapota (Jacq.) H.E. Moore & Stearn |
kalámbali, kalóm, klöm, köm, zapote, zapote colorado, zapote de mono, zapote mamey, zapote negro, zapotillo |
T/A |
IC-1739 (CR, MO, USJ) |
|
Solanaceae |
|||
|
Acnistus arborescens (L.) Schltdl. |
Güitite |
T/Ar |
Obs. |
|
Cestrum tomentosum L. f. |
Zorrillo, zorrillo blanco |
T/Ar |
IC-1585 (CR, MO) |
|
Solanum acerifolium Dunal |
Berenjena, huevos de perro, rabo de chancho |
T/Ar |
Obs. |
|
Solanum rovirosanum Donn. Sm. |
Tomatillo |
T/Ar |
Obs. |
|
Solanum torvum Sw. |
Berenjena cimarrona, berenjena espinuda, uña de gato |
T/Ar |
IC-1774 (CR, USJ) |
|
Solanum umbellatum Mill. |
Bodoque, zorrillo |
T/Ar |
Obs. |
|
Solanum wendlandii Hook. f. |
Flor de volcán, volcán |
T/L |
IC-1725 (CR, MO, USJ) |
|
Witheringia asterotricha (Standl.) Hunz. |
Quina |
T/S |
IC-1723 (CR, USJ) |
|
Staphyleaceae |
|||
|
Staphylea occidentalis Sw. |
Falso Cristobal, sauco |
T/A |
Obs. |
|
Symplocaceae |
|||
|
Symplocos limoncillo Bonpl. |
Corral |
T/A |
IC-1749 (CR) |
|
Ulmaceae |
|||
|
Ulmus mexicana (Liebm.) Planch. |
Cenizo, tirrá |
T/A |
Obs. |
|
Urticaceae |
|||
|
Cecropia angustifolia Trécul |
Guarumo de montaña |
T/A |
Obs. |
|
Myriocarpa longipes Liebm. |
Cofalillo, estrella, guarumo macho, lija, ortiga |
T/Ar |
IC-1724 (CR, USJ) |
|
Phenax rugosus (Poir.) Wedd. |
|
T/Ar |
IC-1698 (CR, USJ) |
|
Boehmeria burgeriana Wilmot-Dear, Friis & Kravtsova |
|
T/S |
Obs. |
|
Verbenaceae |
|||
|
Citharexylum donnell-smithii Greenm. |
Dama, fruto de paloma, huelenoche |
T/A |
Obs. |
|
Lantana camara L. |
Cinco negritos, cuasquite, flor roja, flor de muerto, jaral, mora de caballo, soterré, soterré blanco, uvita |
T/Ar |
IC-1775 (CR, USJ) |
|
Verbena litoralis Kunth |
Verbena |
T/H |
IC-1783 (CR) |
|
Vitaceae |
|||
|
Cissus verticillata (L.) Nicolson & C.E. Jarvis |
Bejuco ubí, uvilla |
T/L |
IC-1785 (CR, MO, USJ) |
*Orden alfabético por división taxonómica, de arriba hacia abajo.
**Forma de vida según su hábitat (F. Háb): Terrestre (T), epífita facultativa (EpF), holoepífita (HEp). Forma de vida según su fisonomía (F. Fis): Árbol (A), arbusto (Ar), sufrútice (S), hierba (H), liana (L). Distribución: Endémica (EN), endémica binacional (ENB), introducida naturalizada (IN), introducida no naturalizada (INN). Observado (Obs.). Recolector: Isler F. Chinchilla (IC).