
UNED Research Journal (e-ISSN 1659-441X), Vol.15(1): e4403, June, 2023
Estado de conservación, sexo y tamaño corporal de reptiles en Santiago Nonualco, El Salvador
1. Universidad Estatal a Distancia, Maestría Académica en Manejo de Recursos Naturales, énfasis Biodiversidad. Sabanilla, San José, Costa Rica; perezjose2493@gmail.com
Recibido 28-IX-2022 □ Corregido 18-XII-2022 □ Aceptado 19-I-2023
DOI: https://doi.org/10.22458/urj.v15i1.4403
|
ABSTRACT. “Conservation status, sex and body size of reptiles in Santiago Nonualco, El Salvador”. Introduction: In recent years, there has been an increase in the number of reptile species considered threatened by emerging pressures in El Salvador. Body characteristics are observable traits that help in the evaluation of their conservation status, but little has been done in El Salvador on this subject. Objective: To evaluate the conservation status, sex and body size of the reptiles of Santiago Nonualco, El Salvador. Methods: We compared the conservation status in official listings with the Environmental Vulnerability Index. Results: We identified 36 species, 14 in some conservation category, six threatened and one at risk of extinction in El Salvador. Individuals of medium body size and adults were the most abundant. Males were larger and more abundant, except in turtles. Conclusion: Santiago Nonualco provides refuge for several reptiles, including threatened species. Turtles differ from other reptiles in sexual differences; and small individuals were less frequently seen in this census.
Keywords: Body size, sex ratio, natural history, herpetofauna.
|
RESUMEN. Introducción: En años recientes ha habido un incremento en el número de especies de reptiles consideradas amenazadas por presiones emergentes en El Salvador. Las características corporales son rasgos observables que ayudan en la evaluación de su estado de conservación, pero poco se ha hecho en El Salvador sobre este tema. Objetivo: Evaluar el estado de conservación, sexo y tamaño corporal de los reptiles de Santiago Nonualco, El Salvador. Métodos: Comparamos el estado de conservación en listados oficiales con el Índice de Vulnerabilidad Ambiental. Resultados: Identificamos 36 especies, 14 en alguna categoría de conservación, seis amenazadas y una en riesgo de extinción en El Salvador. Los individuos de tamaño corporal medio y los adultos fueron los más abundantes. Los machos fueron más grandes y abundantes, excepto en las tortugas. Conclusión: Santiago Nonualco brinda refugio a varios reptiles, incluidas especies amenazadas. Las tortugas se diferencian de otros reptiles en las diferencias sexuales; y los individuos pequeños se vieron con menos frecuencia en este censo.
Palabras clave: Tamaño corporal, proporción sexual, historia natural, herpetofauna.
|
Los rasgos biológicos son características morfológicas, fisiológicas, químicas, estructurales, fenológicas y conductuales a nivel individual o de especie (Miatta et al., 2021). Los atributos de edad, sexo, sistema de reproducción, tamaño corporal y forma de alimentación caracterizan los roles ecológicos, la distribución espacial, las interacciones inter e intraespecíficas y con el medio circundante de las especies (Weber et al., 2021). Los enfoques basados en rasgos biológicos a nivel de vertebrados especialmente en reptiles, son útiles para inferir las respuestas de las especies al medio y los efectos de los individuos en los procesos de los ecosistemas y constituyen un punto de partida para desarrollar estrategias de conservación, puesto que estos enfoques caracterizan a las poblaciones incluso a las comunidades (Miatta et al., 2021).
El tamaño corporal es uno de los atributos más influyentes en la biología y ecología de los organismos (Lu et al., 2022). Existe una tendencia sobre que las especies grandes se distribuyen por áreas geográficas más grandes, mientras que las especies más pequeñas las áreas de distribución geográfica son más variables (Velasco et al., 2020). El tamaño corporal grande está relacionado con la disponibilidad de presas relativamente grandes en el ambiente, puesto que los reptiles de tallas grandes tienden a evitar presas pequeñas porque son más difíciles de manejar y los costos energéticos para consumirlos excede la ganancia de energía (Costa et al., 2008). Además, un tamaño corporal grande puede significar un aumento en la tasa de supervivencia en unas poblaciones, pero no en otras, tiende a variar según las condiciones ambientales y en ciertas especies puede variar entre sexo o zonas geográficas (Warner & Shine, 2007).
El dimorfismo sexual es común en la naturaleza y una de las expresiones de este fenómeno es la diferencia corporal entre machos y hembras (Liang et al., 2021). En reptiles, el dimorfismo de tamaño sexual se explica por la teoría de selección sexual (Márquez et al., 2005) y la divergencia resultante de la competencia intraespecífica (Agha et al., 2018) y está más sesgado hacia el sexo femenino en serpiente y tortugas, mientras que en lagartos y cocodrilos los machos suelen ser los más grandes (Lu et al., 2022). Cuando los machos son más grandes, estos tienen mayor capacidad de luchar contra individuos pequeños por el acceso a recursos como el espacio y el alimento, así también por las parejas (Liang et al., 2021; Lu et al., 2022). Por otra parte, la abundancia y fecundidad femenina generalmente aumenta con el tamaño corporal de la hembra, por lo que en ciertas especies, necesitan que las hembras sean más grandes para obtener mayor éxito reproductivo y supervivencia de la especie (Agha et al., 2018).
En reptiles es más probable que una especie sea propensa a la extinción según varíen las características biológicas y los factores ambientales. La especialización del hábitat, tamaño corporal grande y la distribución geográfica restringida frecuentemente está correlacionada con un mayor riesgo de extinción (Böhm et al., 2016). Los factores externos como la destrucción del hábitat, contaminación, especies invasoras, sobreexplotación y el cambio climático impulsan las extinciones, y dependiendo del factor, ciertos rasgos biológicos pueden ser cruciales en la trayectoria de una especie hacia la extinción (Chichorro et al., 2020). De tal manera, el abordaje de los rasgos biológicos permite hacer comparaciones a futuro y es el punto de partida para explicar los efectos de la degradación del hábitat sobre las especies (Urbina-Cardona et al., 2006; Vitt & Caldwell, 2014).
En El Salvador aún es limitada la información sobre los reptiles en cuanto a las características corporales. Por lo cual, este trabajo aporta información relacionada con aspectos biológicos de este grupo de vertebrado y tuvo por objetivo evaluar el estado de conservación, sexo y tamaño corporal de una comunidad de reptiles en el municipio de Santiago Nonualco, El Salvador.
MATERIALES Y MÉTODOS
El área de muestreo se localiza al noroeste del casco urbano del municipio de Santiago Nonualco, departamento de La Paz, El Salvador (13°51’ y 13°54’ N y 88°93’ y 88°95’ W), en la región de transición de la planicie costera y a la cordillera del Bálsamo-San Vicente, a una altitud entre 200 y 400msnm. La zona corresponde a la zona de vida de bosque húmedo subtropical (Carbajal et al., 2009). Presenta un clima cálido con marcada estacionalidad (lluvias: mayo-octubre, Sequía: noviembre-abril), con temperaturas de 27°C, precipitaciones de 1960mm y humedad relativa promedio de 74% (Cuéllar, 2006; Carbajal et al., 2009). El área se caracteriza por remanentes de bosque caducifolio, bosque semideciduo, bosque ripario y alta actividad agropecuaria.
Se realizaron 12 jornadas de campo entre marzo y agosto de 2021, dos por mes y cada una con duración de cuatro días. Se establecieron al azar 32 trayectos lineales de 100m por cuatro m de ancho abarcando las zonas boscosas de la zona. En cada visita al campo se muestreo una vez todos los trayectos por medio de la técnica de Inspección por Encuentro Visual (Heyer et al., 2001; Doan, 2016), la inspección de cada trayecto fue realizado por dos personas en forma simultánea y en zig-zag, con duración aproximada de una hora. Los muestreos se realizaron entre 8:00h y 13:00h y entre 15:00h y 20:00h, por lo que el esfuerzo diario de muestreo con este método fue de 16 horas/hombre, para un total de 768 horas/hombre; se seleccionaron estas horas de muestreos debido a que son el periodo donde los reptiles tienen mayor actividad y es más probable la detección de estas especies.
Todos los individuos se identificaron en el campo con ayuda de literatura especializada (Köhler et al., 2006; Guerra-Centeno et al., 2014; Ministerio de Medio Ambiente y Recurso Naturales [MARN], 2018; Uetz & Hallermann, 2022). Los individuos se clasificaron en adultos si mostraban características corporales típicas de los adultos como la coloración y tamaño según la especie, el resto de individuos se clasificaron como subadultos. Cuando se pudo se registró el sexo considerando características distintivas de cada sexo como la reducción de la barba gular o la presencia de hemipenes y de los individuos atrapados se tomaron medidas morfométricas en cm. La caracterización de las tallas y tamaño corporal tuvo como base la longitud hocico-cloaca (LHC). En concordancia con Medina-Rangel y Cárdenas-Árevalo (2015), los individuos se clasificaron en pequeños (lagartijas inferiores a 4cm y serpientes inferior a 40cm), medianos (lagartijas 4-10cm, serpientes 40-100cm) y grandes (lagartijas superiores a 10cm y serpientes superiores a 100cm). La manipulación de los individuos atrapados fue de manera manual y se liberaron posterior a la toma de datos.
Adicionalmente, con el fin de obtener un listado de especies más amplio, entre mayo de 2021 y julio de 2022 se realizaron 12 recorridos de 1km de longitud sobre la calle principal tipo rural del área de estudio, la cual se encuentra pavimentada en algunos sectores y no presenta alto flujo vehicular. Para ello, en cada recorrido se aplicó la técnica de búsqueda sin restricciones (Rentería, 2013; Angarita-Sierra, 2014, Moya-Robledo, 2016; Rengifo et al., 2021) con una duración de 90 minutos aproximadamente. Con esta técnica sólo se colectó información de especies nuevas respecto a lo registrado con el método del trayecto. Además, se determinó el estado de los individuos al momento de observarlos en: vivos o muertos, en este último caso se describió el daño que tuvo cada individuo según De la Quintana et al. (2022).
Se evaluó el estado de conservación de los reptiles por medio del listado oficial de especies amenazadas del Ministerio de Medio Ambiente y Recursos Naturales (2015), la lista roja de la Unión Internacional para la Conservación de la Naturaleza (2022), los Apéndices de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES, 2022) y el Cálculo de Vulnerabilidad Ambiental propuesto por Wilson y McCranie (2004) y Johnson et al. (2015), el cual se basa en a) la distribución geográfica b) la distribución ecológica y c) el grado de persecución humana hacia la especie y considera una escala de vulnerabilidad baja, media y alta (Apéndice 1).
Para el análisis poblacional sólo se tomó en cuenta la información recolectada a través de los trayectos. La proporción de sexos se basó en individuos adultos debido a que en este grupo etario es más factible realizar la distinción de lo sexos y se calculó dividiendo el número de individuos machos entre el total de individuos hembras de cada especie (Benavides-Morera et al., 2017). Se aplicó una prueba de chi cuadrado para determinar si existe diferencia entre la proporción calculada y esperada (1:1). Se comparó la longitud corporal entre sexos mediante una prueba de t de Student. Todos los análisis se realizaron en R 4.0.3 (R Core Team, 2020) y las pruebas tuvieron un nivel de significancia del 0,05.
RESULTADOS
Se registraron 36 especies de reptiles (28 para los trayectos y ocho en los recorridos) de las cuales, 14 se encuentran en categoría de riesgo, seis están amenazadas y una está en peligro de extinción según MARN; cuatro especies están reportadas en el Apéndice II de la CITES y el Cálculo de Vulnerabilidad Ambiental arrojó que dos especies presentaron vulnerabilidad alta, nueve vulnerabilidad media y 24 vulnerabilidad baja (Tabla 1). Asimismo, se encontró que algunas especies coincidían en el estatus de conservación respecto a los análisis utilizados, como por ejemplo el caso de Ctenosaura similis, Iguana Iguana y Loxocemus bicolor que presentan alguna categoría de conservación en tres tipos de análisis utilizados (Tabla 1).
Se registraron 36 especies de reptiles (28 para los trayectos y ocho en los recorridos) de las cuales, 14 se encuentran en categoría de riesgo, seis presentan amenaza y una está en peligro de extinción dentro del territorio salvadoreño. Ninguna pertenece a la lista roja de la UICN, pero cuatro están dentro del Apéndice II de la CITES. Según el Cálculo de Vulnerabilidad Ambiental dos especies presentan vulnerabilidad alta, nueve vulnerabilidades medias y 24 presentan vulnerabilidad baja. Se detectó que en algunas especies hubo coincidencia en el estatus de conservación respecto a los métodos utilizados (Tabla 1), como por ejemplo el caso de Ctenosaura similis, Iguana Iguana y Loxocemus bicolor que presentan alguna categoría de conservación en tres métodos.
Seis ejemplares de serpientes fueron encontradas muertas: Masticophis mentovarius, Scaphiodontophis annulatus e Imantodes gemmistratus se encontraron con cuerpo completo y con pocos daños; Coniophanes fissidens y Micrurus nigrocinctus se encontraron con cuerpos cortados en pedazos; solamente L. bicolor se registró aplastada en medio de la vía casi en estado de descomposición (Apéndice 2).
En la mayoría de las especies los individuos adultos fueron los de mayor abundancia (Tabla 1). En relación al tamaño corporal de los individuos atrapados, en las lagartijas hubo dos especies de categoría grande (B. vittatus y Holcosus undulatus), el resto presentaron talla mediana (Tabla 2). En serpientes, hubo dos especies de talla mediana y una de categoría pequeña. De las especies que presentaron individuos adultos, se les pudo determinar el sexo a 12 especies. De estas, la mayoría estuvo representada por individuos machos (Figura 1), a excepción de Rhinoclemmys pulcherrima y Kinosternon scorpioides que todos sus individuos fueron hembras. Solo en A. deppii hubo igual proporción de sexos (M:H= 1; no distinta de 1; X2= 0; p>0,05). Solamente en cuatro especies se pudo establecer la relación de tamaño corporal entre sexos. Se detectó que en Anolis macrophallus y en A. wellbornae los machos tuvieron mayor tamaño que las hembras (Tabla 3, Apéndice 3). Para el caso de A. serranoi y Sceloporus squamosus no se encontró diferencia de tamaño corporal entre los sexos.
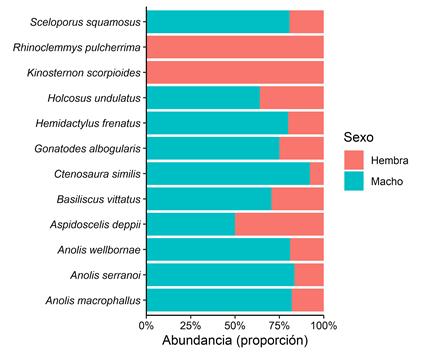
Fig. 1. Proporción de sexos en individuos adultos de reptiles registrados dentro de los trayectos de muestreo. Santiago Nonualco, El Salvador
TABLA 2
Tamaño corporal (LHC) de los reptiles capturados dentro de los trayectos de muestreo. Santiago Nonualco, El Salvador
|
Especie |
n |
Media |
Mínimo-Máximo |
Categoría |
|
Anolis macrophallus |
71 |
4,30 ± 0,26 |
3,60-5,10 |
Mediana |
|
Anolis serranoi |
72 |
6,55 ± 0,56 |
4,40-8,00 |
Mediana |
|
Anolis wellbornae |
53 |
4,43 ± 0,50 |
3,50-6,30 |
Mediana |
|
Aspidoscelis deppii |
1 |
7,60 |
|
Mediana |
|
Basiliscus vittatus |
11 |
12,21 ± 1,48 |
11,00-15,10 |
Grande |
|
Boa imperator |
1 |
49,20 |
|
Mediana |
|
Coniophanes picievittis |
1 |
43,00 |
|
Mediana |
|
Ctenosaura similis |
1 |
7,40 |
|
Mediana |
|
Epictina phenops |
1 |
7,40 |
|
Pequeña |
|
Gonatodes albogularis |
3 |
4,00 ± 0,10 |
3,90-4,10 |
Mediana |
|
Hemidactylus frenatus |
4 |
4,22 ± 0,25 |
4,10-4,60 |
Mediana |
|
Holcosus undulatus |
2 |
10,20 ± 0,98 |
9,50-10,90 |
Grande |
|
Leptodeira rhombifera |
1 |
51,00 |
|
Mediana |
|
Marisora unimarginata |
3 |
6,20 ± 0,10 |
6,10-6,30 |
Mediana |
|
Sceloporus squamosus |
63 |
4,75 ± 0,47 |
3,90-5,90 |
Mediana |
|
Scincella assatus |
2 |
4,45 ± 0,42 |
4,20-4,80 |
Mediana |
|
Kinosternon scorpioides |
3 |
13,16 ± 0,76* |
15,5-14,00 |
|
|
Rhinoclemmys pulcherrima |
1 |
14,5* |
|
|
* Corresponden a valores de la longitud del plastrón.
TABLA 1
Inventario general, método de detección, estado de conservación y distribución de la abundancia de los reptiles según la etapa de vida. Santiago Nonualco, El Salvador
|
FAMILIA/Especie |
Detección |
Estado |
MARN* |
UICN** |
CITES*** |
CVA**** |
Subadulto |
Adulto |
Total |
|
CORYTOPHANIDAE |
|
|
|
|
|
|
|
|
|
|
Basiliscus vittatus |
Trayectos |
Vivo |
SA |
LC |
|
B |
40 |
61 |
101 |
|
DACTYLOIDAE |
|
|
|
|
|
|
|
|
|
|
Anolis macrophallus |
Trayectos |
Vivo |
SA |
LC |
|
A |
0 |
73 |
72 |
|
Anolis serranoi |
Trayectos |
Vivo |
SA |
LC |
|
M |
1 |
88 |
89 |
|
Anolis wellbornae |
Trayectos |
Vivo |
SA |
LC |
|
A |
0 |
76 |
76 |
|
GEKKONIDAE |
|
|
|
|
|
|
|
|
|
|
Hemidactylus frenatus |
Trayectos |
Vivo |
SA |
LC |
|
NE |
0 |
5 |
5 |
|
IGUANIDAE |
|
|
|
|
|
|
|
|
|
|
Ctenosaura similis |
Trayectos |
Vivo |
A |
LC |
Apéndice II |
M |
22 |
11 |
33 |
|
Iguana iguana |
Trayectos |
Vivo |
A |
LC |
Apéndice II |
M |
2 |
0 |
2 |
|
PHYLLODACTYLIDAE |
|
|
|
|
|
|
|
|
|
|
Phyllodactylus tuberculosus |
Trayectos |
Vivo |
SA |
LC |
|
B |
0 |
2 |
2 |
|
PHRYNOSOMATIDAE |
|
|
|
|
|
|
|
|
|
|
Sceloporus squamosus |
Trayectos |
Vivo |
SA |
LC |
|
M |
14 |
90 |
104 |
|
SPHAERODACTYLIDAE |
|
|
|
|
|
|
|
|
|
|
Gonatodes albogularis |
Trayectos |
Vivo |
SA |
LC |
|
B |
0 |
4 |
4 |
|
SCINCIDAE |
|
|
|
|
|
|
|
|
|
|
Marisora brachypoda |
Trayectos |
Vivo |
SA |
LC |
|
B |
0 |
11 |
11 |
|
Scincella assata |
Trayectos |
Vivo |
SA |
LC |
|
B |
0 |
2 |
2 |
|
TEIIDAE |
|
|
|
|
|
|
|
|
|
|
Aspidoscelis deppii |
Trayectos |
Vivo |
SA |
LC |
|
B |
48 |
36 |
84 |
|
Holcosus undulatus |
Trayectos |
Vivo |
SA |
LC |
|
B |
10 |
50 |
60 |
|
XANTHUSIIDAE |
|
|
|
|
|
|
|
|
|
|
Lepidophyma smithii |
Recorridos |
Vivo |
SA |
LC |
|
B |
|
|
|
|
BOIDAE |
|
|
|
|
|
|
|
|
|
|
Boa imperator |
Trayectos |
Vivo |
SA |
LC |
Apéndice II |
B |
2 |
0 |
2 |
|
COLUBRIDAE |
|
|
|
|
|
|
|
|
|
|
Drymarchon melanurus |
Trayectos |
Vivo |
SA |
LC |
|
B |
0 |
1 |
1 |
|
Drymobius margaritiferus |
Trayectos |
Vivo |
SA |
LC |
|
B |
0 |
1 |
1 |
|
Masticophis mentovarius |
Recorridos |
Muerto |
SA |
LC |
|
B |
|
|
|
|
Leptophis mexicanus |
Trayectos |
Vivo |
SA |
LC |
|
B |
0 |
1 |
1 |
|
Oxybelis koehleri |
Trayectos |
Vivo |
SA |
SR |
|
B |
0 |
1 |
1 |
|
Scaphiodontophis annulatus |
Recorridos |
Muerto |
A |
LC |
|
M |
|
|
|
|
Spilotes pullatus |
Recorridos |
Vivo |
SA |
LC |
|
B |
|
|
|
|
Stenorrhina freminvillei |
Trayectos |
Vivo |
SA |
LC |
|
B |
0 |
1 |
1 |
|
Trimorphodon cuadruplex |
Trayectos |
Vivo |
SA |
SR |
|
B |
0 |
1 |
1 |
|
DIPSADIDAE |
|
|
|
|
|
|
|
|
|
|
Coniophanes fissidens |
Recorridos |
Muerto |
SA |
SR |
|
B |
|
|
|
|
Coniophanes piceivittis |
Trayectos |
Vivo |
SA |
SR |
|
B |
0 |
2 |
2 |
|
Imantodes gemmistratus |
Recorridos |
Muerto |
A |
LC |
|
B |
|
|
|
|
Leptodeira nigrofasciata |
Trayectos |
Vivo |
A |
LC |
|
B |
0 |
1 |
1 |
|
Leptodeira rhombifera |
Trayectos |
Vivo |
SA |
LC |
|
M |
1 |
1 |
2 |
|
Leptodrymus pulcherrimus |
Trayectos |
Vivo |
A |
LC |
|
M |
0 |
1 |
1 |
|
ELAPIDAE |
|
|
|
|
|
|
|
|
|
|
Micrurus nigrocinctus |
Recorridos |
Muerto |
A |
LC |
|
M |
|
|
|
|
LEPTOTYPHLOPIDAE |
|
|
|
|
|
|
|
|
|
|
Epictia phenops |
Trayectos |
Vivo |
SA |
SR |
|
B |
0 |
1 |
1 |
|
LOXOCEMIDADE |
|
|
|
|
|
|
|
|
|
|
Loxocemus bicolor |
Recorridos |
Muerto |
EP |
LC |
Apéndice II |
M |
|
|
|
|
GEOEMIDIDAE |
|
|
|
|
|
|
|
|
|
|
Rhinoclemmys pulcherrima |
Trayectos |
Vivo |
SA |
SR |
|
B |
0 |
1 |
1 |
|
KINOSTERNIDAE |
|
|
|
|
|
|
|
|
|
|
Kinosternon scorpioides |
Trayectos |
Vivo |
SA |
SR |
|
B |
3 |
0 |
3 |
*MARN= Ministerio de Medio Ambiente y Recursos Naturales. A= Amenazada, EP= En Peligro, SA= Sin Amenaza.
**UICN= Unión Internacional para la Conservación de la Flora y Fauna Silvestre. LC= Menor preocupación,
SR= Sin registro en la base de datos
***CITES= Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres.
****CVA= Cálculo de Vulnerabilidad ambiental. B= Vulnerabilidad baja, M= Vulnerabilidad media, A= Vulnerabilidad alta, NE= No evaluado.
TABLA 3
Tamaño corporal de los reptiles atrapados según el sexo y resultados de la prueba de t de Studen. Santiago Nonualco, El Salvador
|
Especie |
Sexo |
LHC (cm) |
t |
GL |
p |
||||
|
n |
Media |
DE |
Min |
Max |
|||||
|
Anolis macrophallus |
Macho |
58 |
4,33 |
0,27 |
3,60 |
5,10 |
-2,83 |
26,60 |
0,00 |
|
Hembra |
13 |
4,16 |
0,17 |
3,70 |
4,50 |
||||
|
Anolis serranoi |
Macho |
61 |
6,61 |
0,50 |
4,40 |
8,00 |
-1,80 |
12,14 |
0,09 |
|
Hembra |
11 |
6,22 |
0,68 |
4,90 |
7,50 |
||||
|
Anolis wellbornae |
Macho |
44 |
4,48 |
0,52 |
3,50 |
6,30 |
-2,27 |
17,20 |
0,03 |
|
Hembra |
9 |
4,17 |
0,33 |
3,50 |
4,50 |
||||
|
Sceloporus squamosus |
Macho |
51 |
4,75 |
0,44 |
3,9 |
5,90 |
-0,17 |
14,03 |
0,83 |
|
Hembra |
12 |
4,72 |
0,59 |
4,10 |
5,60 |
||||
DISCUSIÓN
Con este estudio la fauna de reptiles para el municipio de Santiago Nonualco representa el 35% de los reptiles reportados para El Salvador (103 especies). La riqueza de especies registrada es alta al compararla con otros estudios en la región mesoamericana donde se han muestreado áreas más extensas, hábitats mejores conservados y lapsos más largos (Guerra-Centeno et al., 2014; Aguilar-López et al., 2020; Nahuat-Cervera et al., 2020).
Dado los registros de algunas serpientes en estado muerto y por las condiciones en que fueron encontradas, permite suponer que fueron matados intencionalmente por los pobladores locales, lo cual evidencia el conflicto que existe entre los humanos y estas especies. Estos resultados son consistentes con los reportados en otras investigaciones de otros países donde los registros de ejemplares con cuerpo completo y con cortadura son los más comunes (De la Quintana et al., 2022). Por otra parte, Lync (2012) estimó que en las zonas bajas de Colombia se aniquilan entre 21 y 31 millones de individuos de serpientes cada año. Por lo cual, lo reportado en este estudio puede representar sólo una fracción de los casos que suceden diariamente. La conducta de los humanos hacia ocasionar la muerte intencional de las serpientes está influida por los medios de comunicación, la religión y mitos que acrecientan la propaganda negativa de estas especies (Fernández-Badillo et al., 2021).
Los métodos utilizados para el establecimiento de las categorías de conservación de los reptiles se deben tomar de manera integral como lo realizado en este estudio, ya que sus criterios no son equivalentes y suelen tener deficiencias en el establecimiento de las categorías de conservación. Por ejemplo, para el listado de especies amenazadas del Ministerio de Medio Ambiente y Recursos Naturales se desconocen los criterios usados en las clasificaciones de las especies; algunos estudios identifican un subregistro en el comercio ilegal de reptiles en peligro de extinción, pero varias de esas especies no aparecen en ningún Apéndice de la CITES (D’Cruze & Macdonald, 2016; Jensen et al., 2018; Watters et al., 2022). A nivel global la lista roja de la UICN es la evaluación más conocida y aceptada en los planes de conservación, pero sólo cubre una fracción de los reptiles conocidos, varias evaluaciones están desactualizadas y en ocasiones no considera los cambios taxonómicos recientes (Soares et al., 2022).
Por el contrario, el Cálculo de Vulnerabilidad Ambiental propuesto por Wilson & McCranie (2004) es fácil y rápido calcular, es predictivo y aplicable en cualquier momento a una especie o un taxón superior (Johnson et al., 2015), lo cual explicaría de mejor manera la vulnerabilidad alta y media que obtuvieron algunas especies aquí registradas; además Cadena-Rico et al. (2020) manifiesta que es un método efectivo y superior a los demás porque utiliza criterios medibles y características de la historia natural de los reptiles. Lo anterior permite visualizar que no basta usar un solo método para establecer el estado de conservación de las especies y se vuelve necesario actualizar periódicamente tales estados a fin de que los administradores de fauna tengan herramientas certeras para tomar acciones oportunas de conservación.
Aunque en este estudio se registraron especies con amplia distribución geográfica, esto no les garantiza que sus poblaciones sean estables, ya que algunas como I. iguana y C. similis son sobreexplotadas como fuente de alimento y como producto comercial, las capturas de individuos de estas especies ocurren sin distinción de si son adultas o juveniles, también la recolecta de huevos en estas especies suele ser de forma inapropiada; otras especies como las del género Aspidoscelis aunque se han adaptada a áreas con alta actividad antrópica, pueda que con el tiempo se tenga una baja en la calidad de los sitios de anidación y por ende reducir la sobrevivencia embrionaria y la descendencia (Leyequien-Abarca et al., 2019; Perozo-Díaz et al., 2019; Ramos & Rodríguez, 2019, Hernández-Gallegos et al., 2021).
El registro de mayor cantidad de individuos adultos en casi todas las especies puede ser indicativo de que los subadultos son excluidos del área de distribución de los adultos, al interior de cada especie esto representa una forma de evitar la competencia por el recurso alimentario y microhábitats (Kerr et al., 2005; Sales et al., 2011). Por su parte, Vidal et al. (2002), sugiere que cuando el recurso térmico es limitado, los individuos adultos muestran un comportamiento agresivo y los subadultos tienden a usar sustratos subóptimos, mostrando así una segregación espacial entre clases de edad. Esto sería un patrón común en reptiles y ampliamente estudiado en saurios (Sillero et al., 2018).
Los registros de reptiles mayormente de tamaño mediano demuestran el grado de perturbación del área y están en concordancia con lo reportado por Urbina-Cardona et al. (2006), siendo un patrón que distingue a los paisajes con alta actividad antrópica. El tamaño mediano es óptimo para mantener el equilibrio ecológico y estaría en sintonía con la gran cantidad de presas pequeñas o medianas características de estos ambientes, además no demandan recursos especiales para subsistir (Bernal, 2014). Esto a nivel comunitario representaría una estrategia para facilitar la segregación en el uso del espacio o el alimento (Medina-Rangel & Cárdenas-Árevalo, 2015). En cambio, las especies de tamaño grande, aunque siempre tienden a ser menos abundantes, se les asocia a ambientes conservados y complejos donde los recursos como el alimento les sea factible de conseguir (Lynch, 2012; Jack et al., 2020) y presentan un ámbito hogareño mayor (Morales-Mávil et al., 2001).
Por otra parte, el registro de la proporción de sexos a favor de los individuos machos en la mayoría de las especies evaluadas es un patrón que ha sido encontrado en otros estudios (Pinilla-Renteria et al., 2015; Serrano, 2018). En teoría, la proporción de sexos debe ser uno a uno, o más hembras que machos, pero cuando ocurre lo contrario, como lo registrado en este estudio, puede que se relacione con una ventaja competitiva y que se estimule la competencia entre machos por acceder a un mayor número de hembras logrando así mayor éxito reproductivo (Márquez et al., 2005; Laspiur & Acosta, 2007).
Al haber encontrado que en A. macrophallus y A. wellbornae los machos son más grandes que las hembras, estaría en concordancia con un patrón frecuente en los saurios y ampliamente estudiado en Dactyloidae, Phrynosomatidae y Teiidae (Losos, 2009; Sales et al., 2011; Ramírez-Bautista et al., 2016). El tamaño corporal a favor de los machos se relaciona con una conducta territorial, de cubrir sitios más amplios y ejercer control sobre las hembras que residen dentro de esa área (Losos, 2009). Por el contrario, en ciertos reptiles las hembras necesitan ser más grandes y abundantes por requerimientos de llevar los huevos para así aumentar el éxito reproductivo (Pinilla-Renteria et al., 2015). No obstante, estos resultados se deben tomar con cautela, ya que aspectos metodológicos como el periodo de realización de los muestreos y la no determinación del sexo en varios individuos pudo haber influido en los resultados. Además, la proporción de los sexos tiende a variar entre épocas climáticas y de un año a otro (Marichal & Maure, 2022). Estudios a nivel de especies deberían realizarse considerando métodos específicos para capturar individuos de conducta activa y tomar en cuenta otras variables morfométricas como longitud de la cola, tronco, pata, brazo, entre otras.
Finalmente, para el municipio de Santiago Nonualco este estudio representa las primeras aproximaciones sobre aspectos biológicos de reptiles, y demuestra que la zona tiene potencial para albergar una cantidad alta de especies, entre las que sobresalen 14 especies que requieren atención por presentar alguna categoría de amenaza del MARN (2015), Apéndice II de la CITES (2022) o riesgo según el Cálculo de Vulnerabilidad Ambiental. Eso le confiere a la localidad un alto valor de importancia para la conservación de los remanentes boscosos entre los que sobresalen los bosques riparios y bosque caducifolio, los cuales tienen potencial para albergar a reptiles que demandan recursos del ambiente específicos. Además, se vuelve necesario realizar estudios con más frecuencia con el fin de lograr una mejor interpretación de las respuestas de las especies respecto a la modificación de los ecosistemas boscosos y el uso intensivo del suelo. Esto sería relevante para detectar problemas complejos como la pérdida de diversidad funcional o bien la homogenización biótica del paisaje. De tal forma, la conservación de los reptiles no sólo es para mantener un número determinado de especies, sino también por los procesos asociados de los que forman parte como el papel de presas, depredadores, dispersores de semillas e indicadores de salud de los ecosistemas. Campañas de educación ambiental con énfasis en serpientes deben realizarse con el fin de concientizar a las personas y disminuir significativamente las muertes en estas especies.
AGRADECIMIENTOS
Agradezco a Abel Batista, Joseph Vargas, Oscar Paz Quevedo, Zaidett Barrientos y dos revisores anónimos por la revisión y recomendaciones para mejorar el manuscrito. A la Organización de los Estados Americanos (OEA) por la beca otorgada para cursar los estudios de maestría. A Alfredo Panameño por el apoyo durante la fase de campo. Este trabajo es parte de los requisitos de graduación del programa de Maestría Académica en Manejo de Recursos Naturales con énfasis en Gestión de la Biodiversidad de la Universidad Estatal a Distancia de Costa Rica.
ÉTICA, CONFLICTO DE INTERESES Y DECLARACIÓN DE FINANCIAMIENTO
Declaro/declaramos haber cumplido con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en la preparación de este documento; que no hay conflictos de interés de ningún tipo, y que todas las fuentes financieras se detallan plena y claramente en la sección de agradecimientos. Asimismo, estoy/estamos de acuerdo con la versión editada final de esta publicación. El respectivo documento legal firmado se encuentra en los archivos de la revista.
La declaración de contribución de cada autor es la siguiente: J.N.P.G.: Diseño del estudio, recolección y análisis de datos y preparación del manuscrito.
REFERENCIAS
Agha, M., Ennen, J. R., Nowakowski, A. J., Lovich, J. E., Sweat, S. C., & Todd, B. D. (2018). Macroecological patterns of sexual size dimorphism in turtles of the world. Journal of Evolutionary Biology, 31(3), 336–345. https://doi.org/10.1111/jeb.13223
Aguilar-López, J. L., Ortiz-Lozada, L., Pelayo-Martínez, J., Mota-Vargas, C., Alarcón-Villegas, L. E., & Demeneghi-Calatayud, A. P. (2020). Diversidad y conservación de anfibios y reptiles en un área protegida privada de una región altamente transformada en el sur de Veracruz, México. Acta Zoológica Mexicana, 36, 1–14. https://doi.org/10.21829/azm.2020.3612164
Angarita-Sierra, T. (2014). Diagnosis del estado de conservación del ensamble de anfibios y reptiles presentes en los ecosistemas de sabanas inundables de la cuenca del río Pauto, Casanare, Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 38(146), 53-78.
Benavides-Morera, R., Brenes-Rodríguez, C. L., & Márquez-Artavia, A. (2017). Proporción sexual, relación talla-peso y distribución geográfico-batimétrica de Squalus cubensis (Squaliformes: Squalidae) en la costa Caribe de Centroamérica. Uniciencia, 31(2), 69–84. https://doi.org/10.15359/ru.31-2.5
Bernal, V. A. (2014). Respuestas de los ensambles de anfibios y reptiles a los cambios en el uso de la cobertura del suelo, en localidades del departamento del César, Colombia. [Tesis de maestría, Universidad Nacional de Colombia]. https://bit.ly/3kgbGC4
Böhm, M., Williams, R., Bramhall, H. R., McMillan, K. M., Davidson, A. D., Garcia, A., Bland, L. M. Bielby, J., & Collen, B. (2016). Correlates of extinction risk in squamate reptiles: the relative importance of biology, geography, threat and range size. Global Ecology and Biogeography, 25(4), 391-405. https://doi.org/10.1111/geb.12419
Cadena-Rico, S., Leyte-Manrique, A., & Hernández-Salinas, U. (2020). Herpetofauna de la cuenca baja del río Temascatio, Irapuato, Guanajuato, México. Acta Zoológica Mexicana, 36, 1–14. https://doi.org/10.21829/azm.2020.3612231
Carbajal, A., Guerrero, C. E., & Meléndez, L. N. (2009). Diseño de un plan estratégico de mercadeo para incrementar el desarrollo ecoturístico en el municipio de Santiago Nonualco, departamento de La Paz. [Tesis de Licenciatura, Universidad de El Salvador]. https://ri.ues.edu.sv/id/eprint/9245/1/T-658%20C263d.pdf.
Chichorro, F., Correia, L., & Cardoso, P. (2022). Biological traits interact with human threats to drive extinctions: A modelling study. Ecological Informatics, 69, 101604. https://doi.org/10.1016/j.ecoinf.2022.101604
Convención sobre el Comercio de Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES). (2022). Apéndices I, II y III. https://bit.ly/3Z0ab9y
Costa, G. C., Vitt, L. J., Pianka, E. R., Mesquita, D. O., & Colli, G. R. (2008). Optimal foraging constrains macroecological patterns: body size and dietary niche breadth in lizards. Global Ecology and Biogeography, 17(5), 670-677. https://doi.org/10.1111/j.1466-8238.2008.00405.x
Cuéllar, N. (2006). Informe Nacional El Salvador. https://www.fao.org/3/j2903s/j2903s00.htm#TopOfPage
D'Cruze N., & Macdonald D. W. (2016). Tip of an iceberg: global trends in CITES wildlife confiscations. Nature Conservation, 15, 47-63. https://doi.org/10.3897/natureconservation.15.10005
De la Quintana, P., Seltzer, E., & Aparicio, J. (2022). Registros de serpientes en San Borja (Beni-Bolivia) prevenientes del conflicto humano-serpiente. Revista Latinoamerica de Herpetología, 5(2), 145-153. https://doi.org/10.22201/fc.25942158e.2022.2.375
Doan, T. M. (2016). Plot and transect censuses. In C. K. Dodd Jr. (Ed.), Reptile ecology and conservation: a handbook of techniques (227-240). Oxford University Press.
Fernández-Badillo, L., Zuria, I., Sigala-Rodríguez, J., Sánchez-Rojas, G., & Castañeda-Gaytán, G. (2021). Revisión del conflicto entre los seres humanos y las serpientes en México: origen, mitigación y perspectivas. Animal Biodiversity and Conservation, 44(2), 153-174. https://doi.org/10.32800/abc.2021.44.0153
Guerra-Centeno, D., Morán-Villatoro, D., Fuentes-Rousselin, H., Meoño-Sánchez, E., & Valdez-Sandoval, C. (2014). Riqueza de herpetofauna de la reserva natural privada Los Tarrales, Cuenca del Lago Atitlán, Guatemala. Anales de Biología, 36, 23-31.
Hernández-Gallegos, O., Benitez-Dolores, E., Pérez-Pérez, A., Rosa-Silva, E., Granados-González, G., Méndez-Sánchez, J., & Martín W., J. (2021). Characterization of thermal and hydric condiction of nesting sites of female Aspidoscelis costatus costatus (Squamata: Teiidae). Herpetological Conservation and Biology, 16(1), 95-103.
Heyer, R., Donnelly, M., McDiarmid, R., Hayek, L., & Foster, M. S. (2001). Medición y monitoreo de la diversidad Biológica. Métodos estandarizados para anfibios. Editorial Universitaria de La Patagonia.
Jack, K. M., Brown, M. R., Buehler, M. S., Cheves Hernadez, S., Ferrero Marín, N., Kulick, N. K., & Lieber, S. E. (2020). Cooperative rescue of a juvenile capuchin (Cebus imitator) from a Boa constrictor. Scientific Reports, 10, 16814. https://doi.org/10.1038/s41598-020-73476-4
Jensen, T. J., Auliya, M., Burgess, N. D., Aust, P. W., Pertoldi, C., & Strand, J. (2018). Exploring the international trade in African snakes not listed on CITES: highlighting the role of the internet and social media. Biodiversity and conservation, 28(1), 1-19. https://doi.org/10.1007/s10531-018-1632-9
Johnson, J. D., Mata-Silva, V., & Wilson, L. D. (2015). A conservation reassessment of the Central American herpetofauna based on the EVS measure. Amphibian & Reptile Conservation, 9(2), 1-94.
Kerr, A. M., Powell, R., Parmerlee, J., S., (2005). Ameiva erythrocephala (Teiidae) on Sint Eustatius, Netherlands Antilles: Baseline Data on a Small Population in a Severely Altered Habitat. Carribbean Journal of Science, 41(1), 162-169.
Köhler, G., Veselý, M., & Greenbaum, E. (2006). The amphibians and reptiles of El Salvador. Krieger Publishing Company.
Laspiur, A., & Acosta, J. (2007). Dimorfismo sexual de Liolaemus cuyanus Cei & Scolaro, 1980 (Iguania: Liolaemidae) en una población de San Juan, Argentina Sexual. Revista de Ciencias Biológicas, 16(1), 47–50.
Leyequien-Abarca, L., David Mendoza-Martínez, G., Clemente-Sánchez, F., González-Saldivar, F., Moreno-Casasola, P., & Luis Arcos-García, J. (2019). Abundancia, caracterización y predicción de hábitat de iguana verde (Iguana iguana L. 1758) en la Reserva de la Mancha, Veracruz, México. Tropical and Subtropical Agroecosystems, 22, 537–545.
Liang, T., Meiri, S., & Shi, L. (2021). Sexual size dimorphism in lizards: Rensch's rule, reproductive mode, clutch size, and line fitting method effects. Integrative zoology, 17(5), 787–803. https://doi.org/10.1111/1749-4877.12569
Losos, J. B. (2011). Lizards in an evolutionary tree: ecology and adaptive radiation of anoles. University of California Press.
Lu, H. L., Gao, J. F., Guo, K., & Ji, X. (2022). Sexual size monomorphism may evolve in lizards with a body size maximizing reproductive performance for both sexes. Current Zoology, zoac033, https://doi.org/10.1093/cz/zoac033
Lynch, J. D. (2012). El contexto de las serpientes de Colombia con un análisis de las amenazas en contra de su conservación. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 36(140), 435-449.
Marichal, E., & Maure, K. (2022). Reptiles terrestres del archipiélago de los Jardines de la Reina, Cuba. Novitates Caribaea, 20, 123–136.
Márquez, C., Mora, J. M., Bolaños, F., & Rea, S. (2005). Aspectos de la biología poblaciones en el campo de Anolis aquaticus, Sauria: Polychridae en Costa Rica. Ecología Aplicada, 4(1–2), 59–69.
Medina-Rangel, G. F., & Cárdenas-Árevalo, G. (2015). Relaciones espaciales y alimenticias del ensamblaje de reptiles del complejo cenagoso de Zapatosa, departamento del Cesar (Colombia). Papéis Avulsos de Zoologia, 55(10), 143-165. http://dx.doi.org/10.1590/0031-1049.2015.55.10
Miatta, M., Bates, A. E., & Snelgrove, P. V. (2021). Incorporating biological traits into conservation strategies. Annual Review of Marine Science, 13(1), 421-443.
Ministerio de Medio Ambiente y Recursos Naturales (MARN). (2015). Listado oficial de especies de vida silvestre amenazadas o en peligro de extinción. https://bit.ly/3xIJkDj
Ministerio de Medio Ambiente y Recursos Naturales (MARN). (2018). Listado de fauna silvestre registrada para El Salvador. https://bit.ly/3Z6RAJi
Morales-Mávil, J. E., Hernández-González, M., & Bravo-Méndez, O. (2001). Biomasa de reptiles en un borde de selva de la región de Los Tuxtlas, Veracruz, México. Foresta Veracruzana, 3(2), 25-30.
Moya-Robledo, J. (2016). Anuros del gradiente altitudinal bosque altoandino-subpáramo en un sector de los Farallones del Citará. Bioetnia, 13(1), 6-15.
Nahuat-Cervera, P., Hernández-Bentancourt, S., & Díaz-Gamboa, L. (2020). Anfibios y reptiles del Centro Educativo Hobonil, Tzacacab, Yucatán, México. Revista Latinoamerica de Herpetología, 3(1), 53–65.
Perozo-Díaz, I., Rojas-Cañizales, D., Espinoza-Rodríguez, N., & Barrios-Garrido, H. (2019). Tráfico ilegal de fauna silvestre en las principales carreteras del noroccidente de Venezuela. Ciencia, 27(1), 14-23.
Pinilla-Renteria, E., Rengifo-Mosquera, J. T., & Salas Londoño, J. (2015). Dimorfismo, uso de hábitat y dieta de Anolis maculiventris (Lacertilia: Dactyloidae), en bosque pluvial tropical del Chocó, Colombia. Acta Biológica Colombiana, 20(1), 89–100. https://doi.org/10.15446/abc.v20n1.39109
R Core Team. (2020). R: A Language and Environment for Statistical Computing.
Ramírez-Bautista, A., Hernández-Salinas, U., Cruz-Elizalde, R., Lozano, A., & Rodríguez-Romero, F. D. J. (2016). Sexual dimorphism and reproductive traits over time in Sceloporus aeneus (Squamata: Phrynosomatidae), based on a population in the Transmexican Volcanic Belt, Mexico. Salamandra, 52(2), 197-203.
Ramos, E., & Rodríguez. C., N. (2019). ¿Comer Iguana Verde? Antropología, Arqueología, Biología de la Conservación y Etnobiología: Distintas Miradas a Un Mismo Problema. Revista Etnobiología, 17(2), 55–75.
Rengifo, M. Y., Rengifo, J. T., & Serna, J. E. (2021). Diversidad de Anolis (Lacertilia: Dactyloidae) en bosque pluvial tropical, del Chocó-Colombia. Revista colombiana de Ciencia Animal, 13(1), 27-36. https://doi.org/10.24188/recia.v13.n1.2021.729
Rentería, L., Cuesta, E., Bonilla, N., & Guerra, J. (2013). Percepción, etimología y uso de la herpetofauna en una comunidad Embera-Dobida, en el Pacífico colombiano. Bioetnia, 10(1), 5-10.
Sales, R. F., Ribeiro, L. B., & Freire, E. M. (2011). Feeding ecology of Ameiva ameiva in a caatinga area of northeastern Brazil. The Herpetological Journal, 21(3), 199-207.
Serrano, J. (2018). La condición física del lagarto Anolis cupreus (Squamata: Dactyloidae) y su relación con la estructura del hábitat durante la estación seca. Cuadernos de Herpetología, 32(2), 119–121. https://doi.org/10.31017/cdh.2018.(2018-014)
Sillero, N., Argaña, E., Freitas, S., García-Muñoz, E., Arakelyan, M., Corti, C., & Carretero, M. (2018). Short term spatial structure of a lizard (Darevskia sp.) community in Armenia. Acta Herpetologica, 13(2), 155-163. https://doi.org/10.13128/Acta_Herpetol-22830
Soares, N., Gonçalves, J. F., Vasconcelos, R., & Ribeiro, R. P. (2022). Combining Multiple Data Sources to Predict IUCN Conservation Status of Reptiles. In Bouadi, T., Fromont, E., Hüllermeier, E. (eds) Advances in Intelligent Data Analysis XX. IDA 2022. Lecture Notes in Computer Science, vol 13205. Springer, Cham. https://doi.org/10.1007/978-3-031-01333-1_24
Uetz, P., & Hallermann, J. (2022). El Salvador. The Reptile Database. https://bit.ly/3EmFvYa
Unión Internacional para la Conservación de la Naturaleza (UICN). (2022). Lista roja de especies amenazadas. https://www.iucnredlist.org/es
Urbina-Cardona, J. N., Olivares-Pérez, M., & Reynoso, V. H. (2006). Herpetofauna diversity and microenvironment correlates across a pasture-edge-interior ecotone in tropical rainforest fragments in the Los Tuxtlas Biosphere Reserve of Veracruz, Mexico. Biological Conservation, 132(1), 61–75. https://doi.org/10.1016/j.biocon.2006.03.014
Velasco, J. A., Villalobos, F., Diniz‐Filho, J. A., Poe, S., & Flores‐Villela, O. (2020). Macroecology and macroevolution of body size in Anolis lizards. Ecography, 43(6), 812-822. https://doi.org/10.1111/ecog.04583
Vidal, M., Ortiz, J. C., & Labra, A. (2002). Sexual and age differences in ecological variables of the lizard Microlophus atacamensis (Tropiduridae) from northern Chile. Revista Chilena de Historia Natural, 75(2), 283-292.
Vitt, L., & Caldwell, J. (2014). Herpetology: An introductory biology of amphibians and reptiles (Cuarta ed.). Academic Press.
Warner, D. A., & Shine, R. (2007). Fitness of juvenile lizards depends on seasonal of hatching, not offspring body size. Oecologia, 154, 65-73. https://doi.org/10.1007/s00442-007-0809-9
Watters, F., Stringham, O., Shepherd, C. R., & Cassey, P. (2022). The U.S. market for imported wildlife not listed in the CITES multilateral treaty. Conservation Biology, 36(6), e13978. https://doi.org/10.1111/cobi.13978
Weber, W. D., Anthony, N. M., & Lailvaux, S. P. (2021). Size but not relatedness drives the spatial distribution of males within an urban population of Anolis carolinensis lizards. Ecology and evolution, 11(6), 2886-2898. https://doi.org/10.1002/ece3.7248
Wilson, L. D., & McCranie, J. R. (2004). The conservation status of the herpetofauna of Honduras. Amphibian and Reptile Conservation, 3(1), 6–33. https://doi.org/10.1514/journal.arc.0000012
APÉNDICE
Apéndice 1. Detalle del Cálculo de Vulnerabilidad Ambiental para la obtención del estado de conservación de reptiles (Johnson et al., 2015).
|
Categoría |
Ítem |
Puntaje |
|
Distribución geográfica |
Distribución geográfica muy amplia, dentro y fuera de la región centroamericana |
1 |
|
La mayor parte del rango está fuera de América Central |
2 |
|
|
La mayor parte del rango se encuentra dentro de América Central |
3 |
|
|
Distribución limitada tanto dentro como fuera de América Central, la mayor parte del rango es marginal a áreas cercanas a la frontera de América Central y México o América del Sur, respectivamente |
4 |
|
|
Distribución restringida a Centroamérica, pero no a una localidad específica |
5 |
|
|
Distribución limitada a un sector en específico del área centroamericana |
6 |
|
|
Distribución ecológica |
Ocurrencia en ocho o más formaciones vegetales |
1 |
|
Ocurrencia en siete formaciones vegetales |
2 |
|
|
Ocurrencia en seis formaciones vegetales |
3 |
|
|
Ocurrencia en cinco formaciones vegetales |
4 |
|
|
Ocurrencia en cuatro formaciones vegetales |
5 |
|
|
Ocurrencia en tres formaciones vegetales |
6 |
|
|
Ocurrencia en dos formaciones vegetales |
7 |
|
|
Ocurrencia en una formación vegetal |
8 |
|
|
Grado de persecución de los reptiles |
Fosoriales, por lo general escapan a la atención humana |
1 |
|
Semifosoriales, o nocturnas arborícolas o acuáticas, no venenosas y generalmente no miméticas, a veces escapan a la atención humana |
2 |
|
|
Terrestres y/o arborícolas o acuáticas, generalmente ignorado por los humanos |
3 |
|
|
Terrestres y/o arborícolas o acuáticas, que se cree que son dañinos, pueden ser asesinadas |
4 |
|
|
Especies venenosas o imitaciones de las mismas, asesinadas inmediatamente |
5 |
|
|
Explotados para el comercio de pieles, carnes, huevos o animales de compañía |
6 |
Apéndice 2. Serpientes muertas registradas mediante los recorridos por la calle principal del área de estudio. Santiago Nonualco. El Salvador. Loxocemus bicolor (A), Masticophis mentovarius (B), Micrurus nigrocinctus (C), Imantodes gemmistratus (D), Coniophanes fissidens (E), Scaphiodontophis annulatus (F).

Apéndice 3. Ejemplares (adultos) de individuos machos y hembras en algunas especies de reptiles registradas en los trayectos de muestreo. Santiago Nonualco, El Salvador. Anolis macrophallus (A, parte superior individuo macho mostrando la barba gular, nótese la prominencia de los hemipenes; parte inferior un individuo hembra con la región abdominal más robusta y cuerpo con diferente coloración), Hemidactylus frenatus (B, hembra, ausencia de protuberancia de los hemipenes), Basiliscus vittatus (C, macho, nótese la cresta dorsal en la cabeza), B. vittatus (D, hembra, cresta ausente), Gonatodes albogularis (E, macho, cabeza color naranja), G. albogularis (F, hembra).
