
Composición espacial y temporal de aves acuáticas y rapaces en humedales del centro de México
Héctor
Cayetano-Rosas1![]() Montserrat
Ramírez Hernández2,3
Montserrat
Ramírez Hernández2,3![]() , J. Oswaldo Gómez-Garduño1
, J. Oswaldo Gómez-Garduño1![]() , Neptalí
Piñón Santoyo2,3
, Neptalí
Piñón Santoyo2,3![]() , Rogelio
Bautista-Trejo1
, Rogelio
Bautista-Trejo1![]() ,
Juan Gerardo Valverde Nieto2,3
,
Juan Gerardo Valverde Nieto2,3 ![]() & Jorge E.
Ramírez-Albores4
& Jorge E.
Ramírez-Albores4![]()
1. Consultores en Sistemas Terrestres Ecológicos S.A. de C.V. (CONSISTE), Santa Mónica 244, Col. Vicente Villada, Nezahualcóyotl, Estado de México. C.P. 57720, México; hectorcayana@gmail.com; rogerbautis@yahoo.com.mx; joswalgom@hotmail.com
2. Secretaría de Medio Ambiente, Coordinación General de Conservación Ecológica, Gobierno del Estado de México. Gustavo Baz Prada 2160, 2º. piso, Edif. Ericsson, Col. La Loma, Tlalnepantla, Estado de México. C.P. 54060. México; montserratramirezhdz@gmail.com; neptalipisan@yahoo.com.mx; jgvalverde.sma@edomex.gob.mx; particularcgce@edomex.gob.mx
3. Parque Estatal Ecológico, Turístico y Recreativo Sierra Hermosa, Carr. Federal Pachuca-México km. 36.5, Tecámac de Felipe Villanueva, Estado de México, México.
4. Universidad Autónoma Agraria Antonio Narro, Departamento de Botánica, Saltillo, C.P. 25315, México; jorgeramirez22@hotmail.com
Recibido 23-IX-2022 □ Corregido 1-II-2023 □ Aceptado 15-II-2023
DOI: https://doi.org/10.22458/urj.v15i1.4382
|
ABSTRACT. “Spatial and temporal composition of aquatic birds and raptors in wetlands of central Mexico”. Introduction: Wetlands play an important role as habitats for various groups of birds, particularly those with aquatic habits. Despite their high biodiversity, in Mexico there are few studies on the composition and dynamics of bird assemblages in these wetlands. Objective: To evaluate the spatial and temporal dynamics of the aquatic bird and raptor community in wetlands. Methods: To characterize waterfowl and raptors, transects of variable distance were checked monthly from November 2019 to February 2022 in wetlands located in the Metropolitan Zone of Mexico City. Results: We counted 105 bird species. The highest values of diversity were in Laguna de Zumpango (91 species) and Lake Nabor Carrillo (91). Most of these species are migratory (63%), while 30% are residents, and 7% are introduced. Significant spatial and temporal differences (p<0,05) were found in the composition of the bird community. Conclusion: The highest diversity was in Zumpango and Nabor, and most species are migratory.
Keywords: Avifauna, species richness, urbanization, Valley of Mexico, waterbodies.
|
RESUMEN. Introducción: Los humedales cumplen una importante función ecológica como hábitats para diversos grupos de aves, en específico las de hábitos acuáticos. A pesar de su alta diversidad, en México existen escasos estudios sobre la composición y dinámica de la comunidad de aves en humedales. Objetivo: evaluar la dinámica espacial y temporal de la comunidad de aves acuáticas y rapaces en humedales. Métodos: para caracterizar las aves acuáticas y rapaces se realizaron transectos de distancia variable mensualmente durante noviembre de 2019 a febrero de 2022 humedales ubicados en la Zona Metropolitana de la Ciudad de México. Resultados: se registraron un total de 105 especies de aves. Los valores más altos de diversidad se encontraron en la Laguna de Zumpango (91 especies) y en el Lago Nabor Carrillo (91). La mayoría de estas especies son migratorias (63%), mientras que 30% son residentes, y 7% son introducidas. Se encontraron diferencias espaciales y temporales significativas (p<0,05) en la composición de la comunidad de aves. Conclusión: La mayor diversidad fue en Zumpango y Nabor Carrillo, y la mayoría fueron especies migratorias.
Palabras clave: Avifauna, cuerpos de agua, riqueza de especies, urbanización, Valle de México.
|
Los humedales constituyen uno de los hábitats que contienen una gran biodiversidad, que resultan prescindibles para el mantenimiento de la estructura y el funcionamiento de estos ecosistemas (Bobbink et al., 2006). Sin embargo, muchas de ellas se ven actualmente amenazadas como consecuencia de las numerosas actividades antropogénicas que provocan la degradación y pérdida de la biodiversidad (Millenium Ecosystem Assessment, 2005). Las aves constituyen uno de los grupos más característicos y clave de la biota que habita en los humedales (Gatto et al., 2005; Elliot et al., 2020). Diversas aves pueden hacer uso de dichos humedales de forma permanente o temporal para cumplir una determinada etapa de su ciclo de vida (e.g., alimentación, nidificación, reproducción, entre otras) y estos ambientes representan sitios importantes albergando altas concentraciones durante la migración anual (Wetlands International, 2018). En estos ecosistemas, podemos encontrar dos grupos de aves con funciones ecológicas importantes, las acuáticas como consumidoras, contribuidoras de materia orgánica y modificadoras del ambiente circundante; y las rapaces (o de presa), que son un grupo esencial para mantener el equilibrio en las comunidades, dada su posición tope en la cadena trófica (Rodríguez-Estrella et al., 1998; Vázquez-Pérez et al., 2009). Ambos grupos de aves tienen una alta sensibilidad a la perturbación antrópica y a cambios climáticos en el ambiente que permite que sean utilizadas como especies indicadoras de la calidad y salud del hábitat (Rodríguez-Estrella et al., 1998; Carrete et al., 2009).
Las diversas actividades antrópicas afectan y ponen en riesgo la conservación de la biota en un ecosistema, por ello es fundamental el estudio de éstas en sitios prioritarios para proponer estrategias de manejo y conservación. Por ejemplo, el rápido crecimiento poblacional y los procesos de migración masiva hacia la ciudad han acelerado la urbanización y reducido significativamente los sitios de refugio y de alimentación para muchas aves dentro y cercanos a ambientes urbanos (McDonnell & MacGregor-Fors, 2016). Esto trae como consecuencia una perdida en la biodiversidad al disminuir la cobertura vegetal (Marzluff, 2005; Aronson et al., 2014). Además, la urbanización incrementa la contaminación ambiental y la presencia humana (Isaksson, 2018), lo que provoca que las poblaciones de aves en estos ambientes se aíslen, disminuyan, o se extirpen localmente (Ramírez-Bastida et al., 2008; De Gortari-Ludlow et al., 2015). Sin embargo, la pérdida del hábitat ha sido compensada, al menos en parte, por la creación de nuevos ambientes alternativos para la biota como lo son los humedales artificiales (Isaksson, 2018).
La importancia de estos reservorios depende en gran medida de la variedad y disponibilidad de los recursos (Jankowski et al., 2009; Ayala-Pérez et al., 2013). Por tal motivo, la generación de información sobre el uso de los humedales por las aves puede ser un elemento importante para el establecimiento de estrategias de manejo y conservación de estos ecosistemas. Sin embargo, la información orientada sobre el estado de conservación de los humedales de México y a caracterizar las comunidades de aves es aún deficiente (Ayala-Pérez et al., 2013; Ramírez-Albores & Pérez-Suárez, 2019). Recientemente, estos ambientes han sufrido un acelerado deterioro, lo que demanda acciones urgentes de conservación para revertir esta situación (Ramírez-Bastida et al., 2008; De Gortari-Ludlow et al., 2015). El presente trabajo cubre un vacío de información existente en el tema y en la región aportando información base útil para el conocimiento, conservación y manejo de los recursos naturales en el área. Para ello, describimos los patrones de cambio en la estructura de la comunidad de aves acuáticas y de rapaces en cuatro humedales ubicados dentro de la Zona Metropolitana de la Ciudad de México (ZMCM) en el centro de México, entre noviembre de 2019 a febrero de 2022, evaluamos las diferencias entre periodos del año (i.e., meses), en función de la composición de la comunidad de aves acuáticas y rapaces.
MATERIALES Y MÉTODOS
Área de estudio: La Zona Metropolitana de la Ciudad de México se ubica en la provincia biótica denominada Eje Neovolcánico Transversal, en el centro de México (19°25' N, 99°07' O). La ZMCM es considerada una de las seis megalópolis más grandes del mundo (United Nations, 2018). Esta megalópolis tiene una superficie de 7 954km2 y abarca 16 alcaldías que integran a la Ciudad de México, 59 municipios adyacentes del Estado de México y un municipio del Estado de Hidalgo. El rápido crecimiento poblacional de esta megalópolis actualmente es mayor a los 21 millones de habitantes (más de 2559,8hab/km2) (Instituto Nacional de Geografía y Estadística [INEGI], 2010). Lo anterior ha provocado la pérdida y transformación de los hábitats originales, a pesar de ser considerada como una región con una alta biodiversidad. La altitud común en toda la ZMCM es de 2 240m.s.n.m., pero aumenta ligeramente desde el centro de la ciudad hacia las zonas sur y oeste, que están rodeadas por altas montañas. Presenta valles intermontanos, mesetas y quebradas, así como tierras semiplanas. Los pastizales y los matorrales semidesérticos son la vegetación dominante en el norte y el este, mientras que las tierras bajas del sureste están dominadas por campos agrícolas; los bosques de encino, pino y abeto están presentes en áreas relativamente grandes en el sur, este y oeste de la ciudad (Instituto Nacional de Geografía y Estadística [INEGI], 2001). Sin embargo, la transformación de los ecosistemas naturales originales en el área que actualmente ocupa la ZMCM ha creado un sistema altamente heterogéneo con diferentes usos de suelo, quedando como remanente un 34% de vegetación natural (Sorani et al., 2016). En la ZMCM ubicamos cuatro humedales (Fig. 1):
1) Laguna de Zumpango (19°47'00'' N, 99°08'16'' O a 2 250m.s.n.m.) se ubica al norte de la ZMCM con una superficie de 1 860ha, una periferia de 18km y una capacidad máxima de almacenamiento de 100 millones de m3. Se encuentra rodeada por zonas urbanas, carreteras, zona industrial, vegetación arbolada (Eucalyptus sp., Schinus molle, Casuarina equisetifolia, Salix sp, entre otros), matorral xerófilo (Prosopis juliflora, Opuntia sp., Mimosa biuncifera entre otras), chaparral, pastizales y cultivos. Esta laguna ha sufrido un proceso de desecación por la acelerada urbanización. El agua es usada para riego agrícola (Instituto Mexicano de Tecnología del Agua [IMTA], 2012).
2) Lago de Guadalupe (19°38'03'' Norte, 99°15'16'' Oeste a 2 305m.s.n.m.) es un embalse que se localiza al noroeste de la ZMCM con una extensión aproximada de 450ha y una profundidad máxima cercana a los 40m. Se encuentra rodeado por zonas urbanas, vegetación arbolada (Eucalyptus sp., Schinus molle, Casuarina equisetifolia, Salix sp, Quercus sp., Juniperus sp., Pinus sp., Taxodium sp., Fraxinus sp., entre otras), cultivos y un campo de golf.
3) Lago Nabor Carrillo (19°27'17'' N, 98°58'17'' O a 2 235m.s.n.m.) ubicado al noreste de la ZMCM, en la zona federal del ex-vaso de Texcoco en el Estado de México. Presenta vegetación acuática o hidrofílica representada por pastizales halófitos. La zona federal del lago recibe los escurrimientos de las partes oriente, poniente y sur de la ZMCM.
4) Parque Estatal Ecológico, Turístico y Recreativo Sierra Hermosa y áreas adyacentes (19°42'37'' N, 99°01'05'' O a 2245m.s.n.m.) se ubica al noreste de la ZMCM, en el municipio de Tecámac, Estado de México. Tiene una superficie de 572,6ha y se compone de dos cuerpos de agua permanentes (3,70 y de 2,43has) y dos semipermanentes rodeados de escasa vegetación halófita y tulares, zonas recreativas, edificaciones abandonadas, pastizales inducidos y zonas arboladas inducidas. La vegetación se compone por una escasa presencia de árboles (Schinus molle, Eucalyptus sp., Cinnamomum canphora, Casuarina equisetifolia, Ficus sp., Castilla elastica, Jacaranda mimosifolia entre otras); los valles están representados por pastizales inducidos y cultivos de maíz, nopal y zacatonales forrajeros. Se encuentra rodeado por zonas urbanas, un aeropuerto internacional y cultivos de maíz, cebada, trigo y frijol.
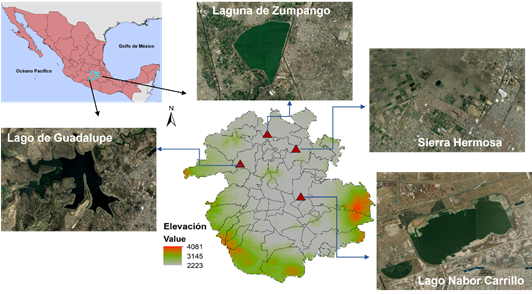
Fig. 1. Localización geográfica de los sitios de muestreo en la Zona Metropolitana de la Ciudad de México, México
Estos humedales presentan un alto nivel de contaminación dada la descarga constante de aguas sin tratamiento por el aporte urbano, agrícola e industrial, ya que varios parámetros rebasan los límites establecidos por la normatividad vigente en materia de la calidad del agua.
Muestreo de aves: El muestreo se efectuó mediante observación visual directa durante cuatro recorridos fijos en cada sitio realizados durante noviembre de 2019 a febrero de 2022. Cada sitio fue visitado una vez al mes, representando un total de 112 días de trabajo de campo. Los recorridos tuvieron una duración mínima aproximada de tres horas cada uno, en un horario entre 07:00 a 13:00h. Las observaciones se realizaron con binoculares Bushnell 10 × 45mm, Carson 3D ED 10 × 42mm y Eagle Optics 10 × 50mm; además se tomaron fotografías con cámaras Nikon D3500, Sony DSC H300, Nikon P1000 y Nikon Coolpix P520. La identificación de las especies se basó en las guías de campo de Peterson y Chalif (1989), Dunn y Alderfer (2008) y Sibley (2014). De acuerdo con su presencia estacional clasificamos a las especies en residente y en migratorias (que incluye a visitantes de invierno, residentes de verano y transitorias) (Howell & Webb, 1995). El estado de conservación de cada especie se basó en la Norma Oficial Mexicana (NOM-059-SEMARNAT-2010) (Secretaría de Medio Ambiente y Recursos Naturales [SEMARNAT], 2010) y en la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza (International Union for Conservation of Nature [IUCN], 2021). Los nombres comunes de las aves se basaron en la propuesta de Berlanga et al. (2019). La nomenclatura científica y el orden sistemático son los establecidos por la American Ornithologists´Union y suplementos posteriores (Chesser et al., 2021).
Análisis de datos: Para evaluar la eficiencia del muestreo y si este fue suficiente utilizamos los estimadores no paramétricos de Jackknife 1 y Chao 2 con EstimateS 9.1.0 (Colwell, 2018), ya que son dos de los estimadores con menos sesgo (Colwell & Coddington, 1995). Estos estimadores basan su cálculo en datos de incidencia y toman en cuenta la distribución de las especies entre las muestras, además, de considerar a las especies observadas en exactamente una y dos unidades de muestreo (Moreno, 2001). La diversidad de especies se calculó con el índice de Shannon (Magurran, 2004). Se utilizó una prueba de independencia χ2 (Siegel & Castellan, 1988), en las que se evaluó diferencias en las proporciones de especies compartidas entre los meses y por sitio de muestreo (α=0,05). Realizamos un análisis de escalamiento multidimensional no métrico (nMDS) para extraer patrones de composición de especies entre meses. Posteriormente, se evaluó el grado de similitud en la composición de especie entre los sitios de muestreo y los meses de monitoreo, esta se estimó usando el índice de similitud de Bray-Curtis en BiodiversityPro 2.0 (McAleece et al., 1997), que considera en conjunto datos de presencia-ausencia (Clarke & Warwick, 2001). Este índice toma valores de 0 (ninguna especie en común) y 1 (las muestras son idénticas).
RESULTADOS
Se registró un total de 105 especies de 17 familias y 11 órdenes y con una abundancia promedio de 25 042ind/mes (Apéndice 1). La familia que presentó el mayor número de especies fue Scolopacidae (21 especies), seguida de Anatidae (20) y Accipitridae (12). Con base a los estimadores de diversidad, se determinó que se identificó entre 94,8% (Jackkniffe 1) y 98,2% (Chao 2) del total de aves acuáticas y rapaces; y entre 90,6% (Jackkniffe 1) y 98,6% (Chao 2) para los humedales de muestreo (Tabla 1, Fig. 2).
TABLA 1
Riqueza de especies observada y estimada en los sitios de muestreo en la Zona Metropolitana de la Ciudad de México, México.
|
|
Sitios de muestreo |
||||
|
Total |
Laguna de Zumpango |
Lago Nabor Carrillo |
Lago de Guadalupe |
Sierra Hermosa |
|
|
Especies observadas |
105 |
91 |
91 |
65 |
67 |
|
Especies estimadas (Chao 2) |
106,86 |
94,52 |
92,3 |
68,38 |
67,21 |
|
Completitud del muestreo |
98,2% |
96,2% |
98,6% |
95,0% |
99,8% |
|
Especies estimadas (Jackknife 1) |
110,71 |
99,54 |
97,61 |
71,75 |
69,82 |
|
Completitud del muestreo |
94,8% |
91,4% |
93,2% |
90,6% |
95,9% |
Los humedales con mayor riqueza de especies fueron Laguna de Zumpango (91 especies) y Lago Nabor Carrillo (91), seguidos por Sierra Hermosa (66) y Lago de Guadalupe (65) (Fig. 3). De manera general, los meses donde se registró la mayor riqueza de especies fue de noviembre a febrero, mientras los meses de menor riqueza de especies fue de mayo a agosto. Lo anterior coincide con la llegada y establecimiento de las aves migratorias y con la partida de estas mismos, respectivamente. La mayor riqueza de aves acuáticas se presentó en el mes de marzo del 2021 (56 especies) y de rapaces en enero del 2021, septiembre del 2021 y enero de 2022 con 17 especies registradas en cada mes (Fig. 3); mientras que la menor riqueza de aves acuáticas se presentó en noviembre del 2019 con 28 especies y de rapaces fue en mayo del 2020 con cinco especies. Por mes de muestro, la mayor abundancia de aves se registró entre septiembre a febrero (Fig. 3). Por el contrario, de mayo a agosto se presentó la menor abundancia (Fig. 3). Estacionalmente hubo diferencias en la riqueza de especies (χ2=22,6, p<0,001), abundancia (χ2=31,1, p<0,001) y diversidad de especies (χ2=29,4, p<0,001) a lo largo de los meses de muestreo. Este mismo comportamiento se presentó en cada humedal de muestreo (p<0,001). El índice de diversidad de Shannon vario significativamente, siendo entre noviembre a febrero los meses con los valores más altos (Fig. 3); mientras que de julio a octubre se registraron valores relativamente bajos de diversidad. Lo que se podría deber, a la presencia de grandes números de Anátidos y Charadriidos en estos humedales.
Las especies más abundantes a lo largo del periodo de muestreo fueron Spatula clypeata, S. discors, Fulica americana, Oxyura jamaicensis, Himantopus mexicanus, Recurvirostra americana, Plegdis chihi, Bubulcus ibis, y Charadrius vociferus, así como algunas rapaces como Cathartes aura. Entre las especies menos abundantes (n=29; registrando menos de cinco individuos) podemos mencionar a Aechmophorus occidentalis, Bartramia longicauda, Botaurus lentiginosus, Calidris alba, Limnodromus griseus, Rallus tenuirostris y Glaucidium gnoma. Por mes de muestreo, existió una variación en las abundancias de las especies, por ejemplo, Spatula clypeata (χ2=25,8, p<0,001), Spatula discors (χ2=23,1, p<0,001), Fulica americana (χ2=25,2, p<0,001), Oxyura jamaicensis (χ2=26,7, p<0,001), Himantopus mexicanus (χ2=22,9, p<0,001) y Recurvirostra americana (χ2=20,2, p<0,001). Solamente 13 especies fueron exclusivas a los sitios de muestreo, como Buteo brachyurus, Calidris alba, Limosa haemastica, Numenius americanus y Sterna hirundo (Apéndice 1). Por el contrario, 45 especies fueron comunes en todos los sitios, como Anas acuta, Spatula cyanoptera, Ardea alba, Mareca americana, Buteo swainsoni y Circus hudsonius (Apéndice 1). Se identificaron 32 especies residentes, 66 migratorias y siete especies introducidas (e.g., Anser anser, Cairina moschata) (Apéndice 1). Por otra parte, se registraron dos especies en estatus de casi amenazada dentro de la IUCN: Charadrius nivosus y Rallus tenuirostris; y seis especies se enlistan con estatus de protección especial y tres como amenazadas considerando la NOM-059-SEMARNAT para México (Apéndice 1). Además, se registraron dos especies endémicas de México, Anas diazi y Rallus tenuirostris (Apéndice 1). Dentro de las especies registradas, destacó la presencia de varias especies con actividad reproductiva (i.e., cortejo, nidificando, presencia de polluelos), tales como Fulica americana (polluelos, juveniles), Himantopus mexicanus (nidos, polluelos, juveniles), Recurvirostra americana (nidos, polluelos, juveniles), Charadrius vociferus (polluelos, juveniles), Anas diazi (polluelos, juveniles), Oxyura jamaicensis (polluelos, juveniles), Gallinula galeata (polluelos, juveniles), Podilymbus podiceps (polluelos, juveniles), Podiceps nigricollis (polluelos), Elanus leucurus (nidos, polluelos, juveniles), Buteo jamaicensis (nidos y polluelos), Accipiter cooperi (nidos y polluelos), Parabuteo unicinctus (juveniles), Aechmophorus clarkii (polluelos, juveniles), Bubulcus ibis (nidos, polluelos, juveniles), Nycticorax nycticorax (juveniles), Spatula discors (polluelos), Nannopterum brasilianum (juveniles), Plegadis chihi (juveniles) y Spatula clypeata (polluelos, juveniles), las cuales fueron observadas con esta actividad en varias ocasiones a lo largo del periodo de muestreo.
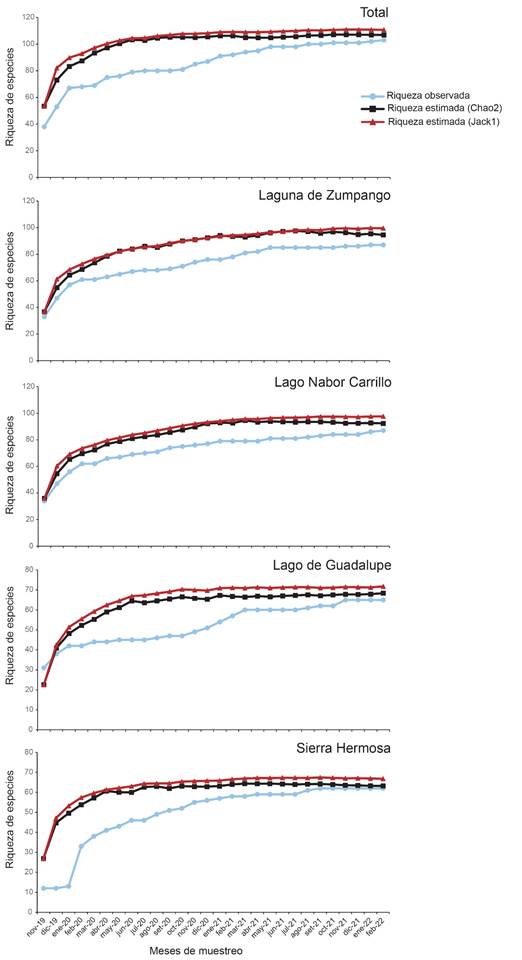
Fig. 2. Curva de acumulación de las especies de aves acuáticas y rapaces registradas en los sitios de muestreo en la Zona Metropolitana de la Ciudad de México, México.
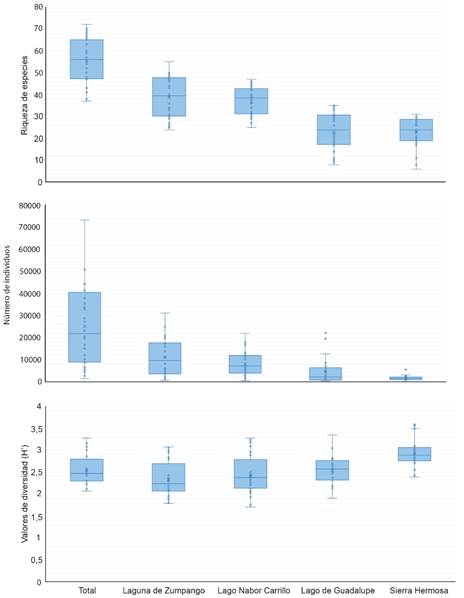
Fig. 3. Variación temporal de la riqueza de especies, abundancia (número de individuos) y diversidad (H´) en los sitios de muestreo en la Zona Metropolitana de la Ciudad de México, México.
El primer y segundo eje de nMDS explicaron el 66% y el 29% de la variación para los meses. Observando un fuerte gradiente de composición de especies entre meses (Fig. 4). En cuanto al índice de Bray-Curtis, la mayor similitud se encontró entre Laguna de Zumpango-Lago Nabor Carrillo (89,01%), seguida por Laguna de Zumpango-Sierra Hermosa (80,25%), Lago Nabor Carrillo-Sierra Hermosa (80,25%), Laguna de Zumpango-Lago de Guadalupe (76,92%), Lago de Guadalupe-Sierra Hermosa (73,28%), y encontrando la similitud más baja entre Lago Nabor Carrillo-Lago de Guadalupe (69,23%) (Fig. 5). Por otra parte, se encontraron diferencias entre la composición de aves para los meses de muestreo (Fig. 6), dado que mostraron porcentajes altos entre combinaciones como febrero del 2020-marzo del 2020, noviembre del 2021-diciembre del 2021 (93%), enero del 2020-febrero del 2020 (91%) y noviembre del 2021-enero del 2022 (91%) con una similitud del 92% en cada combinación; mientras que se encontró una baja similitud entre noviembre del 2019-junio del 2020 (52%) y entre noviembre del 2019-julio del 2020 (51%) (Fig. 6). De la misma forma, el índice de Bray-Curtis para los humedales de muestreo también se identificaron diferencias, los porcentajes más altos se presentaron en las combinaciones de diciembre del 2021-enero del 2022, noviembre del 2021-enero del 2022, diciembre del 2020-enero del 2021 con una similitud del ≥89% en cada combinación (Fig. 6); mientras que se encontró una similitud relativamente baja (≤45%) entre noviembre del 2019-junio del 2020, noviembre del 2019-julio del 2020, diciembre del 2021-julio del 2020, diciembre del 2019-agosto del2020 y entre junio del 2021-septiembre del 2021 (Fig. 6).
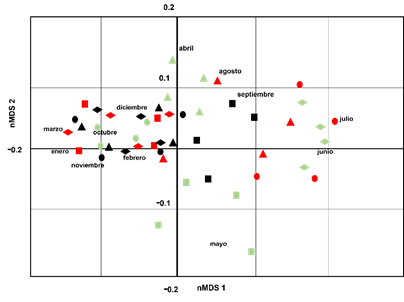
Fig. 4. Gráfico del nMDS que muestra la composición de aves acuáticas y rapaces en los diferentes meses de muestreo en los sitios de muestreo en la Zona Metropolitana de la Ciudad de México, México.
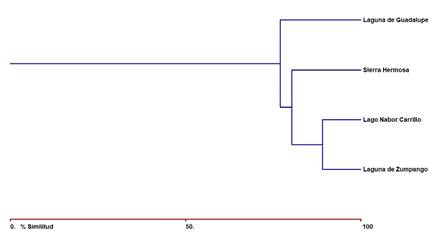
Fig. 5. Dendograma de similitud (índice de Bray-Curtis) entre los humedales de muestreo en la Zona Metropolitana de la Ciudad de México, México.

Fig. 6. Dendogramas de similitud temporal (índice de Bray-Curtis) para los humedales de muestreo en la Zona Metropolitana de la Ciudad de México, México.
DISCUSIÓN
La composición y diversidad de aves acuáticas y rapaces en los humedales de estudio en la ZMCM varió entre los meses y sitios de muestreo, esto puede explicarse por diversos factores como la estructura del paisaje (e.g., grado de urbanización, vegetación circundante, estructura de la vegetación, presencia de cuerpos de agua) o por diferencias en los patrones de distribución o abundancia de recursos (Thiollay, 2007; Gatto et al., 2005; Donatelli et al., 2014). Lo anterior conlleva a que la riqueza y abundancia de las aves no sea uniforme (Gatto et al., 2005; Donatelli et al., 2014; Carmona et al., 2017).
La riqueza registrada de aves acuáticas y rapaces representa el 9,8% de las especies reportadas para México (Navarro-Sigüenza et al., 2014) y en el contexto regional más del 69% (Peterson & Navarro-Sigüenza, 2006; De Sucre et al., 2009), lo que destaca la importancia de estos humedales como áreas prioritarias para la conservación. El análisis de la riqueza de especies y la curva de acumulación indicó que el muestreo fue representativo. Solamente 45 especies de aves fueron comunes a todos los humedales de estudio, esto podría indicar una selección de hábitat dado que muchas de las especies acuáticas muestran dispersiones locales, especialmente en distancias cortas o medias entre los diferentes humedales o cuerpos de agua, además de que exhiben una alta adaptabilidad con respecto a la disponibilidad y uso de los recursos (Snyder & Chesson, 2003; Jankowski et al., 2009; Ayala-Pérez et al., 2013; Beatty et al., 2014). Sin embargo, aunque las rapaces presentan un rango amplio de movimiento y una alta flexibilidad para desplazamiento, su abundancia parece estar relacionada con la heterogeneidad del paisaje en la región. Lo anterior puede ser resultado, por la disponibilidad de alimento y refugio dado la alta perturbación antrópica que existe en la ZMCM (Ortega-Álvarez & McGregor-Fors, 2009; Ayala-Pérez et al., 2013; Ramírez-Bastida et al., 2018). Debido a lo anterior, la riqueza de especies encontrada está relacionada con la
presencia del recurso hídrico y trófico que requieren las especies acuáticas y rapaces, donde obtuvimos una mayor riqueza entre noviembre y marzo, que coincidió con la época de migración, lo cual se ha reportado en otras publicaciones (Ayala-Pérez et al., 2013; Carmona et al., 2017; Ramírez-Bastida et al., 2018), esto debido a que las aves migratorias aumentaron significativamente la riqueza de especies en esos meses (Hernández-Vázquez et al., 2000; Castillo-Guerrero & Carmona 2001; Ramírez-Bastida et al., 2011; Ayala-Pérez et al., 2013). En este sentido, los humedales de estudio se localizan en la ruta migratoria del centro de México y representan un área de invernación o de paso para muchas aves migratorias, por lo que estos sitios tienen una mayor relevancia para su conservación. No obstante, estos sitios han recibido poca atención y son escasos los estudios sobre aves en la región (Ayala-Pérez et al., 2013; Ramírez-Bastida et al., 2018; Ramírez-Albores & Pérez-Suárez, 2019). Por tal, su monitoreo es útil para incrementar el conocimiento de la avifauna y generar e implementar estrategias para su conservación. Adicionalmente, la creciente urbanización impacta negativamente a las poblaciones de especies vulnerables o de distribución restringida (i.e., endémicas), que son muy sensibles a la perturbación antrópica, mientras que por otra parte pueden ser idóneos para especies generalistas o invasoras (Alberti, 2005; Clergeau et al., 2006; Thiollay, 2007).
Nuestros resultados muestran diferencias en los meses de muestreo tanto en la diversidad, riqueza de especies como en la abundancia. Tales variaciones son probablemente asociadas con las diferencias en los ensambles de aves registrados mensualmente en estas áreas. Además, la avifauna puede también ser influenciada por variaciones en la disponibilidad de recursos de cada sitio, lo que indica que la distribución de las especies es influenciada no solo por la variación temporal, sino también por la selección del hábitat i.e., donde encuentren menos perturbación antrópica (Thiollay, 2007; Donatelli et al., 2014; Beatty et al., 2014). Respecto a la diversidad temporal entre noviembre y marzo se presentó una alta riqueza de especies (60 especies en promedio/mes), con especies bien representadas como Spatula clypeata, Spatula discors, Anas diazi, Fulica americana, Oxyura jamaicensis y Buteo jamaicensis, siendo sitios como zonas importantes para la invernación para estas como para otras especies acuáticas (Alcántara & Escalante, 2005; Ramírez-Bastida et al., 2011; Ayala-Pérez et al., 2013). Otra especie migratoria notoria fue Mareca penelope, ya que la literatura indica su llegada a América a través de una migración transhemisférica y que gradualmente ha ido expandiendo su territorio en Norteamérica (Ramírez-Albores et al., 2021). En México, se ha registrado principalmente en la Península de Baja California y esporádicamente en Durango, Chihuahua, Coahuila, Jalisco y Tamaulipas (Ramírez-Albores et al., 2021; eBird, 2022); sin embargo, recientemente se ha registrado su migración invernal junto con Mareca americana en el centro de México (Ramírez-Albores et al., 2021; eBird, 2022).
Las principales especies que explican estos cambios fueron Spatula clypeata, Spatula cyanoptera y Spatula discors dada sus altas abundancias, dado que estuvieron presentes en casi todos los meses de monitoreo (27, 28 y 24, respectivamente), junto con especies residentes como Fulica americana, Anas diazi, Himantopus mexicanus, Plegadis chihi, Bubulcus ibis y Oxyura jamaicensis. Por ejemplo, especies abundantes como Fulica americana y Oxyura jamaicensis pasaban desapercibidas cuando se presentaban altas concentraciones de individuos de Spatula clypeata (más de 3000 individuos por recorrido). Otras especies, como Anas diazi, Anas crecca, Anas acuta, Mareca strepera, Mareca americana y Spatula discors mostraron un patrón de cambio en sus abundancias similar al de Fulica americana y Oxyura jamaicensis. Aunque muchas de las especies son residentes, la importancia de estas especies acuáticas en la dinámica temporal de la avifauna ya ha sido documentada por otros autores (Castillo-Guerrero & Carmona, 2001; Ayala-Pérez et al., 2013; Carmona et al., 2017). Esto indica la estacionalidad con la que la comunidad de aves utiliza estos sitios, así como la mayor importancia de estos humedales para diferentes grupos de aves como Anátidos, Rallidos, Ardeidos y Charadridos durante el invierno. Otro grupo temporal lo formaron los meses de mayo a agosto con una menor riqueza de especies y con una representación claramente baja de aves acuáticas, así como de rapaces. Esto coincide con las fechas de partida hacia Norteamérica (Castillo-Guerrero & Carmona, 2001; Carmona et al., 2017) o realizando migraciones altitudinales como los casos de Cathartes aura y Buteo jamaicensis. Por otro lado, se ha señalado que la variabilidad espacio-temporal de los recursos que proporciona la vegetación a las aves (e.g., alimento, cobertura de la vegetación y refugio) puede modificar la distribución y abundancia de las aves afectadas (Ma et al., 2004; Alberti, 2005). Adicionalmente, se han detectado marcadas diferencias estacionales en la riqueza de especies de aves (Ma et al., 2004; Sebastián-González et al., 2010; Donatelli et al., 2014), indicando una fuerte adaptación a los cambios en los meses de lluvia y secas, particularmente las variaciones en el nivel del agua, presencia de lirio acuático o actividades antropogénicas (e.g., altos niveles de tránsito vehicular, poda y talado de árboles, altos niveles de descarga de aguas residuales), que consecuentemente alteran la disponibilidad de alimento y de refugio (Ayala-Pérez et al., 2013; Donatelli et al., 2014; Ramírez-Bastida et al., 2018).
Por lo tanto, nuestros datos junto con lo de otros estudios sugieren que la composición de especies de aves no sólo fluctúa con el tiempo (Donatelli et al., 2014), sino también en el espacio, reforzando la selección de hábitat y corroborando los resultados de estudios previos (Ayala-Pérez et al., 2013; Carmona et al., 2017; Ramírez-Bastida et al., 2018; Ramírez-Albores & Pérez-Suárez, 2019). Sin embargo, otro aspecto que resaltar son las perturbaciones ocasionadas por las actividades aeroportuarias debido al establecimiento en la región del Aeropuerto Internacional Felipe Ángeles.
Lo anterior, implicaría que muchas aves sean obligadas a migrar a nuevos sitios (Ning & Chen, 2011; Elías-Cruzado & Madrid-Ibarra, 2019), pudiendo colisionar con una aeronave durante estos movimientos (Sodhi, 2002). Aunado a esto, la contaminación acústica y la modificación de áreas naturales por la construcción de infraestructura (Gil et al., 2015; Elías-Cruzado & Madrid-Ibarra, 2019). Sin embargo, alrededor del aeropuerto se pueden encontrar condiciones que pueden resultar idóneas para las aves como cuerpos de agua artificiales, cercos vivos, camellones arbolados, pastizales con vegetación adyacente, áreas ajardinadas, entre otros (Ma et al., 2004; McKinney et al., 2006).
Los valores de similitud indicaron que la composición avifaunística en los humedales de muestreo fueron similares y que las abundancias están distribuidas uniformemente (Magurran, 2004; Moreno, 2001). Cada estación del año juega un papel fundamental para la presencia y diversidad de especies, esto es evidente con el análisis de Bray-Curtis donde los porcentajes de la composición avifaunística son altos, lo que indica una alta similitud de especies presentes entre los humedales de muestreo y entre los meses de muestreo. La alta diversidad beta documentada implica la necesidad de realizar acciones de conservación en el conjunto de ambientes, especialmente el mantenimiento de parches de vegetación y bordes alrededor o adyacentes a estos humedales, así como la conservación de ambientes con menos impacto antrópico. Así, el extenso sistema de humedales y de pequeños cuerpos de agua artificiales ubicados a los alrededores y dentro de la ZMCM pueden representar un hábitat amplio para las aves en su conjunto (Ramírez-Bastida et al., 2008, 2011; Ayala-Pérez et al., 2013). La riqueza y abundancia de especies que registramos muestran que incluso los pequeños cuerpos de agua artificiales con vegetación podrían ser relevantes para la conservación de las aves acuáticas y rapaces, ya que estos son un refugio para muchas especies migratorias. Nuestros resultados apoyan la idea de realizar acciones de manejo en las poblaciones de aves para integrar a los humedales alterados y amenazados del centro de México como una herramienta efectiva para evaluar su estado de conservación. Por tanto, existe la necesidad de realizar estudios que aborden temas como la alimentación de las diferentes especies, el uso de hábitat, el estado de salud de los individuos, y aspectos demográficos, como el éxito reproductivo y la supervivencia en poblaciones de especies representativas de los distintos grupos, y como distintas condiciones ambientales influyen en estos aspectos.
AGRADECIMIENTOS
Agradecemos a la Secretaría de la Defensa Nacional y al Instituto de Ingeniería de la UNAM. Al personal del Parque Estatal Ecológico, Recreativo y Turístico Sierra Hermosa por el apoyo logístico y las facilidades otorgadas, en específico a Jorge Pedro Cabañas Pérez por el apoyo logístico y a Noé Cabañas por su apoyo en los recorridos. A Clemente Vázquez por el apoyo logístico. A los ejidatarios de Tecámac, Nextlalpan, San Miguel Jaltocán, San Lucas Xolox, San Juan Pueblo Nuevo, San Juan Zitlaltepec y Zumpango de Ocampo por facilitarnos el trabajo de campo en sus terrenos.
ÉTICA, CONFLICTO DE INTERESES Y DECLARACIÓN DE FINANCIAMIENTO
Declaramos haber cumplido con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en la preparación de este documento; que no hay conflictos de interés de ningún tipo, y que todas las fuentes financieras se detallan plena y claramente en la sección de agradecimientos. Asimismo, estoy/estamos de acuerdo con la versión editada final de esta publicación. El respectivo documento legal firmado se encuentra en los archivos de la revista.
La declaración de contribución de cada autor es la siguiente: HCR, JOGG, RBT, JERA y MRH toma de datos; MRH, NPS, JGVN, JPCP y JERA concepción; NPS, JGVN, JPCP apoyo logístico; JERA diseño, análisis de datos y escritura del documento.
REFERENCIAS
Alberti, M. (2005). The effects of urban patterns on ecosystem function. International Regional Science Review, 28, 138-192. https://www.doi.org/10.1177/0160017605275160
Alcántara, J. L., & Escalante, P. (2005). Current threats to the Lake Texcoco Globally important bird area. USDA Forest Service General Technical Reports PSW-GTR-191.
Aronson, M. F. J., La Sorte, F. A., Nilon, C. H., Katti, M., Goddard, M. A., Lepczyk, C. A., Warren, P. S., Williams, N. S. G., Cilliers, S., Clarkson, B., Dobbs, C., Dolan, R., Hedblom, M., Klotz, S., Kooijams, J.L., Kühn, I., MacGregor-Fors, I., MacDonnell, M., Mörtberg, U., Pyŝek, P., Siebert, S., Sushinsky, J., Werner, P., & Winter, M. (2014). A global analysis of the impacts of urbanization on bird and plant diversity reveals key anthropogenic drivers. Proceedings of the Royal Society of London Series B, 281, 20133330. https://www.doi.org/10.1098/rspb.2013.3330
Ayala-Pérez, V., Arce, N., & Carmona, R. (2013). Distribución espacio-temporal de aves acuáticas invernantes en la ciénega de Tláhuac, planicie lacustre de Chalco, México. Revista Mexicana de Biodiversidad, 84(1), 327-337. https://www.doi.org/10.7550/rmb.28632
Beatty, W. S., Kesler, D. C., Webb, E. B., Raedeke, A. H., Naylor, L. W., & Humburg, D. D. (2014). The role of protected area wetlands in waterfowl habitat conservation: implications for protected area network design. Biological Conservation, 176(1), 144-152. https://www.doi.org/10.1016/j.biocon.2014.05.018
Berlanga, H., Gómez de Silva, H., Vargas-Canales, V. M., Rodríguez-Contreras, V., Sánchez-González, L. A., Ortega-Álvarez, R., & Calderón-Parra, R. (2019). Aves de México: lista actualizada de especies y nombres comunes. CONABIO.
Bobbink, R., Whigham, D. F., Beltman, B., & Verhoeven, T. A. (2006). Wetland functioning in relation to biodiversity conservation and restoration. En R. Bobbink, B. Beltman, T.A. Verhoeven & D.F. Whigham (Eds.), Wetlands: functioning, biodiversity conservation, and restoration. Springer.
Carmona, R., Mendoza, L. F., Molina, D., Ortega, L., Miramontes, E., & Cruz, M. (2017). Presencia espacial y temporal de aves rapaces diurnas (Aves: Accipitriformes, Falconiformes) en Marismas Nacionales Nayarit-Sinaloa, México. Acta Zoológica Mexicana (nueva serie), 33(1), 27-38.
Carrete, M., Tella, J. L., Blanco, G., & Bertellotti, M. (2009). Effects of habitat degradation on the abundance, richness and diversity of raptors across Neotropical biomes. Biological Conservation, 142(10), 2002-2011. https://www.doi.org/10.1016/j.biocon.2009.02.012
Castillo-Guerrero, J. A., & Carmona, R. (2001). Distribución de aves acuáticas y rapaces en un embalse dulceacuícola artificial de Baja California Sur, México. Revista de Biología Tropical, 49(3-4), 1131-1142. https://www.doi.org/10.15517/RBT.V5512.6036
Chesser, R. T., Billerman, S. M., Burns, K. J., Cicero, C., Dunn, J. L., Hernández-Baños, B. E., Kratter, A. W., Lovette, I. J., Mason, N. A., Rasmussen, P. C., Remsen Jr., J. V., Stotz, D. F., & Winker, K. (2021). Check-list of North American Birds. American Ornithological Society. https://checklist.aou.org/taxa.
Clarke, K. R., & Warwick, R. M. (2001). A further biodiversity index applicable to species lists: variation in taxonomic distinctness. Marine Ecology Progress Series, 216, 265-278. https://www.doi.org/10.3354/meps216265
Clergeau, P., Croci, S., Jokimäki, J., Kaisanlathi-Jokimäki, M., & Dinetti, M. (2006). Avifauna homogenisation by urbanisation: Analysis at different European latitudes. Biological Conservation, 127(3), 336-344. https://www.doi.org/10.1016/j.biocon.2005.06.035
Colwell, R. K. (2018). EstimateS: Statistical estimation of species richness and shared species from samples. Version 9. User’s Guide and application. https://purl.oclc.org/estimates
Colwell, R. K., & Coddington, J. A. (1995). Estimating terrestrial biodiversity through extrapolation. In D.L. Hawksworth (Ed.), Biodiversity: Measurement and estimation. Chapman & Hall.
De Gortari-Ludlow, N., Espinosa-Reyes, G., Flores-Rivas, J., Salgado-Ortiz, J., & Chapa-Vargas, L. (2015). Threats, conservation actions, and research within 78 Mexican non-coastal protected wetlands. Journal for Nature Conservation, 23, 73-79. https://www.doi.org/10.1016/j.jnc.2014.06.005
De Sucre, A. E., Ramírez-Bastida, P., Gómez de Silva, H., & Ramírez, S. (2009). Aves. En G. Ceballos, R. List, G. Garduño, R. López-Cano, M. J. Muñozcano, E. Collado, & J. E. San Román (Comps.). La diversidad biológica del Estado de México: Estudio de Estado (pp. 131-144). Editorial de la Administración Pública Estatal de México.
Donatelli, R. J., Possos, R., & Toledo, M. C. B. (2014). Distribution, composition and seasonality of aquatic birds in the Necolândia sub-region of south Pantanal, Brazil. Brazilian Journal of Biology, 74(4), 844-853. https://www.doi.org/10.1590/1519-6984.05013
Dunn, J.L., & Alderfer, J. (2008). Field guide to the birds of North America. National Geographic Society.
eBird. (2022). eBird: an online database of bird distribution and abundance. Cornell Lab of Ornithology. https://www.ebird.org
Elías-Cruzado, C. A., & Madrid-Ibarra, F. M. (2019). Distribución espacial y temporal de avifauna en el Aeropuerto Internacional Jorge Chávez, Callao-Perú. Biotempo, 16(2), 257-269.
Elliott, L., Igl, L., & Johnson, D. (2020). The relative importance of wetland area versus habitat heterogeneity for promoting species richness and abundance of wetland birds in the Prairie Pothole Region, USA. Condor, 122(1), 1-21. https://www.doi.org/10.1093/condor/duz060
Gatto, A., Quintana, F., Yorio, P., & Lisnizer, N. (2005). Abundancia y diversidad de aves acuáticas en un humedal marino del Golfo San Jorge, Argentina. El Hornero, 20(2), 141-152.
Gil, D., Honarmand, M., Pascual, J., Pérez-Mena, E., & Macías, C. (2015). Birds living near airports advance their dawn chorus and reduce overlap with aircraft noise. Behavioral Ecology, 26(2), 435-443. https://www.doi.org/10.1093/beheco/aru207
Hernández-Vázquez, S., Durand-Martínez, B. C., Esparza-Salas, R., & Valadez-González, C. (2000). Distribución temporal de aves rapaces diurnas en la Reserva “Playón de Mismaloya”, Jalisco, México. Revista de Biología Tropical, 48, 1015-1018. https://www.doi.org/10.15517/RBT.V4814.18994
Howell, S. N. G., & Webb, S. (1995). A guide to the birds of Mexico and Northern Central America. Oxford University Press.
Instituto Mexicano de Tecnología del Agua (IMTA). (2012). Plan Estratégico para la recuperación ambiental de la laguna de Zumpango. Diagnostico e identificación de retos, problemas, estrategias, objetivos, acciones y proyectos prioritarios. https://bit.ly/41lT9oi
INEGI (Instituto Nacional de Estadística y Geografía). (2001). Estadísticas del medio ambiente del Distrito Federal y Zona Metropolitana 2000. INEGI.
Instituto Nacional de Geografía y Estadística (INEGI). (2010). Censo de población y vivienda 2010. https://www.inegi.org.mx/programas/ccpv/2010/
Isaksson, C. (2018). Impact of urbanization on birds. En D.T. Tietze (Ed.). Bird species. How they arise, modify and vanish. Springer.
International Union for Conservation of Nature (IUCN). (2021). Red List of Threatened Species-International Union for Conservation of Nature. https://www.iucnredlist.org/
Jankowski, J. E., Ciecka, A. L., Meyer, N. Y., & Rabenold, K. N. (2009). Beta diversity along environmental gradients: implications of habitat specialization in tropical montane landscapes. Journal of Animal Ecology, 78(2), 315-327. https://www.doi.org/10.1111/j.1365-2656.2008.01487.x
Ma, Z., Zhao, B., Jing, K., Tang, S., & Chen, J. (2004). Are artificial wetlands good alternatives to natural wetlands for waterbirds? A case study on Chongming Island, China. Biodiversity and Conservation, 13, 333-350. https://www.doi.org/10.1023/B:BIOC.0000006502.96131.59
Magurran, A. E. (2004). Measuring biological diversity. Blackwell Science Ltd.
Marzluff, J.M. (2005). Island biogeography for an urbanizing world: how extinction and colonization may determine biological diversity in human-dominated landscapes. Urban Ecosystems, 8, 155-175. https://www.doi.org/10.1007/s11252-005-4378-6
McAleece, N., Gage, J. D. G., Lambshead, P. J. D., & Paterson, G. L. J. (1997). BioDiversity Professional statistics analysis software. The Scottish Association for Marine Science and the Natural History Museum London.
McDonnell, M. J., & MacGregor-Fors, I. (2016). The ecological future of cities. Science, 352(6288), 936-938. https://www.science.org/doi/10.1126/science.aaf3630
McKinney, R. A., McWilliams, S. R., & Charpentier, M. A. (2006). Waterfowl-habitat associations during winter in an urban North Atlantic estuary. Biological Conservation, 132, 239-249. https://www.doi.org/10.1016/j.biocon.2006.04.002
Millenium Ecosystem Assessment. (2005). Ecosystems and Human Well-Being: Wetlands and Water Synthesis. World Resources Institute.
Moreno, C. E. (2001). Métodos para medir la biodiversidad. M & T-Manuales y Tesis sea.
Navarro-Sigüenza, A. G., Rebón-Gallardo, M. F., Gordillo-Martínez, A., Peterson, A. T., Berlanga, H., & Sánchez-González, L. A. (2014). Biodiversidad de aves. Revista Mexicana de Biodiversidad, 85, 476-495. https://www.doi.org/10.7550/rmb.41882
Ning, H., & Chen, W. (2014). Bird strike risk evaluation at airports. Aircraft Engineering and Aerospace Technology, 86, 129–137.
Ortega-Álvarez, R., & McGregor-Fors, I. (2009). Living in the big city: effects of urban land-use on bird community structure, diversity, and composition. Landscape and Urban Planning, 90(3-4), 189-195. https://www.doi.org/10.1016/j.landurbplan.2008.11.003
Peterson, R. T., & Chalif, E. L. (1989). Aves de México, guía de campo. Edit. Diana.
Peterson, A. T., & Navarro-Sigüenza, A. G. (2006). Hundred-year changes in the avifauna of the Valley of Mexico, Distrito Federal, Mexico. Huitzil, 7(1), 4-14. https://doi.org/10.28947/hrmo.2006.7.1.27
Ramírez-Albores, J. E., & Pérez-Suárez, M. (2019). El papel de la Universidad Autónoma del Estado de México-campus El Cerrillo como refugio de la diversidad de aves en el Valle de Toluca, México. Ciencia ergo-sum, 25(3), e32. https://www.doi.org/10.30878/ces.v25n3a10
Ramírez-Albores, J. E., Bautista, R., & Cayetano-Rosas, H. (2021). First occurrence of Eurasian wigeon (Mareca penelope L.) in central Mexico. Western North American Naturalist, 81(3), 453-456. https://www.doi.org/10.3398/064.081.0314
Ramírez-Bastida, P., Navarro-Sigüenza, A. G., & Peterson, A. T. (2008). Aquatic bird distributions in Mexico: designing conservation approaches quantitatively. Biodiversity and Conservation, 17, 2525-2558. https://www.doi.org/10.1007/s10531-008-9398-0
Ramírez-Bastida, P., Varona-Graniel, E., & DeSucre, A. E. (2011). Aves en los relictos de un gran lago: Los humedales de la Ciudad de México y áreas vecinas. El Canto del Centzontle, 2(1), 72-86.
Ramírez-Bastida, P., Meléndez-Herrada, A., López-Saut, E. G., Saldaña-Martínez, S., Ruiz-Rodríguez, A., Vargas-Gómez, M., Cruz-Nava, A.R., Dávalos-Fong, M. I., García, U. D., Sánchez-Sánchez, C., & Gómez-Rosas, A. (2018). Importancia de los ambientes acuáticos urbanos para las aves nativas: el caso de la zona metropolitana de la Ciudad de México. En A. Ramírez-Bautista & R. Pineda-López (Eds.). Ecología y conservación de fauna en ambientes antropizados. REFAMA-CONACyT-UAQ.
Rodríguez-Estrella, R., Donázar, J.A., & Hiraldo, F. (1998). Raptors as indicators of environmental change in the scrub hábitat of Baja California Sur, Mexico. Conservation Biology, 12(4), 921-925.
Sebastián-González, E., Sánchez-Zapata, J. A., & Botella, F. (2010). Agricultural ponds as alternative habitat for waterbirds: spatial and temporal patterns of abundance and management strategies. European Journal of Wildlife Research, 56, 11-20. https://doi.org/10.1007/s10344-009-0288-x
Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT). (2010). Norma Oficial Mexicana NOM-059-ECOL-2010. Protección ambiental-especies nativas de México de flora y fauna silvestres categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-lista de especies en riesgo. Diario Oficial de la Federación 30 de diciembre de 2010.
Sibley, D. A. (2014). The Sibley guide to birds (2nd ed.). Knopf.
Siegel, S., & Castellan Jr., N. J. (1988). Nonparametric statistics for the behavioral sciences. McGraw-Hill.
Snyder, R. E., & Chesson, P. (2003). Local dispersal can facilitate coexistence in the presence of permanent spatial heterogeneity. Ecology Letters, 6(4), 301-309. https://doi.org/10.1046/j.1461-0248.2003.00434.x
Sodhi, N.S. (2002). Competition in the air: birds versus aircraft. The Auk A Quarterly Journal of Ornithology, 119(3), 587–595. https://doi.org/10.1093/auk/119.3.587
Sorani, V., Rodríguez, G., & Reygadas, D. D. (2016). Usos y cobertura de suelo. En CONABIO & SEDEMA (Eds.), La biodiversidad de la Ciudad de México Volumen I (pp.104-112) CONABIO-SEDEMA.
Thiollay, J. M. (2007). Raptor communities in French Guiana: distribution, habitat selection, and conservation. Journal of Raptor Research, 41(2), 90-105. https://doi.org/10.3356/0892-1016(2007)41[90:RCIFGD]2.0.CO;2
United Nations. (2018). 2018 Revision of World Urbanization Prospects. United Nations. https://population.un.org/wup/
Vázquez-Pérez, J. R., Enríquez, P. L., & Rangel-Salazar, J. L. (2009). Diversidad de rapaces diurnas en la Reserva de la Biosfera Selva del Ocote, Chiapas, México. Revista Mexicana de Biodiversidad, 80 (1), 203-209. https://www.redalyc.org/pdf/425/42511957022.pdf
Wetlands International. (2018). Waterbird Population Estimates. Wetlands International. https://wpe.wetlands.org/