COMUNICACIÓN BREVE
Contaminación del agua del río Durazno, Costa Rica: más allá del índice holandés de calidad del agua
Douglas Alberto
Venegas González1![]() Eric
Morales Mora2
Eric
Morales Mora2![]() , Kenia
Barrantes-Jiménez2
, Kenia
Barrantes-Jiménez2![]() , Eddy Gómez Ramírez3
, Eddy Gómez Ramírez3![]() , Paola Fuentes-Schweizer4
, Paola Fuentes-Schweizer4![]() & Andrea
Irías-Mata5
& Andrea
Irías-Mata5![]()
1. Universidad de Costa Rica, Facultad de Ciencias Básicas, Escuela de Química, San José, Costa Rica; douglas.venegas@ucr.ac.cr
2. Universidad de Costa Rica, Instituto de Investigaciones en Salud, San José, Costa Rica; eric.morales@ucr.ac.cr, kenia.barrantes@ucr.ac.cr
3. Universidad de Costa Rica, Centro de Investigaciones en Ciencias del Mar y Limnología, San José, Costa Rica, eddy.gomez@ucr.ac.cr
4. Universidad de Costa Rica, Facultad de Ciencias Básicas, Escuela de Química, San José, Costa Rica, Centro de Investigaciones en Electroquímica y Energía Química, San José, Costa Rica; paola.fuentes@ucr.ac.cr
5. Universidad de Costa Rica, Centro para Investigaciones en Granos y Semillas, San José, Costa Rica; andrea.iriasmata@ucr.ac.cr
Recibido 9-X-2022 □ Corregido 13-I-2023 □ Aceptado 31-I-2023
DOI: https://doi.org/10.22458/urj.v15i1.4339
|
ABSTRACT. “Pollution of the Durazno River water, Costa Rica: beyond the Dutch water quality index”. Introduction: The micro-basin of the Durazno River in Costa Rica is a source of water for human consumption, but is suspected of microbiological pollution from several land uses. Objective: To assess the water quality of the Durazno micro-basin from the physicochemical, microbiological and antibiotics points of view. Methods: We used the Dutch Water Quality index; Standard Methods for the Examination of Water and Wastewater; and solid-phase extraction and ultra-high performance liquid chromatography coupled to tandem mass spectrometry. Results: While physicochemical parameters indicated an adequate water quality, microbiologically this water is not acceptable for human consumption. The water has Doxycycline and Cefotaxime, possibly of agricultural origin. This is the first report of Cefotaxime in water from Costa Rica. The Dutch index fails to take into account microbiological parameters that are also important. Conclusion: The Durazno River does not meet the standards for human water consumption and the Dutch index needs to be complemented with microbiological parameters.
Key words: Water pollution, indicators, water quality, antibiotics, SPE-UHPLC-MS/MS.
|
RESUMEN. Introducción: La microcuenca del río Durazno en Costa Rica es fuente de agua para consumo humano, pero se sospecha de contaminación microbiológica por varios usos del suelo. Objetivo: Evaluar la calidad del agua de la microcuenca del Durazno desde el punto de vista fisicoquímico, microbiológico y antibiótico. Métodos: Utilizamos el índice holandés de calidad del agua; Métodos Estándar para el Examen de Agua y Aguas Residuales; y extracción en fase sólida y cromatografía líquida de ultra alta resolución con espectrometría de masas en tándem. Resultados: Si bien los parámetros fisicoquímicos indicaron una calidad de agua adecuada, microbiológicamente esta agua no es aceptable para el consumo humano. El agua tiene doxiciclina y cefotaxima, posiblemente de origen agrícola. Este es el primer reporte de Cefotaxima en agua de Costa Rica. El índice holandés no tiene en cuenta parámetros microbiológicos que también son importantes. Conclusión: El río Durazno no cumple con los estándares para consumo humano de agua y el índice holandés necesita ser complementado con parámetros microbiológicos.
Palabras clave: Contaminación del agua, indicadores, calidad del agua, antibióticos, SPE-UHPLC-MS/MS.
|
El recurso hídrico es indispensable para el desarrollo humano, (Oladipo et al., 2020) y garantizar su disponibilidad, gestión y saneamiento es uno de los Objetivos para el Desarrollo Sostenible de la agenda 2030 ( Organización de las Naciones Unidas para la Educación, la Ciencia y la Cultura [UNESCO], 2017). Por esto, se deben monitorear las fuentes de agua para consumo humano, debido a que son susceptibles a la contaminación por descarga de aguas residuales municipales y drenaje urbano sobre las cuencas hidrográficas (Liyanage & Yamada, 2017).
Los índices numéricos son usados para evaluar la calidad del agua (ICA) (Hafeez et al., 2019; Lumb et al., 2011), donde el mayor reto de su elaboración es sintetizar la compleja realidad de un cuerpo de agua, donde influyen muchas variables ambientales (Simões et al., 2008), lo que provoca que se requiera el análisis de numerosos parámetros fisicoquímicos, biológicos y microbiológicos (Calvo-Brenes & Araya-Ulloa, 2018).
En Costa Rica se utiliza el índice holandés para la clasificación de los cuerpos de agua superficial, según lo establecido en el Reglamento para la Evaluación y Clasificación de la Calidad de Cuerpos de Agua Superficiales (RECCCAS)(Ministerio de Ambiente y Energía [MINAE], 2007), este contempla únicamente el nitrógeno amoniacal, la demanda bioquímica de oxígeno (DBO) y el porcentaje de saturación de oxígeno (%SO) y les otorga un valor escalado a cada uno de los parámetros (Tabla 1), y clasifica la calidad del agua a partir de la suma de los valores individuales (Tabla 2). Sin embargo, este reglamento establece una serie de parámetros complementarios, como la medición del número más probable por cada 100mL (NMP/100mL) de coliformes fecales (CF) como indicador microbiológico. Este parámetro complementario indica que valores menores a 20 corresponden a agua clase 1, de 20-1000 a clase 2, de 1000-2000 a clase 3, de 2000-5000 a clase 4 y mayor a 5000 a clase 5.
Tabla 1
Puntajes según sistema holandés de valoración de la calidad fisicoquímica del agua para cuerpos receptores.
|
Puntos |
PSO (%) |
DBO (mg L-1) |
N-NH4+ (mg L-1)* |
|
1 |
91-100 |
≤3 |
< 0,5 |
|
2 |
71-90 111-120 |
3,1-6,0 |
0,5-1,0 |
|
3 |
51-70 121-130 |
6,1-9,0 |
1,1-2,0 |
|
4 |
31-50 |
9,1-15 |
2,1-5,0 |
|
5 |
≤30 y > 130 |
>15 |
>5 |
*Nitrógeno amoniacal
Tabla 2
Clases de calidad del agua según sistema holandés, basado en valores de PSO, DBO y nitrógeno amoniacal
|
Clase |
Sumatoria de puntos |
Interpretación de la calidad |
Abastecimiento de agua para uso y consumo humano |
|
1 |
3 |
≤3 |
Con tratamiento simple con desinfección |
|
2 |
4-6 |
3,1-6,0 |
Con tratamiento convencional |
|
3 |
7-9 |
6,1-9,0 |
Con tratamiento avanzado |
|
4 |
10-12 |
9,1-15 |
No utilizable |
|
5 |
13-15 |
>15 |
No utilizable |
El uso de parámetros microbiológicos es importante debido a sus efectos sobre la salud ambiental, la Organización Mundial de la Salud establece la Escherichia coli (E.coli) como indicador de contaminación fecal (United Nations Environment Programme, 2007). Otros índices contemplan el análisis de nutrientes para evaluar la eutrofización (Acuña-Alonso et al., 2020; Simões et al., 2008) y de elementos asociados a contaminación antropogénica (American Public Health Association [APHA], 2017; Yidana & Yidana, 2010). Asimismo, contaminantes emergentes, como los residuos de antibióticos, pueden generar una presión selectiva sobre las bacterias presentes en los cuerpos de agua, favoreciendo el desarrollo de resistencia hacia estos organismos (Alduina, 2020; Jovanovic et al., 2021). Entre los grupos de antibióticos, las tetraciclinas y los betalactámicos de espectro extendido, son muy utilizados tanto a nivel clínico como agropecuario, por lo tanto, tienen una presencia ambiental importante e incluso se han asociado a resistencia antimicrobiana en el país (Granados-Chinchilla & Rodríguez, 2017; Sarmah et al., 2006).
La microcuenca del río Durazno es un punto de captación de agua para consumo humano, (Figura 1) donde se han descrito altos niveles de contaminación microbiológica, que la convierte en un área propicia para el estudio de la presencia de antibióticos (Morales et al., 2019).
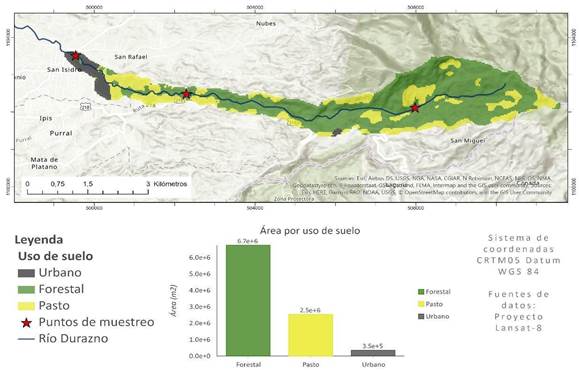
Fig. 1. Mapa de uso de suelo de la microcuenca del río Durazno, que posee un área de 9,6 km2 y se ubica en el cantón de Vásquez de Coronado en la subcuenca del río Virilla. El uso de suelo contempla actividades forestal, agrícola, pecuaria, industrial y urbana
El objetivo de este trabajo fue evaluar la calidad del agua de la microcuenca del río Durazno, con análisis fisicoquímicos, microbiológicos y cuantificación de antibióticos.
En 2021 hicimos 2 muestreos puntuales en 3 sitios (punto 1 W 1103543, N 499555; punto 2 W 1102465, N 502320; punto 3 W 1102156, N 508035) en época seca (marzo; 0,00mm lluvia, 16,7°C) y lluviosa (junio; 3,50mm lluvia, 16,7°C; Instituto Meteorológico Nacional #84207, Patio de Agua en Coronado; W 1103194, N 503289; 1690m.s.n.m), para un total de 6 muestras analizadas por triplicado, a excepción del pH y el análisis elemental, que corresponden a una única medición. Las muestras para los análisis fisicoquímicos y microbiológicos se recolectaron acorde a APHA, 2017 y Spongberg et al., 2011.
Medimos alcalinidad (Environmental Protection Agency [EPA], 1983; Strickland & Parsons, 1972), dureza (APHA, 2017), demanda bioquímica de oxígeno (DBO) (Vargas, 2009), demanda química de oxígeno (DQO) (HACH Company, 2000), clorofila a (Chla-a), nutrientes (Nitrito, Amoniaco, Nitrato, Fosfato y Silicato) (Parsons et al., 1984; Strickland & Parsons, 1972), material en suspensión (APHA, 2017), y metales, fósforo y azufre (APHA, 2017).
Calificamos la calidad del agua superficial con el índice holandés (MINAE, 2007) y E.coli y Enterococcus faecalis (E .faecalis) por número más probable (9221E, 9221F y 9230B, American Public Health Association).
Validamos el método para cuatro antibióticos, tres tetraciclinas (tetraciclina, doxiciclina y oxitetraciclina) y un betalactámico (cefotaxima), considerando parámetros de desempeño de linealidad, límites de detección y cuantificación, precisión, recuperación y efecto de matriz; Tabla S1). Extracción y el análisis cromatográfico según Ramírez-Morales et al., 2020, y Zhang et al., 2016. Para los antibióticos usamos fase sólida, con un cartucho Oasis HLB 200mg (Waters, USA) y como disolventes de elución volúmenes iguales de metanol:acetonitrilo y metanol:diclorometano en proporciones 1:1 (Figura S1).
Aplicamos cromatografía líquida de ultra alta resolución acoplado a un detector de masas de triple cuadrupolo (UHPLC-MS), con una separación en fase reversa (Tabla S2)
Para el análisis espacial de la distribución de antibióticos y su asociación con las proporciones de CF-EF y el uso del suelo en la microcuenca, aplicamos Morales et al., 2019 y Chacón et al., 2018, con ArcGIS Pro2.5.
La delimitación y visualización de la cuenca se realizó con los datos del Sistema Nacional de Información Territorial (SNIT) del Instituto Nacional Geográfico de Costa Rica utilizando el software QGIS 3.16.15 (QGIS Development Team, 2021. QGIS Geographic Information System. Open Source Geospatial Foundation Project. https://qgis.org) con base en los mapas estándar del Open Geospatial Consortium (OGC del SNIT). El uso del suelo se realizó conforme a lo indicado por Morales et al., 2019. La delimitación de la proporción CF-EF se realizó según Chacón et al., 2018, y se realizó una representación de burbujas por punto de muestreo. Para la delimitación de las concentraciones de antibióticos se calculó la media geométrica de las repeticiones y se realizó una interpolación de la media geométrica con la técnica de distancia inversa ponderada. Finalmente, se superpuso el gráfico de burbujas y la interpolación espacial de la media. Todos los análisis fueron realizados en el software ArcGIS Pro2.5.
La mayoría de los parámetros fisicoquímicos y concentraciones de nutrientes y elementos evaluados se mantuvieron con valores similares y bajo el máximo permisible en ambos muestreos. Sólo se evidencia una diferencia en la cantidad de material en suspensión, niveles de Chl-a y concentraciones de calcio y azufre, pero siempre entre los valores recomendados por el RECCCAS para agua clase 3. El manganeso, cobre y zinc no fueron detectados, mientras que el hierro se logró cuantificar solo en el segundo muestreo (Tabla S3).
Acorde al índice holandés el agua de la microcuenca del río Durazno se clasifica como clase 2 en todos los puntos y en ambos muestreos, por lo que con un tratamiento convencional sería apta para el uso y consumo humano (Tabla 3).
Tabla 3
Resultados del índice holandés en las aguas superficiales de la microcuenca del río Durazno en muestreos realizados en época seca (I) y lluviosa (II)
|
Punto de muestreo-Muestreo |
PSO (%) |
DBO (mg L-1) |
N-NH4+ (mg L-1) |
Sumatorio de puntos |
Clasificación |
|
1-I |
77,1 |
3,00 |
0,0053 |
4 |
2 |
|
2-I |
79,8 |
2,00 |
0,0027 |
4 |
2 |
|
3-I |
72,2 |
2,00 |
0,0026 |
4 |
2 |
|
1-II |
80,1 |
7,00 |
0,0020 |
6 |
2 |
|
2-II |
80,7 |
0,50 |
0,0003 |
4 |
2 |
|
3-II |
77,5 |
8,00 |
0,0036 |
6 |
2 |
Sin embargo, todos los análisis de coliformes superaron el valor máximo admisible para el agua clase 3 (Tabla 4). En el primer muestreo se obtuvo calidad clase 4 y en el segundo calidad clase 5. Esto es reforzado por los otros indicadores microbiológicos (E. coli y E. faecalis), que se encontraron en concentraciones altas cuando lo esperado sería que no se presenten.
Tabla 4
Concentraciones de E. coli y E. faecalis presentes en las aguas superficiales de la microcuenca del río Durazno.
|
Indicador microbiológico (NMP/100 mL) |
Punto de muestreo |
Valor máximo permisible (NMP/100 mL)* |
|||||
|
Muestreo época seca |
Muestreo época lluviosa |
||||||
|
1 |
2 |
3 |
1 |
2 |
3 |
||
|
CF |
4 600 |
2 200 |
4 600 |
5 240 |
18 315 |
77 559 |
2000 |
|
E. coli |
4 600 |
2 200 |
3 500 |
5 240 |
18 315 |
77 559 |
-- |
|
E. faecalis |
3 500 |
2 100 |
2 600 |
1 272 |
48 303 |
86 748 |
-- |
El valor máximo admisible corresponde al permitido para agua clase 3 (máximo nivel de contaminación que puede ser tratado para el uso y consumo humano).
*De acuerdo con el reglamento de agua potable y la guía de calidad para agua potable de la OMS, no deben ser detectables en los suministros de agua.
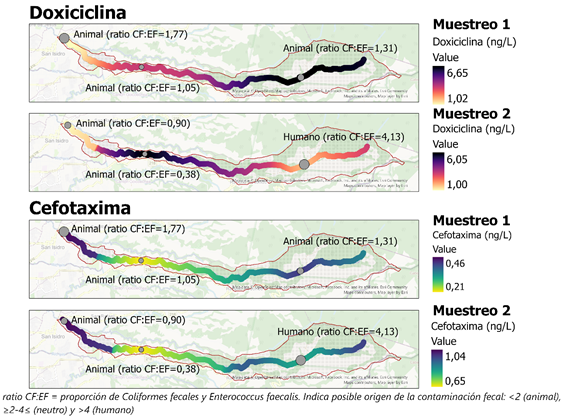
Se evidenció la presencia de doxiciclina y cefotaxima en concentraciones cuantificables, sin diferencias significativas entre puntos de muestreo ni muestreos (p> 0.05), aunque de manera acumulada existe una mayor carga de estos en el punto 2 del segundo muestreo (Figura 2).
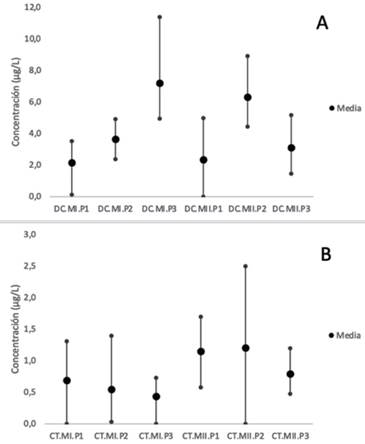
Fig. 2. Concentraciones de doxiciclina (A) y cefotaxima (B) presentes en las aguas superficiales de la microcuenca del río Durazno en los muestreos en época seca (I) y lluviosa (II) (Código del eje x: Antibiótico. Muestreo. Punto de muestreo). La normalidad de los datos se verificó con las pruebas de Shapiro-Wilks y de Levene, seguido de una comparación de medias con la prueba de Kruskal-Wallis entre puntos y épocas de muestreo, a un nivel de significancia de 95%, usando el paquete ggplot2 de Rstudio (Core Team, 2021).
Los valores de los parámetros fisicoquímicos y elementos evaluados se encuentran en el rango adecuado (Tabla S3) (Ewaid & Abed, 2017; MINAE, 2007) mostrando así un agua sin contaminación o con contaminación incipiente. Las pequeñas variaciones observadas se pueden atribuir a diferencias geográficas, estación, período del día, circulación del aire, cobertura de nubes, flujo y profundidad promedio (Oladipo et al., 2020). Fue excepción la chl-a; que puede asociarse a las precipitaciones de los días previos y durante el muestreo, donde por arrastre y escorrentía se puede aumentar la cantidad de sólidos presentes, biomasa fitoplantónica y nutrientes resuspendidos (Campos-González et al., 2016). En todos los puntos el calcio predominó, posiblemente por el intercambio iónico y el tipo de roca en la cuenca (Rashid & Romshoo, 2013)
Los análisis microbiológicos evidencian una contaminación fecal a niveles superiores a los permitidos, que clasifica el agua con contaminación muy severa no apta para consumo humano (Tabla 4). Esto se debe principalmente a origen animal (Fig. 2) en concordancia con la predominancia de actividades agropecuarias en la zona. Esto reafirma la limitación del índice holandés para evaluar de forma adecuada la calidad del agua al no considerar el panorama completo de la contaminación presente en la matriz de estudio.
Fig. 3. Modelo descriptivo del comportamiento de las concentraciones de cefotaxima y doxiciclina y su asociación con los indicadores de contaminación fecal en las aguas superficiales de la microcuenca del río Durazno para las campañas de muestreo en época seca y lluviosa del año 2021.
En cuanto a la presencia de antibióticos, la doxiciclina, principalmente utilizada en el sector agropecuario, no presenta una concentración significativamente mayor en los puntos de muestreo 1 y 2, que corresponden a zonas forestales y de pasto. Estos valores son menores a los reportados en el país para aguas superficiales (Spongberg et al., 2011) y en plantas de tratamiento de agua residual (Ramírez-Morales et al., 2020). A su vez la cefotaxima, que no había sido reportada en cuerpos de agua anteriormente, no presenta una concentración significativamente mayor en el punto 3, que corresponden a una zona urbana, lo que sugiere una aplicación de este antibiótico a nivel agropecuario y no únicamente en humanos. El punto 2 que presenta mayor acumulación de antibióticos es el punto más cercano a la toma de agua en la zona, lo que aumenta las posibilidades de su introducción a un sistema de tratamiento que no es eficiente para eliminarlos (Ramírez-Morales et al., 2020; Rodriguez-Mozaz et al., 2015).
Como recomendación derivada de los resultados de esta investigación, es evidente la necesidad de modificar y ampliar el RECCCAS contemplando parámetros microbiológicos asociados a contaminación fecal y algunos contaminantes emergentes para realizar una certera evaluación de la calidad del agua superficial.
AGRADECIMIENTOS
Los autores agradecen a la Vicerrectoría de Investigación de la Universidad de Costa Rica por el apoyo financiero otorgado para el desarrollo de esta investigación en el marco del proyecto VI-742-C0-078: Análisis temporal y espacial de la resistencia a los antibióticos y la calidad de las aguas superficiales de la microcuenca del Río Durazno.
ÉTICA, CONFLICTO DE INTERESES Y DECLARACIÓN DE FINANCIAMIENTO
Los autores declaran haber cumplido con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en el manuscrito; que no hay conflicto de intereses de ningún tipo, que todas las fuentes financieras se detallan plena y claramente en la sección de agradecimientos: y que están de acuerdo con la versión final del documento. Un documento firmado se encuentra en los archivos de la revista.
La contribución de los autores es como se detalla a continuación: D.A.V.G, P.F.S y E.M.M: análisis y visualización de datos. Todos los coautores: recopilación de datos, preparación y aprobación del documento.
REFERENCIAS
Acuña-Alonso, C., Álvarez, X., Lorenzo, O., Cancela, Á., Valero, E., & Sánchez, Á. (2020). Assessment of water quality in eutrophized water bodies through the application of indexes and toxicity. Science of The Total Environment, 728, 138775. https://doi.org/10.1016/j.scitotenv.2020.138775
Alduina, R. (2020). Antibiotics and Environment. Antibiotics, 9(4), 202. https://doi.org/10.3390/antibiotics9040202
American Public Health Association (APHA). (2017). Standard Methods for the Examination of Wastewater (23th edition). America Public Health Association.
Calvo-Brenes, G., & Araya-Ulloa, A. (2018). Evaluation of two water quality indices in several sites of the La Central stream, Pacayas de Alvarado, Costa Rica. Tecnología en Marcha, 31(4), 74–83. https://doi.org/10.18845/tm.v31i4.3966
Campos-González, M., Vargas, J. R., Franco-Herrera, A., & Medina, J. H. (2016). Distribución de la clorofila a en las aguas adyacentes a las islas de providencia y santa catalina, caribe colombiano. Bulletin of Marine and Coastal Research, 40(2). https://doi.org/10.25268/bimc.invemar.2011.40.2.115
Chacón, L., Arias, V., Barrantes, K., Beita-Sandí, W., Reyes, L., & Achí, R. (2018). Enterococci as a key parameter for water quality index: Purires River, Costa Rica. Journal of Water and Health, 16(6), 1007–1017. https://doi.org/10.2166/wh.2018.087
Environmental Protection Agency (EPA). (1983). Manual of Methods for Chemical Analysis of Water and Waste. https://nepis.epa.gov
Ewaid, S. H., & Abed, S. A. (2017). Water quality index for Al-Gharraf River, southern Iraq. The Egyptian Journal of Aquatic Research, 43(2), 117–122. https://doi.org/10.1016/j.ejar.2017.03.001
Food and Drug Administration (FDA). (2018). Bioanalytical Method Validation, Guidance for Industry. https://bit.ly/3Io4Aoo
Granados-Chinchilla, F., & Rodríguez, C. (2017). Tetracyclines in Food and Feedingstuffs: From Regulation to Analytical Methods, Bacterial Resistance, and Environmental and Health Implications. Journal of Analytical Methods in Chemistry, 2017, 1315497. https://doi.org/10.1155/2017/1315497
HACH COMPANY. Manual de análisis de agua HACH. https://bit.ly/3K3F1di
Hafeez, S., Wong, M., Ho, H., Nazeer, M., Nichol, J., Abbas, S., Tang, D., Lee, K., & Pun, L. (2019). Comparison of Machine Learning Algorithms for Retrieval of Water Quality Indicators in Case-II Waters: A Case Study of Hong Kong. Remote Sensing, 11(6), 617. https://doi.org/10.3390/rs11060617
Jovanovic, O., Amábile-Cuevas, C. F., Shang, C., Wang, C., & Ngai, K. W. (2021). What Water Professionals Should Know about Antibiotics and Antibiotic Resistance: An Overview. ACS ES&T Water, 1(6), 1334–1351. https://doi.org/10.1021/acsestwater.0c00308
Liyanage, C., & Yamada, K. (2017). Impact of Population Growth on the Water Quality of Natural Water Bodies. Sustainability, 9(8), 1405. https://doi.org/10.3390/su9081405
Lumb, A., Sharma, T. C., Bibeault, J.-F., & Klawunn, P. (2011). A Comparative Study of USA and Canadian Water Quality Index Models. Water Quality, Exposure and Health, 3(3–4), 203–216. https://doi.org/10.1007/s12403-011-0056-5
Ministerio de Ambiente y Energía (MINAE). (2007). Reglamento para la Evaluación y Clasificación de la Calidad de Cuerpos de Agua Superficiales. https://bit.ly/3IjhaVM
Morales, E., Solano, M., Morales, R., Reyes, L., Barrantes, K., Achí, R., & Chacón, L. (2019). Evaluación de la influencia de la estacionalidad climática en calidad del agua de consumo humano en un sistema de abastecimiento en San José, Costa Rica, periodo 2017-2018. Revista Costarricense de Salud Pública, 28(1), 77-87. https://www.scielo.sa.cr/pdf/rcsp/v28n1/1409-1429-rcsp-28-01-48.pdf
Oladipo, J. O., Aboyeji, O. S., Akinwumiju, A. S., & Adelodun, A. A. (2020). Fuzzy Logic Interference for Characterization of Surface Water Potability in Ikare Rural Community, Nigeria. Journal of Geovisualization and Spatial Analysis, 4(1), 1-14 1. https://doi.org/10.1007/s41651-019-0044-z
Organización de las Naciones Unidas para la Educación, la Ciencia y la Cultura (UNESCO). (2017). Education for sustainable development goals: Learning objectives. https://unesdoc.unesco.org/ark:/48223/pf0000247444
Parsons, T. R., Maita, Y., & C.M., L. (1984). A Manual of Chemical and Biological Methods for Seawater Analysis. Pergamon Press.
Ramírez-Morales, D., Masís-Mora, M., Montiel-Mora, J. R., Cambronero-Heinrichs, J. C., Briceño-Guevara, S., Rojas-Sánchez, C. E., Méndez-Rivera, M., Arias-Mora, V., Tormo-Budowski, R., Brenes-Alfaro, L., & Rodríguez-Rodríguez, C. E. (2020). Occurrence of pharmaceuticals, hazard assessment and ecotoxicological evaluation of wastewater treatment plants in Costa Rica. Science of The Total Environment, 746, 141200. https://doi.org/10.1016/j.scitotenv.2020.141200
Rashid, I., & Romshoo, S. A. (2013). Impact of anthropogenic activities on water quality of Lidder River in Kashmir Himalayas. Environmental Monitoring and Assessment, 185(6), 4705–4719. https://doi.org/10.1007/s10661-012-2898-0
R Core Team (2021). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. https://www.R-project.org/
Rodriguez-Mozaz, S., Chamorro, S., Marti, E., Huerta, B., Gros, M., Sànchez-Melsió, A., Borrego, C. M., Barceló, D., & Balcázar, J. L. (2015). Occurrence of antibiotics and antibiotic resistance genes in hospital and urban wastewaters and their impact on the receiving river. Water Research, 69, 234–242. https://doi.org/10.1016/j.watres.2014.11.021
Sarmah, A. K., Meyer, M. T., & Boxall, A. B. A. (2006). A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics (VAs) in the environment. Chemosphere, 65(5), 725–759. https://doi.org/10.1016/j.chemosphere.2006.03.026
Simões, F. dos S., Moreira, A. B., Bisinoti, M. C., Gimenez, S. M. N., & Yabe, M. J. S. (2008). Water quality index as a simple indicator of aquaculture effects on aquatic bodies. Ecological Indicators, 8(5), 476–484. https://doi.org/10.1016/j.ecolind.2007.05.002
Spongberg, A. L., Witter, J. D., Acuña, J., Vargas, J., Murillo, M., Umaña, G., Gómez, E., & Pérez, G. (2011). Reconnaissance of selected PPCP compounds in Costa Rican surface waters. Water Research, 45(20), 6709–6717. https://doi.org/10.1016/j.watres.2011.10.004
Strickland, J. D. H., & Parsons, T. R. (1972). A Practical Handbook of Seawater Analysis (Second). Fisheries Research Board of Canada. https://epic.awi.de
United Nations Environment Programme. (2007). Global Drinking Water Quality Index: Development and Sensitivity Analysis Report. https://bit.ly/3LRphuM
Vargas, E. (2009). Manual de laboratorio para análisis químico y control de calidad. Editorial Universidad Nacional.
Yidana, S. M., & Yidana, A. (2010). Assessing water quality using water quality index and multivariate analysis. Environmental Earth Sciences, 59(7), 1461–1473. https://doi.org/10.1007/s12665-009-0132-3
Zhang, Z., Li, X., Ding, S., Jiang, H., Shen, J., & Xia, X. (2016). Multiresidue analysis of sulfonamides, quinolones, and tetracyclines in animal tissues by ultra-high performance liquid chromatography–tandem mass spectrometry. Food Chemistry, 204, 252–262. https://doi.org/10.1016/j.foodchem.2016.02.142
APÉNDICE
Tabla S1
Resumen de resultados de los parámetros de desempeño evaluados en la validación del método para los dos antibióticos detectados en el Río Durazno.
|
Parámetro de validación |
Antibiótico |
|
|
Cefotaxima |
Doxiciclina |
|
|
Rango lineal (µg L-1) |
0.78-78.38 |
1.00-99.86 |
|
Coeficiente de correlación (R2) |
0.9954 |
0.9942 |
|
Límite de detección (µg L-1) |
0.015 |
0.025 |
|
Límite de cuantificación (µg L-1) |
0.049 |
0.082 |
|
Repetibilidad entre corridas ( % CV, n=3) |
2.4 |
6.1 |
|
Repetibilidad entre días ( % CV, n=3) |
34.5* |
11.4 |
|
Recuperación 10 µg L-1 (%) |
261 |
117 |
|
Recuperación 50 µg L-1 (%) |
105 |
91 |
|
Recuperación 100 µg L-1 (%) |
125 |
114 |
|
Efecto Matriz |
-21.1% |
|
* La variación se debe a una rápida degradación de la cefotaxima.
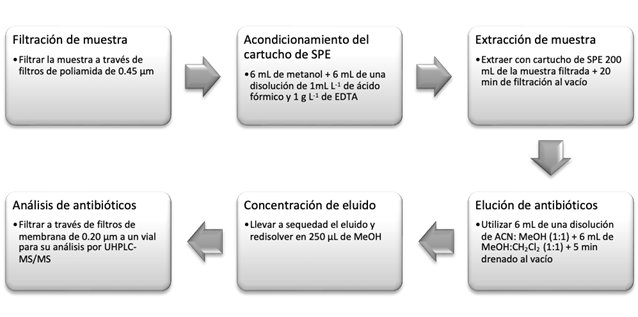
Fig. S1. Procedimiento SPE (Cartuchos Waters, Oasis HLB 200 mg con capacidad para 6 mL) de doxiciclina y cefotaxima en aguas superficiales de río.
Tabla S2
Condiciones cromatográficas y de cuantificación óptimas para la cuantificación de los antibióticos en estudio.
|
Parámetro |
Condiciones cromatográficas |
|
Columna |
Waters Acquity (UPLC CSHTM C18 1.7µm 2.1x100) |
|
Temperatura de columna |
37°C |
|
Fase móvil |
(A) Agua con ácido fórmico 1mL L-1 (B) Acetonitrilo con ácido fórmico al 1mL-1-1 |
|
Gradiente (min. -% A: %B) |
0-99:1 0.25-99:1 1.25-83:17 3.50-55:45 4-1:99 5.50-1:99 8-99:1 10-99:1 |
|
Flujo |
0.4mL min -1 |
|
Volumen de inyección |
5µL |
|
Temperatura del automuestreador |
4°C |
|
Gas de desolvatación |
Nitrógeno |
|
Fuente de ionización |
ESI |
|
Voltaje del aerosol |
+3500 V |
|
Temperatura de la fuente |
300°C |
|
Temperatura de evaporización |
350°C |
|
Gas de colisión |
Argón |
|
Modo de escaneo |
Monitoreo de la reacción seleccionada (SRM, por sus siglas en inglés) |
Tabla S3
Parámetros fisicoquímicos y concentraciones de nutrientes, clorofila y elementos analizados en las aguas superficiales de la microcuenca del río Durazno en época seca y lluviosa.
|
Parámetro |
Punto de muestreo |
Valor máximo permisible |
|||||
|
Muestreo época seca |
Muestreo época lluviosa |
||||||
|
I |
II |
III |
I |
II |
III |
||
|
Temperatura (°C) |
10,8 |
13,5 |
15,1 |
14,4 |
15,4 |
16,5 |
30 * |
|
Conductividad (µS cm-1) |
233,3 |
229,9 |
227,7 |
219,1 |
207,1 |
207,8 |
400,0** |
|
pH |
6,78 |
6,85 |
6,70 |
7,77 |
7,82 |
7,51 |
9,0 |
|
Alcalinidad (mg L-1 CaCO3) |
97,1 ± 0,7 |
127,7 ± 0,7 |
133 ± 1 |
96 ± 1 |
122 ± 0 |
113,4 ± 0,7 |
N.A |
|
Material en suspensión (mg L-1) |
14,7 ± 1 |
16,2 ± 0,3 |
8,0 ± 0,2 |
47 ± 3 |
41,6 ± 0,2 |
49,7 ± 0,5 |
100 |
|
DQO (mg L-1) |
25 ± 2 |
30 ± 2 |
10 ± 2 |
10 ± 2 |
10 ± 2 |
10 ± 2 |
50 |
|
Clorofila-a (µg L-1) |
3,2 ± 0,1 |
2,6 ± 0,2 |
1,37 ± 0,03 |
16 ± 4 |
10 ± 1 |
14 ± 1 |
N.A |
|
Fosfatos (± 0,008 mg L-1) |
0,195 |
0,292 |
0,320 |
0,227 |
0,228 |
0,280 |
N.A |
|
Nitratos (mg L-1) |
0,24 ± 0,02 |
0,43 ± 0,02 |
0,63 ± 0,02 |
0,02 ± 0,03 |
0,02 ± 0,03 |
0,67 ± 0,05 |
15 |
|
Silicatos (mg L-1) |
16,6 ± 0,5 |
16,9 ± 0,5 |
17,0 ± 0,5 |
22,5 ± 0,8 |
23,1 ± 0,8 |
22,8 ± 0,8 |
N.A |
|
Nitritos (± 0,02 mg L-1) |
0,07 |
0,08 |
0,08 |
0,03 |
0,02 |
0,09 |
0,9* |
|
Ca (±0,2 mg L-1) |
39,2 |
30,9 |
29,7 |
31,3 |
27,7 |
26,6 |
100 |
|
Fe (± 0,05 mg L-1) |
- |
- |
- |
0,1 |
0,1 |
0,1 |
0,3 |
|
K (± 0,05 mg L-1) |
5,4 |
5,9 |
6,0 |
5,5 |
7,0 |
7,1 |
10 |
|
Mg (± 0,05 mg L-1) |
9,10 |
9,40 |
9,60 |
8,80 |
9,10 |
8,90 |
50 |
|
Na (± 0,05 mg L-1) |
8,6 |
8,7 |
10,0 |
7,6 |
8.1 |
9,5 |
200 |
|
P (± 0,05 mg L-1) |
0,1 |
0,1 |
0,1 |
-- |
0,1 |
0,1 |
N.A |
|
S (± 0,02 mg L-1) |
31,0 |
20,7 |
18,3 |
26,3 |
17,8 |
16,5 |
N.A |
|
Mn (mg L-1) |
-- |
-- |
-- |
-- |
-- |
-- |
0,5* |
|
Cu (mg L-1) |
-- |
-- |
-- |
-- |
-- |
-- |
2,0 |
|
Zn (mg L-1) |
-- |
-- |
-- |
-- |
-- |
-- |
3,0* |
Los valores máximos admisibles son los permitidos para agua clase 3 (máximo nivel de contaminación que puede ser tratado para el uso y consumo humano).
* Valor máximo admisible según reglamento de calidad de agua potable.
**VA: Valor alerta según reglamento de calidad de agua potable. (Ministerio de Salud, 2015).