
UNED Research Journal (e-ISSN 1659-441X), Vol. 14(2): e4079, December, 2022
Aceites esenciales, fenología e interacciones bióticas de la planta invasora Crassocephalum crepidioides (Asteraceae) en Costa Rica
Carlos Chaverri1,2![]() , Carlos O. Morales3
, Carlos O. Morales3![]() & José F. Cicció1,2
& José F. Cicció1,2![]()
1. Universidad de Costa Rica, Escuela de Química. 11501-2060 San José, Costa Rica; cachaverri@gmail.com; jfciccio@gmail.com
2. Universidad de Costa Rica, Centro de Investigaciones en Productos Naturales (CIPRONA). 11501-2060, San José, Costa Rica.
3. Universidad de Costa Rica, Escuela de Biología, Herbario USJ. 11501-2060, San José, Costa Rica; carlos.morales1264@gmail.com
Recibido 17-III-2022 Corregido 31-V-2022 Aceptado 18-VI-2022
DOI: https://doi.org/10.22458/urj.v14i2.4079
|
ABSTRACT. “Essential oils, phenology and biotic interactions of the invasive plant Crassocephalum crepidioides (Asteraceae) in Costa Rica”. Introduction: Crassocephalum crepidioides (Asteraceae) is an herbaceous species with outstanding ethnobotanical uses in Africa and elsewhere, that has extended invasively in several tropical and subtropical regions around the world. Objective: To identify the chemical composition of the essential oils of C. crepidioides, to observe and measure phenological parameters (growth and development), and to record signs of the interaction of plants with other biotic agents throughout the life cycle in the Central Valley of Costa Rica. Methods: The essential oils were obtained via hydrodistillation in a Clevenger-type apparatus. The chemical composition of the oils was done by capillary gas chromatography (GC/FID and GC/MS). The biological field study was a descriptive account of phenological patterns observed during a year in 45 plants from three places, including vegetative and reproductive phases. Results: The essential oils consisted mainly of terpenoids (91,0 to 98,6%). A total of 231 different compounds were identified in the analyzed samples, corresponding to 94,9-99,3% of the total amount of the oils. The major compounds from the leaf oil were myrcene (67,5%) and β-phellandrene (11,6%), while the stem oil mainly contained myrcene (42,2%) and α-copaene (16,5%). The major constituents of flower oil were myrcene (71,8%) and β-phellandrene (17,2%). In the root oil, (E)-β-farnesene (29,5-46,0%), (Z)-β-farnesene (13,0-15,7%) and (E)-caryophyllene (6,0-6,1%) predominated. The mean height of plants was considerably superior in open and sunny places compared to values in partially shaded habitats. In one of the places, 36% of plants died before completing the life cycle for the most part, due to herbivory that was present in more than 80% of all plants and damaged 100% of their shoot organs (stems, leaves, lateral buds, flower buds, and flowers). November and December were the months with maximal flower anthesis and fruit ripening. Conclusions: This species is recognized as annual, but 2/3 of plants completed their life cycle in 4 to 6 months, and due to herbivory and other environmental factors its propagation shows a considerable reduction.
Keywords: Crassocephalum crepidioides, Asteraceae, essential oils, myrcene, β-phellandrene, (E)-β-farnesene, phenology, annual plants, invasive species, herbivory.
|
RESUMEN. Introducción: Crassocephalum crepidioides (Asteraceae) es una especie herbácea con notables usos etnobotánicos en África y otras áreas, que se extendió como invasora en varias regiones tropicales y subtropicales del mundo. Objetivo: Determinar la composición química de los aceites esenciales de C. crepidioides (planta entera, hojas, tallos, flores y raíces), observar y medir parámetros fenológicos (crecimiento y desarrollo) y registrar indicios de interacción de las plantas con otros agentes bióticos a lo largo del ciclo de vida en el Valle Central de Costa Rica. Métodos: La extracción de los aceites se realizó mediante el procedimiento de hidrodestilación, usando un equipo Clevenger modificado. La composición química de los aceites se obtuvo mediante técnicas cromatográficas (GC/FID y GC/MS), el cálculo de los índices de retención en dos columnas de polaridad diferente y mediante los espectros de masa de cada constituyente. El estudio biológico de campo fue un registro descriptivo de patrones fenológicos observados durante un año en 45 plantas de tres sitios, abarcando las fases vegetativa y reproductiva. Resultados: Los aceites esenciales están constituidos principalmente por terpenoides (91,0-98,6%). Se identificaron en total 231 compuestos diferentes en todas las muestras analizadas, correspondientes a un 94,9-99,3% de los constituyentes totales. Los compuestos mayoritarios de los aceites de las hojas fueron mirceno (67,5%) y β-felandreno (11,6%), mientras que los aceites de los tallos registraron principalmente mirceno (42,2%) y α-copaeno (16,5%). Los constituyentes mayoritarios del aceite de las flores fueron mirceno (71,8%) y β-felandreno (17,2%). En los aceites de las raíces predominaron (E)-β-farneseno (46,0-29,5%), (Z)-β-farneseno (13,0-15,7%) y (E)-cariofileno (6,0-6,1%). La altura promedio de las plantas fue considerablemente mayor en sitios abiertos y soleados que en sitios parcialmente umbrosos. En sitios abiertos las hojas superiores desarrollaron lóbulos laterales profundos, que fueron nulos o raros en sitios sombreados. En uno de los sitios 36% de plantas murió antes de completar el ciclo de vida, principalmente por herbivoría, que afectó más de 80% de todas las plantas y dañó 100% de órganos del vástago. Noviembre y diciembre fueron los meses con máxima antesis floral y maduración de frutos. Conclusiones: Esta especie se reconoce como anual, pero 2/3 de las plantas observadas completaron su ciclo de vida en 4 a 6 meses y, debido a herbivoría y otros factores ambientales, su propagación se ha reducido notablemente.
Palabras clave: Crassocephalum crepidioides, Asteraceae, aceites esenciales, mirceno, β-felandreno, (E)-β-farneseno, fenología, plantas anuales, especies invasoras, herbivoría. |
Asteraceae (Compositae) es una de las familias más grandes de plantas floríferas de la actualidad; tiene distribución cosmopolita, incluye más de 1 600 géneros y ca. 24 000 especies aceptadas, la mayoría herbáceas y arbustivas (Funk et al., 2009; Panero & Crozier, 2012). Numerosas especies asteráceas son importantes ecológica y económicamente; unas en horticultura como ornamentales y como fuente de insecticidas, mientras que otras tienen gran significación como fuentes de medicinas herbarias, alimentos y especias.
El género Crassocephalum (tribu Senecioneae) consta de 20 a 24 especies distribuidas de modo natural en África, las Islas Mascareñas y la Península Arábiga (The Plant List, 2010; Royal Botanic Gardens Kew, (s.f.); Rodríguez, 2020). La especie herbácea anual Crassocephalum crepidioides (Benth.) S. Moore [sinónimo Gynura crepidioides Benth. - ver Belcher, 1955] es nativa de África tropical y subtropical, desde Senegal hasta Etiopía y por el sur hasta Sudáfrica, además de las islas de Madagascar y Mauricio (Lisowski, 1991; Denton, 2004). Esta especie se ha propagado y naturalizado en toda Asia tropical y subtropical, Australia, muchas de las islas del Pacífico tropical y en varias regiones de América. Tanto las hojas como los tallos se convierten en una verdura comestible en países africanos como Sierra Leona, Benín, Ghana, Nigeria y Camerún. Dairo y Adanlawo (2007), así como Adjatin et al. (2013) evaluaron la calidad nutricional (composición proximal, perfil de minerales, perfil de aminoácidos y vitamina C) de materiales procedentes de Nigeria y Benín, respectivamente. La literatura registra aplicaciones en la medicina tradicional de muchos países de África y Asia para curar heridas e indigestión (Lisowski, 1991; Denton, 2004). Algunas investigaciones indican que extractos de estas plantas pueden captar radicales libres y son hepatoprotectores (Aniya et al., 2005; Arawande et al., 2012). También se ha informado que el extracto acuoso de esta especie posee propiedades oncolíticas e inmunopotenciadoras (Tomimori, et al., 2012), actividad diurética (Fidèle et al., 2019) y el extracto metanólico al 80% mostró actividad antidiabética (Bahar et al., 2017). En relación con la fracción volátil de la planta, el aceite esencial obtenido de plantas frescas en India mostró actividad citotóxica contra tres líneas celulares cancerosas humanas (Thakur et al., 2019) y el aceite obtenido de partes aéreas en Vietnam mostró actividad larvicida contra mosquitos (Hung et al., 2019).
Esta especie se considera invasora en numerosos países; por eso está incluida en el “Global Compendium of Weeds” (Compendio Mundial de Arvenses) y ha sido clasificada como una de las hierbas más agresivas de las últimas décadas en las regiones tropicales y subtropicales (Randall, 2012). Crassocephalum crepidioides se recolectó por primera vez en el Nuevo Mundo en Hawái, en 1929. El primer espécimen hallado en Costa Rica procedía de Puntarenas y fue recolectado en 1993. En 2004 esta especie fue observada en la Cordillera Central de República Dominicana (1650 m de altitud) (Nordenstam, 2007). Al iniciar la primera década del siglo XXI era difícil observarla en el Valle Central de Costa Rica, pero según especímenes de herbario ya en 2004 era “maleza común en zonas verdes” del Jardín Botánico Lankester en Cartago (9°50’25” N, 83°53’25” W, 1360 m de altitud, M. Blanco 2662, USJ) y fuera del Valle Central en ese mismo año esta especie apareció en la vertiente atlántica, en un sitio notablemente distante y remoto, el “banco arenoso de una quebrada” en la Reserva Biológica Alberto Brenes, San Ramón de Alajuela (10°13’00” N, 84°37’00” W, 850 m, J. Gómez-Laurito 14281, USJ). Actualmente se halla en innumerables sitios abiertos, orillas de caminos, matorrales y terrenos abandonados de casi todas las regiones del país, según Rodríguez (2020) a altitudes entre 100 y 2000 m. Nuestras observaciones preliminares indican que algunas plantas de menos de 30 cm de altura florecen en pocos meses, mientras que otras alcanzan más de 1 m de altura y completan su ciclo en cerca de un año. Por eso será interesante hacer observaciones sobre el crecimiento de esta especie en Costa Rica y considerar algunos parámetros ambientales que pueden estar relacionados con el éxito de su propagación, o con su control natural. Las plantas observadas en Costa Rica en los últimos años con frecuencia muestran daños provocados por herbívoros y algunas manchas amarillas o grises.
Existen pocos informes científicos acerca de la fitoquímica de esta especie. Se informó sobre la presencia, en la parte aérea de plantas japonesas, de los alcaloides pirrolizidínicos jacobina y jacolina, que son característicos de plantas de Senecio, otro género asteráceo (Asada et al., 1985); se ha probado que la jacobina es un alcaloide hepatotóxico (Newman et al., 2015; Rozhon et al., 2017; Schramm et al., 2021). Existen pocos estudios en la literatura sobre componentes volátiles y están restringidos a Camerún (Zollo et al., 2000), India (Joshi, 2011; 2014; Thakur et al., 2019) y Vietnam (Hung et al., 2019). En la literatura se encuentran dos estudios adicionales, uno de Nigeria (Owokotomo et al., 2011) y otro de China (Wang et al., 2014), pero evidencian serios problemas metodológicos en la identificación de los constituyentes de los aceites. En la Tabla 1 se resumen los constituyentes principales de los aceites esenciales estudiados anteriormente, la parte de las plantas de donde se obtuvieron y los sitios de recolección.
TABLA 1
Estudios previos de la composición química de aceites esenciales obtenidos de Crassocephalum crepidioides (Asteraceae).
|
Sitio de recolecta |
Parte usada |
Constituyentes mayoritarios (%) |
Referencias |
|
Hojas frescas |
Zollo et al., 2000 |
||
|
Hojas frescas |
|||
|
Partes aéreas frescas |
|||
|
Flores frescas |
Mirceno (46,1%), β-felandreno (31,0%) y allo-aromadendreno (4,9%)
|
Joshi, 2011 |
|
|
Nigeria, estado de Ondo, Akure |
Hojas frescas |
Datos no fiables |
Owokotomo et al., 2012 |
|
Nigeria, estado de Ondo, Akure |
Tallos frescos |
Datos no fiables |
Owokotomo et al., 2012 |
|
Raíces frescas |
(E)-β-Farneseno (30,6%), α-humuleno (10,3%), (E)-cariofileno (7,2%), cis-β-guaieno (6,1%), α-bulneseno (5,3%), cipereno (3,7%), acetato de bornilo (3,5%), α-copaeno (3,5%), β-elemeno (3,4%) y β-chamigreno (3,0%) |
||
|
China, Guangzhou |
Hojas frescas |
Datos no fiables |
Wang et al., 2014 |
|
Partes aéreas frescas |
Mirceno (65,9 %), β-felandreno (8,8 %), y α-pineno (3,1 %) |
Thakur et al., 2019 |
|
|
Hojas (aireadas a 25°C) |
Hung et al., 2019 |
||
|
Tallos (aireados a 25°C). |
Mirceno (26,1 %), α-pineno (10,7 %), α-humuleno (5,9 %), (E)-β-farneseno (5,2 %), óxido de cariofileno (5,0 %), (E)-cariofileno (4,4 %), epóxido II de humuleno (3,8 %) y α-copaeno (3,2 %) |
Hung et al., 2019 |
|
|
Flores (aireadas a 25°C). |
Mirceno (43,3 %), β-felandreno (10,7 %), criptona (8,1 %), α-copaeno (3,3 %) y α-humuleno (3,1 %) |
Es de gran interés estudiar la composición química de los aceites esenciales de las diversas partes de esta especie, para contrastarla con los pocos datos de la literatura. Hasta donde nos es conocido, no existen informes anteriores sobre la composición química de esta especie creciendo en el Nuevo Mundo. Ese conocimiento podría ayudar a entender la abundancia de estas plantas y su rápida reproducción, como una de las especies invasoras más exitosas de las últimas décadas (Randall, 2012; y observaciones personales de los autores). Los objetivos principales de este estudio fueron determinar químicamente la composición de los aceites esenciales de esta hierba, observar y medir parámetros fenológicos (crecimiento y desarrollo) y registrar indicios de interacción de las plantas con otros agentes bióticos a lo largo del ciclo de vida en el Valle Central de Costa Rica.
MATERIALES Y MÉTODOS
Ubicación del estudio: El estudio se llevó a cabo en el cantón de Montes de Oca, situado en el Valle Central de Costa Rica, provincia de San José, que registra una estación lluviosa entre mayo y noviembre y una estación seca entre diciembre y abril, con precipitación promedio anual de 2300 mm y temperatura promedio anual de 22°C (Instituto Meteorológico Nacional [IMN], 2021).
Material vegetal: Para el estudio químico se obtuvo el material de dos sitios distintos: tallos, hojas, inflorescencias y raíces de Crassocephalum crepidioides se recolectaron en San Rafael de Montes de Oca (SRMO; 9°56’38’’ N, 84°01’00” W), a una elevación de 1335 m, y en la Reserva Ecológica Leonelo Oviedo, en el Campus de la Universidad de Costa Rica, distrito Mercedes, Montes de Oca (MMO; 9°56’05.80’’ N, 84°03’07.39” W), a 1210 m.
Para el estudio biológico, se marcaron, midieron y observaron 45 plantas en tres sitios distintos del Campus de la Universidad de Costa Rica: Sitio 1, invernadero del Jardín Botánico Orozco, distrito San Pedro, Montes de Oca (9°56’38’’ N, 84°01’00” W, 1213 m); sitio 2, un matorral en la Reserva Ecológica Finca 4 en el distrito Mercedes, Montes de Oca (9°56’ N, 84°02’ W, 1210-1215m); sitio 3, un matorral en la Reserva Ecológica Leonelo Oviedo (9°56’14’’ N, 84°02’59” W, 1209 m), distrito Mercedes, Montes de Oca. Se prepararon especímenes testigo de herbario en los sitios 2 (C.O. Morales 2486, USJ) y 3 (C.O. Morales 2491, USJ).
Extracción de los aceites esenciales: Los aceites se obtuvieron mediante la operación de hidrodestilación a presión atmosférica, durante 3 horas, empleando un equipo Clevenger modificado. Los aceites esenciales hidrodestilados se recolectaron y secaron sobre sulfato de sodio anhidro, se filtraron, envasaron y conservaron entre 0 y 10°C, en viales color ámbar, hasta su posterior análisis. Los rendimientos obtenidos con material fresco (v/masa): 0,06% (planta entera), 0,05% (hojas), 0,02% (tallos), 0,02% (raíces) y 0,01% (flores).
Cromatografía de gases con detector de ionización por llama (GC/FID): Los aceites esenciales de C. crepidioides se analizaron mediante cromatografía de gases con un detector de ionización por llama (GC/FID) empleando un cromatógrafo de gases Shimadzu, modelo GC-2014. Los datos se obtuvieron con una columna capilar de sílice fundida con una fase estacionaria de 5% fenil - 95% dimetilpolisiloxano (30m x 0,25mm de diámetro interno; espesor de película 0,25μm; MDN-5S, Supelco). Las integraciones de los cromatogramas se efectuaron empleando el sistema LabSolutions (software Shimadzu GC Solution, Chromatography Data System, versión 2,3). Las condiciones operativas usadas fueron: gas portador N2, a un flujo de 1,0 mL min-1; programa de temperatura del horno: (60-280°C a 3°C min-1, y a 280°C durante 2min; temperatura del puerto de inyección de 250°C; temperatura del detector 280°C; inyección con división de flujo (Split) 1:60.
Cromatografía de gases/espectrometría de masas (GC/EM): El análisis mediante cromatografía de gases acoplada a un detector selectivo de masas (GC/EM) se efectuó en un cromatógrafo de gases Shimadzu, modelo GC-17A acoplado a un equipo Shimadzu GCMS-QP5000 y utilizando el software CLASS 5000 con las bases de datos computadorizadas Wiley 139 y NIST. Los datos se obtuvieron con una columna capilar de sílice fundida con la fase estacionaria 5% fenil - 95% dimetilpolisiloxano (30m x 0,25mm de diámetro interno; grosor de película 0,25μm; MDN-5S de Supelco). Las condiciones de operación usadas fueron: He como gas portador, a un flujo de 1,0mL min-1; programa de temperatura del horno: 60-280°C a 3°C min-1; temperatura del puerto de inyección 250°C; temperatura del detector, 260°C; voltaje de ionización: 70eV; corriente de ionización, 60μA; velocidad de barrido 0,5s sobre un ámbito de 38 a 400Da; inyección con división de flujo (Split) 1:70. También, los datos se obtuvieron con una segunda columna polar con fase estacionaria de polietilenglicol (30m x 0,25mm; grosor de película 0,25μm; Supelcowax™10 de Supelco) con las siguientes condiciones experimentales: He como gas portador, flujo 1,4mL min-1; programa de temperatura del horno: 60–220°C a 3°C min-1; temperatura del puerto de inyección 240°C; temperatura del detector 260°C; temperatura de la línea de transferencia 230°C; voltaje de ionización: 70eV; corriente de ionización 60μA; velocidad de barrido 0,30s sobre un ámbito de masa de 35 a 400Da; inyección con división de flujo (Split) 1:70.
Identificación de los compuestos: La identificación de los constituyentes de los aceites esenciales se efectuó empleando índices de retención lineales, que se calcularon utilizando una serie homóloga de alcanos lineales, en dos columnas capilares distintas, una no polar (5% fenil - 95% dimetilpolisiloxano) y otra polar (polietilenglicol, Supelcowax™ 10) (van den Dool & Kratz, 1963), y mediante comparación de sus espectros de masas con los publicados en la literatura (Stenhagen, et al., 1974; Swigar & Silverstein, 1981; Adams, 2007), y con los de nuestra base de datos propia, o mediante la comparación de los espectros de masas con los disponibles en las bases de datos computadorizadas (NIST107 y Wiley139) o disponibles en la web (Wallace, 2019). Para la obtención de los índices de retención lineales de cada pico, se co-inyectó 0,1 μL de la mezcla constituida por la serie homóloga de alcanos lineales (Sigma, C8-C32), bajo las mismas condiciones experimentales descritas arriba. Para la obtención de los datos cuantitativos se integró el cromatograma total (GC/FID) expresado como porcentajes de área sin el uso de factores de corrección.
Estudio de campo: Para registrar y describir parámetros fenológicos, entre junio de 2016 y septiembre de 2018 se marcaron, midieron y observaron 45 plantas de esta especie en tres sitios del campus de la Universidad de Costa Rica: Sitio 1, veinticinco plantas en la estación lluviosa de 2016 (junio a diciembre) en el invernadero del Jardín Botánico Orozco, distrito San Pedro; sitio 2, diez plantas maduras, en floración y fructificación, a inicios de diciembre de 2017, en un matorral dominado por pasto de elefante (Pennisetum purpureum Schumach., Poaceae), que había sido cortado varios meses antes, en la Reserva Ecológica Finca 4 en el distrito Mercedes; sitio 3, diez plantas maduras floreciendo y fructificando en septiembre de 2018 en un matorral en la Reserva Ecológica Leonelo Oviedo, junto a las instalaciones de la Escuela de Biología en el distrito Mercedes. El invernadero del sitio 1 tenía un techo de malla metálica, abierto a los elementos; además, aunque tenía una pared en el lado este, el resto era abierto, con paredes de malla metálica y entrada natural de luz, aire y lluvia (entre mayo y noviembre). Vale indicar que había mucha sombra lateral de árboles y palmeras grandes (hasta ca. 25m de altura) en la periferia del invernadero. Allí las plantas de Crassocephalum crecieron de modo natural en bolsas y macetas de otras especies cultivadas. Los sitos 2 y 3 eran matorrales abiertos, soleados, con vegetación baja, dominada por gramíneas y otras plantas pioneras.
Solamente en el sitio 1 se observó el ciclo casi completo de las plantas marcadas, entre junio y diciembre de 2016. Cada mes se describió el desarrollo de ramas y hojas de las plantas marcadas, se midió la altura total de las plantas, longitud y anchura de hojas y se tomaron fotografías de diversas etapas de desarrollo. La fenología de la especie se registró en un ciclo de crecimiento hasta el tiempo de floración, fructificación y dispersión de frutos, incluyendo elongación y ramificación de tallos, producción de hojas, morfología de hojas, inicio de floración hasta la producción de frutos y su dispersión por el viento. Para llevar un registro de la interacción de cada planta marcada con otros agentes bióticos, se anotó en cada fecha de observación el número de hojas y tallos afectados por herbivoría, con cortes y perforaciones por insectos, así como marcas y manchas provocadas por otros organismos, y se estimó visualmente el porcentaje del área total afectada por herbivoría. En los sitios 2 y 3 se observó el desarrollo de inflorescencias, flores y frutos al final del ciclo de vida de las plantas. Vale aclarar que el estudio de campo fue descriptivo, más que cuantitativo.
RESULTADOS
Composición de los aceites esenciales: La composición química de los aceites esenciales obtenidos de la planta entera, flores y raíces de C. crepidioides, recolectada en San Rafael de Montes de Oca (SRMO), se resume en la Tabla 2. Se identificaron un total de 132 compuestos que representan más del 95% de la composición de los aceites hidrodestilados y que están constituidos principalmente por terpenos y terpenoides (más del 94%). El aceite esencial de la planta entera estuvo constituido casi por completo por hidrocarburos tanto monoterpénicos (65,4%) como sesquiterpénicos (30,7%). Los constituyentes principales fueron mirceno (51,2%), (Z)-β-farneseno (11,3%), β-felandreno (8,7%), α-copaeno (5,0%), (E)-β-farneseno (4,0%), germacreno D (3,4%) y α-pineno (3,1%) [ver el cromatograma de iones totales (TIC) en la Fig. 1]. En la composición del aceite esencial de flores predominaron los hidrocarburos monoterpénicos (92,6%), teniendo como componentes principales mirceno (71,8%) y β-felandreno (17,2%). En el aceite esencial de raíces (incluyendo en algunos casos la base rastrera y curvada del tallo), predominaron (E)-β-farneseno (46,0%), (Z)-β-farneseno (13,0%), (E)-cariofileno (6,0%), α-ylangeno (4,0%), β-longipineno (3,3%) y β-chamigreno (3,3%).
Los resultados de la composición química de los aceites esenciales obtenidos de hojas, tallos y raíces de C. crepidioides recolectada en la Reserva Ecológica Leonelo Oviedo (MMO) se resumen en la Tabla 3. Se identificaron un total de 175 compuestos, representando más del 95% de la composición de los aceites obtenidos. Los componentes principales del aceite esencial de las hojas fueron mirceno (67,5%) y β-felandreno (11,6%), seguidos por cantidades menores de α-copaeno (4,0%) y dauca-5,8-dieno (4,0%). En el aceite esencial de los tallos predominaron mirceno (42,2%) y α-copaeno (16,5%), acompañados por cantidades menores de α-pineno (6,3%), α-humuleno (5,8%), β-felandreno (3,7%) y (E)-cariofileno (3,3%). El aceite esencial obtenido de las raíces registró como compuestos principales (E)-β-farneseno (29,5%), (Z)-β-farneseno (15,7%), (E)-cariofileno (6,1%), α-pineno (5,8%), α-copaeno (5,8%), mirceno (4,5%), 4,11-selinadieno (4,0%) y α-gurjuneno (3,4%).
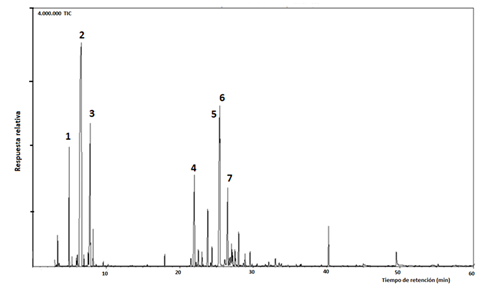
Fig. 1. Cromatograma GC/MS (TIC) del aceite esencial de plantas enteras de Crassocephalum crepidioides: 1. α-pineno; 2. mirceno; 3. β-felandreno; 4. α-copaeno; 5. (Z)-β-farneseno; 6. (E)-β-farneseno; 7. germacreno D.
TABLA 2
Composición química de los aceites esenciales de Crassocephalum crepidioides obtenidos de plantas recolectadas en San Rafael de Montes de Oca (SRMO), Costa Rica
|
Compuestoa |
IRb |
IRLitc |
Clase |
Planta entera (%) |
Flores (%) |
Raíces (%) |
MId |
|
(E)-Hex-2-en-1-ol |
790 |
792 |
A |
t |
|
|
1;2 |
|
(Z)-Hex-3-enal |
798 |
797 |
A |
0,4 |
t |
|
1;2 |
|
(E)-Hex-3-en-1-ol |
846 |
844 |
A |
t |
|
|
1;2 |
|
(E)-Hex-2-en-1-ol |
853 |
854 |
A |
t |
|
|
1;2 |
|
Hexan-1-ol |
864 |
865 |
A |
t |
t |
|
1;2;3 |
|
Heptanal |
900 |
901 |
A |
t |
|
|
1;2 |
|
Tricicleno |
920 |
921 |
M |
t |
|
|
1;2 |
|
Artemisia trieno |
923 |
923 |
M |
t |
|
|
1;2 |
|
α-Tuyeno |
925 |
924 |
M |
t |
t |
|
1;2 |
|
α-Pineno |
932 |
932 |
M |
3,1 |
1,5 |
0,4 |
1;2 |
|
Canfeno |
945 |
946 |
M |
0,2 |
t |
0,1 |
1;2 |
|
Sabineno |
970 |
969 |
M |
0,2 |
0,2 |
0,1 |
1;2 |
|
β-Pineno |
977 |
974 |
M |
0,4 |
0,1 |
0,4 |
1,2,3 |
|
Mirceno |
988 |
988 |
M |
51,2 |
71,8 |
1,6 |
1;2;3 |
|
Acetato de (E)-hex-3-en-1-ilo |
1002 |
1001 |
A |
t |
|
|
1;2 |
|
α-Felandreno |
1008 |
1002 |
M |
0,1 |
|
0,1 |
1;2 |
|
δ-3-Careno |
1009 |
1008 |
M |
|
0,6 |
|
1;2 |
|
α-Terpineno |
1016 |
1014 |
M |
t |
|
0,1 |
1;2 |
|
p-Cimeno |
1024 |
1022 |
M |
0,4 |
0,3 |
0,3 |
1;2 |
|
Limoneno |
1025 |
1024 |
M |
0,1 |
0,1 |
0,9 |
1;2;3 |
|
β-Felandreno |
1026 |
1025 |
M |
8,7 |
17,2 |
0,1 |
1;2 |
|
(Z)-β-Ocimeno |
1034 |
1032 |
M |
0,1 |
t |
0,5 |
1;2 |
|
(E)-β-Ocimeno |
1046 |
1044 |
M |
0,7 |
0,6 |
0,2 |
1;2 |
|
γ-Terpineno |
1057 |
1054 |
M |
0,1 |
|
0,2 |
1;2 |
|
Terpinoleno |
1088 |
1086 |
M |
0,1 |
0,2 |
0,1 |
1;2 |
|
p-Cimeneno |
1089 |
1089 |
M |
t |
|
0,1 |
1;2 |
|
Linalol |
1095 |
1095 |
MO |
t |
t |
|
1;2;3 |
|
Nonanal |
1100 |
1100 |
A |
0,1 |
0,1 |
t |
1;2 |
|
α-Fenchocanforona |
1103 |
1104 |
MO |
|
t |
|
1;2 |
|
p-Menta-1,3,8-trieno |
1106 |
1108 |
M |
t |
|
|
1;2 |
|
trans-Tuyona |
1112 |
1112 |
M |
|
|
t |
1;2 |
|
cis-p-Ment-2-en-1-ol |
1113 |
1113 |
MO |
t |
|
|
1;2 |
|
Hidrato de trans-pineno |
1116 |
1119 |
MO |
|
t |
|
1;2 |
|
Allo-ocimeno |
1126 |
1128 |
M |
t |
|
|
1;2 |
|
cis-p-Menta-2,8-dien-1-ol |
1130 |
1133 |
MO |
t |
|
|
1;2 |
|
trans-p-Ment-2-en-1-ol |
1134 |
1136 |
MO |
t |
|
|
1;2 |
|
Alcanfor |
1143 |
1141 |
MO |
t |
|
|
1;2;3 |
|
(E)-Non-2-en-1-al |
1149 |
1157 |
A |
t |
|
|
1;2 |
|
(2E,6Z)-Nona-2,6-dien-1-ol |
1158 |
1159 |
A |
t |
|
|
1;2 |
|
Borneol |
1164 |
1165 |
MO |
t |
|
0,2 |
1;2 |
|
Terpinen-4-ol |
1174 |
1174 |
MO |
t |
|
0,1 |
1;2;3 |
|
Criptona |
1186 |
1183 |
TI |
t |
|
|
1;2 |
|
α-Terpineol |
1192 |
1192 |
MO |
t |
|
t |
1;2;3 |
|
trans-Pulegol |
1210 |
1213 |
MO |
t |
|
|
1;2 |
|
neo-iso-Dihydrocarveol |
1229 |
1228 |
MO |
0,1 |
|
|
1;2 |
|
Éter metílico del timol |
1233 |
1232 |
MO |
t |
|
t |
1;2 |
|
Éter metílico del carvacrol |
1238 |
1241 |
MO |
- |
|
0,3 |
1;2 |
|
Acetato de isobornilo |
1284 |
1283 |
MO |
- |
|
1,0 |
1;2 |
|
Acetato de bornilo |
1285 |
1285 |
MO |
0,2 |
|
|
1;2 |
|
Timol |
1289 |
1290 |
MO |
t |
|
|
1;2 |
|
Silfineno |
1344 |
1345 |
S |
- |
|
t |
1;2 |
|
Acetato de α-terpinilo |
1347 |
1346 |
MO |
- |
|
t |
1;2 |
|
Eugenol |
1356 |
1356 |
PP |
t |
|
|
1;2;3 |
|
Acetato de nerilo |
1358 |
1359 |
MO |
t |
|
|
1;2 |
|
Ciclosativeno |
1366 |
1369 |
S |
- |
|
0,2 |
1;2 |
|
α-Ylangeno |
1373 |
1373 |
S |
0,2 |
0,1 |
4,0 |
1;2 |
|
Isoledeno |
1372 |
1374 |
S |
|
t |
|
1;2 |
|
α-Copaeno |
1376 |
1374 |
S |
5,0 |
1,4 |
|
1;2 |
|
β-Bourboneno |
1385 |
1387 |
S |
t |
|
|
1;2 |
|
β-Cubeneno |
1386 |
1386 |
S |
t |
|
|
1;2 |
|
β-Elemeno |
1391 |
1389 |
S |
0,4 |
|
2,0 |
1;2 |
|
β-Longipineno |
1403 |
1400 |
S |
|
|
3,3 |
1;2 |
|
α-Gurjuneno |
1411 |
1409 |
S |
0,4 |
|
0,1 |
1;2 |
|
(E)-Cariofileno |
1418 |
1417 |
S |
1,9 |
0,5 |
6,0 |
1;2;3 |
|
β-Copaeno |
1427 |
1430 |
S |
0,1 |
|
t |
1;2 |
|
α-trans-Bergamoteno |
1428 |
1432 |
S |
0,5 |
0,2 |
t |
1;2 |
|
γ-Elemeno |
1432 |
1434 |
S |
|
|
t |
1;2 |
|
(Z)-β-Farneseno |
1444 |
1440 |
S |
11,3 |
|
13,0 |
1;2 |
|
α-Humuleno |
1451 |
1452 |
S |
|
1,5 |
|
1;2;3 |
|
(E)-β-Farneseno |
1454 |
1454 |
S |
4,0 |
|
46,0 |
1;2 |
|
Alloaromadendreno |
1458 |
1458 |
S |
t |
|
|
1;2 |
|
9-epi-(E)-Cariofileno |
1464 |
1464 |
S |
|
t |
|
1;2 |
|
β-Chamigreno |
1479 |
1476 |
S |
|
|
3,3 |
1;2 |
|
Germacreno D |
1485 |
1484 |
S |
3,4 |
1,0 |
t |
1;2 |
|
β-Selineno |
1488 |
1489 |
S |
0,5 |
0,1 |
|
1;2 |
|
(Z,E)-α-Farneseno |
1494 |
1491 |
S |
0,9 |
|
2,4 |
1;2 |
|
(E,Z)-α-Farneseno |
1496 |
1498 |
S |
|
|
0,1 |
1;2 |
|
α-Selineno |
1499 |
1498 |
S |
|
0,3 |
0,1 |
1;2 |
|
α-Muuroleno |
1500 |
1500 |
S |
0,3 |
0,1 |
0,8 |
1;2 |
|
(E,E)-α-Farneseno |
1505 |
1505 |
S |
1,1 |
0,2 |
t |
1;2 |
|
β-Bisaboleno |
1507 |
1505 |
S |
t |
|
0,4 |
1;2 |
|
δ-Amorfeno |
1510 |
1511 |
S |
|
0,3 |
1,4 |
1;2 |
|
γ-Cadineno |
1514 |
1513 |
S |
t |
|
|
1;2 |
|
Cubebol |
1515 |
1514 |
SO |
|
t |
|
1;2 |
|
7-epi-α-selineno |
1522 |
1520 |
S |
|
0,2 |
|
1;2 |
|
δ-Cadineno |
1526 |
1522 |
S |
0,3 |
|
|
1;2 |
|
β-Sesquifelandreno |
1527 |
1521 |
S |
t |
|
0,2 |
1;2 |
|
Kessano |
1528 |
1529 |
SO |
t |
|
1,3 |
1;2 |
|
trans-Cadina-1,4-dieno |
1532 |
1533 |
S |
t |
|
|
1;2 |
|
Selina-3,7(11)-dieno |
1549 |
1545 |
S |
0,4 |
|
0,1 |
1;2 |
|
Germacreno B |
1562 |
1559 |
S |
t |
|
0,7 |
1;2 |
|
(E)-Nerolidol |
1563 |
1561 |
SO |
t |
|
t |
1;2 |
|
(E)-Dendrolasina |
1575 |
1570 |
SO |
|
|
t |
1;2 |
|
Óxido de cariofileno |
1580 |
1582 |
SO |
0,1 |
|
0,2 |
1;2 |
|
Ledol |
1601 |
1602 |
SO |
t |
|
|
1;2 |
|
Epóxido II de humuleno |
1609 |
1608 |
SO |
0,1 |
|
0,3 |
1;2 |
|
1,10-di-epi-Cubenol |
1614 |
1618 |
SO |
t |
|
|
1;2 |
|
iso-Leptospermona |
1621 |
1621 |
SO |
0,1 |
|
|
1;2 |
|
1-epi-Cubenol |
1627 |
1627 |
SO |
t |
|
|
1;2 |
|
epi-α-Cadinol |
1642 |
1638 |
SO |
0,2 |
|
|
1;2 |
|
epi-α-Muurolol |
1643 |
1640 |
SO |
t |
|
|
1;2 |
|
α-Muurolol (Torreyol) |
1646 |
1644 |
SO |
t |
|
1,0 |
1;2 |
|
α-Cadinol |
1654 |
1652 |
SO |
0,2 |
|
t |
1;2 |
|
Selin-11-en-4-α-ol |
1656 |
1658 |
SO |
t |
|
0,3 |
1;2 |
|
neo-Intermedeol |
1664 |
1658 |
SO |
0,1 |
|
- |
1;2 |
|
Intermedeol |
1666 |
1665 |
SO |
- |
|
0,2 |
1;2 |
|
(2Z,6Z)-Farnesal |
1686 |
1684 |
SO |
- |
|
0,1 |
1;2 |
|
Germacra-4(15),5,10(14)-trien-1-α-ol |
1687 |
1685 |
SO |
0,1 |
|
- |
1;2 |
|
2-Pentadecanona |
1695 |
1697 |
A |
- |
|
0.1 |
1;2 |
|
(2E,2Z)-Farnesal |
1712 |
1713 |
SO |
- |
|
t |
1;2 |
|
Pentadecanal |
1715 |
1715 |
A |
0,1 |
|
0,2 |
1;2 |
|
Sulfuro de menta |
1738 |
1740 |
Misc |
0,1 |
|
|
1;2 |
|
(2E,6E)-Farneseno |
1740 |
1740 |
S |
|
|
0,1 |
1;2 |
|
7-Acetoxi-elema-1,3-dien-8-ol |
1778 |
1786 |
SO |
|
|
t |
1;2 |
|
α-Eudesmol |
1787 |
1794 |
SO |
|
|
t |
1;2 |
|
Acetato de tetradecilo |
1811 |
1811 |
A |
t |
|
|
1;2 |
|
Hexadecanal |
1818 |
1818 |
A |
t |
|
|
1;2 |
|
Acetato de (2Z,6E)-farnesilo |
1820 |
1821 |
SO |
|
|
0,2 |
1;2 |
|
Neofitadieno |
1836 |
1830 |
D |
0,8 |
|
|
1;2 |
|
Hexahidrofarnesil acetona |
1840 |
1843 |
TI |
t |
|
|
1;2 |
|
Farnesilacetona |
1911 |
1913 |
TI |
t |
|
|
1;2 |
|
Sandaracopimara-8(14),15-dieno |
1969 |
1968 |
D |
t |
|
|
1;2 |
|
Ácido hexadecanoico |
1971 |
1973 |
A |
t |
|
|
1;2;3 |
|
(Z,E)-Geranil linalol |
1997 |
1998 |
D |
t |
|
|
1;2 |
|
(E,E)-Geranil linalol |
2020 |
2026 |
D |
|
|
t |
1;2 |
|
Octadecanol |
2077 |
2077 |
A |
t |
|
|
1;2 |
|
(E)-Fitol |
2108 |
2109 |
D |
0,5 |
|
|
1;2 |
|
(Z)-Fitol |
2116 |
2114 |
D |
|
|
0,3 |
1,2,3 |
|
Tricosano |
2300 |
2300 |
A |
t |
|
|
1;2;3 |
|
Pentacosano |
2500 |
2500 |
A |
t |
|
|
1;2;3 |
|
Heptacosano |
2700 |
2700 |
A |
t |
|
|
1;2;3 |
|
Escualeno |
2829 |
2833 |
T |
t |
|
|
1;2 |
|
Total |
|
|
|
99,3 |
98,6 |
95,2 |
|
|
Clase de compuesto |
|
|
|
|
|
|
|
|
Hidrocarburos monoterpénicos (M) |
|
|
|
65,4 |
92,6 |
5,2 |
|
|
Monoterpenos oxigenados (MO) |
|
|
|
0,3 |
t |
1,6 |
|
|
Hidrocarburos sesquiterpénicos (S) |
|
|
|
30,7 |
5,9 |
84,2 |
|
|
Sesquiterpenos oxigenados (SO) |
|
|
|
0,9 |
t |
3,6 |
|
|
Compuestos alifáticos (A) |
|
|
|
0,6 |
O,1 |
0,3 |
|
|
Terpenoides irregulares (TI) |
|
|
|
t |
|
|
|
|
Diterpenos (D) |
|
|
|
1,3 |
|
0,3 |
|
|
Triterpenos (T) |
|
|
|
t |
|
|
|
|
Otros |
|
|
|
0,1 |
|
|
|
aCompuestos listados en orden de elución en una columna tipo 5% fenil - 95% dimetilpolisiloxano. bIR = Índice de retención en relación con una serie homóloga de C8-C32 n-alcanos en una columna tipo 5% fenil - 95% dimetilpolisiloxano. cIRLit = Índice de retención en DB-5 (Adams, 2007; Wallace, 2019). dMétodo de identificación: 1 = Índice de retención experimental; 2 = Espectro de masa (MS); 3 = Estándar. t = Trazas (<0,05%). Compuestos mayoritarios en negritas.
TABLA 3
Composición química de los aceites esenciales de Crassocephalum crepidioides obtenidos de plantas recolectadas en Mercedes de Montes de Oca (MMO), Costa Rica.
|
Compuestoa |
IRb |
IRLitc |
IRd |
Clase |
Hojas (H) % |
Tallos (T) % |
Raíces (R) % |
MIe |
|
(Z)-Hex-3-en-1-ol |
|
797 |
1385 (H) |
A |
|
|
|
2;3 |
|
Hexanal |
|
801 |
1092 (H,T) |
A |
|
|
|
2;3 |
|
(E)-Hex-2-enal |
847 |
846 |
1225 (H,T) |
A |
0,4 |
t |
|
1;2;3 |
|
(E)-Hex-2-en-1-ol |
854 |
854 |
1408 (H) |
A |
t |
|
|
1;2;3 |
|
Hexan-1-ol |
862 |
863 |
1353 (H,T) |
A |
t |
|
|
1;2;3 |
|
Nonano |
900 |
900 |
|
A |
|
t |
t |
1;3 |
|
Heptanal |
901 |
901 |
1191 (R) |
A |
|
t |
t |
1;2;3 |
|
Tricicleno |
920 |
921 |
|
M |
t |
t |
t |
1;3 |
|
Artemisia trieno |
924 |
923 |
|
M |
|
t |
|
1;3 |
|
α-Tuyeno |
926 |
924 |
|
M |
t |
t |
t |
1;3 |
|
α-Pineno |
933 |
932 |
1040 (H,T,R) |
M |
0,3 |
6,3 |
5,8 |
1;2;3;4 |
|
Canfeno |
948 |
946 |
1078 (H,T,R) |
M |
|
0,2 |
0,6 |
1;2;3 |
|
Sabineno |
971 |
969 |
1126 (H,T,R) |
M |
0,1 |
0,2 |
0,5 |
1;2;3 |
|
Oct-1-en-3-ol |
|
974 |
1452 (H,R) |
A |
|
|
|
2;3 |
|
β-Pineno |
976 |
974 |
1115 (H,T,R) |
M |
0,1 |
0,3 |
1,4 |
1;2;3;4 |
|
Octan-3-ona |
|
979 |
1255 (R) |
A |
|
|
|
2;3 |
|
2-Pentil furano |
|
984 |
1233 (T,R) |
Misc |
|
|
|
2;3 |
|
Mirceno |
991 |
988 |
1177 (H,R) |
M |
67,5 |
42,2 |
4,5 |
1;2;3;4 |
|
trans-2,6-Dimetilocta-2,6-dieno |
|
990 |
1404 (H,T) |
M |
|
|
|
2;3 |
|
α-Felandreno |
1005 |
1002 |
|
M |
0,1 |
|
0,1 |
2;3 |
|
α-Terpineno |
1016 |
1014 |
1183 (R) |
M |
t |
|
t |
1;2;3 |
|
p-Cimeno |
1023 |
1022 |
1274 (H,T,R) |
M |
0,4 |
0,3 |
0,6 |
1;2;3 |
|
Limoneno |
1024 |
1024 |
1206 (H,T,R) |
M |
|
t |
t |
1;2;3 |
|
β-Felandreno |
1030 |
1025 |
1217 (H,T,R) |
M |
11,6 |
3,7 |
2,0 |
1;2;3;4 |
|
1,8-Cineol |
|
1026 |
1201 (H) |
MO |
|
|
|
2;3 |
|
(Z)-β-Ocimeno |
1035 |
1032 |
1238 (H,T,R) |
M |
0,1 |
t |
0,7 |
1;2;3 |
|
(E)-β-Ocimeno |
1045 |
1044 |
1255 (H,T,R) |
M |
0,4 |
t |
0,2 |
1;2;3 |
|
γ-Terpineno |
1057 |
1054 |
1246 (T,R) |
M |
t |
t |
0,1 |
1;2;3 |
|
Terpinoleno |
1088 |
1086 |
1285 (H,T,R) |
M |
0,1 |
0,1 |
t |
1;2;3 |
|
p-Cimeneno |
|
1089 |
1519 (T) |
M |
|
|
t |
2;3 |
|
(Z)-Dietoxi-hex-3-eno |
1089 |
1090 |
|
A |
|
t |
|
1;3 |
|
6,7-Epoximirceno |
1092 |
1090 |
1411 (R) |
MO |
0,1 |
0,1 |
|
1;2;3 |
|
Linalol |
1094 |
1095 |
1552 (H,T,R) |
MO |
0,1 |
|
0,1 |
1;2;3;4 |
|
Hidrato de trans-sabineno |
1099 |
1098 |
|
MO |
|
|
t |
1;3 |
|
Nonanal |
1100 |
1100 |
1396 (H,T) |
A |
0,1 |
t |
t |
1;2;3 |
|
Perilleno |
1100 |
1102 |
1421 (H,T,R) |
M |
|
0,2 |
|
1;2;3 |
|
p-Menta-1,3,8-trieno |
1106 |
1108 |
|
M |
|
|
t |
1;3 |
|
cis-p-Ment-2-en-1-ol |
1114 |
1118 |
1610 (H) |
MO |
t |
t |
t |
1;2;3 |
|
p-Menta-1,5,8-trieno |
1122 |
1128 |
|
M |
t |
|
t |
1;3 |
|
trans-Ment-2-en-1-ol |
1134 |
1136 |
1559 (H) |
MO |
|
t |
|
1;2;3 |
|
trans-Car-3-en-2-ol |
1140 |
1136 |
|
MO |
t |
|
t |
1;3 |
|
cis-Verbenol |
1137 |
1137 |
|
MO |
|
t |
|
1;3 |
|
exo-Isocitral |
1146 |
1140 |
|
M |
t |
|
|
1;3 |
|
Alcanfor |
1147 |
1141 |
1504 (R) |
MO |
|
|
0,1 |
1;2;3 |
|
Óxido de β-Pineno |
1156 |
1154 |
|
MO |
t |
|
|
1;3 |
|
(E)-Non-2-en-1-al |
1157 |
1157 |
|
A |
|
t |
t |
1;3 |
|
Borneol |
1170 |
1165 |
1695 (R) |
MO |
|
|
0,2 |
1;2;3 |
|
Terpinen-4-ol |
1178 |
1174 |
1598 (H,T,R) |
MO |
t |
t |
0,1 |
1;2;3 |
|
Criptona |
1186 |
1183 |
|
TI |
0,1 |
0,1 |
|
1;3 |
|
α-Terpineol |
1190 |
1192 |
|
MO |
|
t |
t |
1;3 |
|
cis-Piperitol |
1196 |
1195 |
|
MO |
|
|
t |
1;3 |
|
Decanal |
1200 |
1201 |
|
A |
|
t |
t |
1;3;4 |
|
trans-Piperitol |
1207 |
1207 |
|
MO |
t |
t |
t |
1;3 |
|
(2E,4E)-Nona-2,4-dienal |
1215 |
1212 |
|
A |
|
|
t |
1;3 |
|
β-Ciclocitral |
1214 |
1217 |
1610 (H) |
M |
t |
|
|
1;2;3 |
|
Nerol (cis-Geraniol) |
1221 |
1227 |
1798 (H) |
MO |
t |
|
|
1;2;3 |
|
Éter metílico del timol |
1229 |
1232 |
1593 (H,R) |
MO |
t |
t |
0,3 |
1;2;3 |
|
Neral |
1235 |
1235 |
|
MO |
t |
|
|
1;3 |
|
Aldehído cumínico |
1230 |
1238 |
|
MO |
|
t |
|
1;3 |
|
Geraniol (trans-nerol) |
1250 |
1249 |
1847 (H) |
MO |
|
|
|
1;2;3 |
|
Geranial |
1262 |
1264 |
|
MO |
t |
|
|
1;3 |
|
Felandral |
1271 |
1274 |
|
MO |
t |
t |
|
1;3 |
|
Acetato de isobornilo |
1282 |
1283 |
|
MO |
t |
0,2 |
|
1;3 |
|
α-Terpinen-7-al |
1285 |
1283 |
1772 (H) |
MO |
t |
t |
|
1;2;3 |
|
Acetato de bornilo |
1285 |
1287 |
1573 (H,T,R) |
MO |
|
t |
0,7 |
1;2;3 |
|
p-Cimen-7-ol |
1289 |
1289 |
2091 (H) |
MO |
|
t |
|
1;2;3 |
|
(2E,4Z)-Deca-2,4-dienal |
1290 |
1292 |
|
A |
|
t |
|
1;3 |
|
(2E,4E)-Deca-2,4-dienal |
1315 |
1315 |
|
A |
|
t |
t |
1;3 |
|
3-Oxo-p-ment-1-en-7-al |
1335 |
1330 |
|
MO |
t |
|
|
1;3 |
|
α-Cubebeno |
1345 |
1345 |
|
S |
t |
|
t |
1;3 |
|
Acetato de nerilo |
1356 |
1359 |
1726 (H) |
MO |
t |
t |
|
1;2;3 |
|
Ciclosativeno |
1368 |
1369 |
1470 (H,T,R) |
S |
0,2 |
0,7 |
0,3 |
1;2;3 |
|
α-Ylangeno |
1372 |
1373 |
|
S |
t |
|
|
1;3 |
|
Isoledeno |
|
1374 |
1530 (T) |
S |
|
|
t |
2;3 |
|
α-Copaeno |
1378 |
1374 |
1489 (H,T,R) |
S |
4,0 |
16,5 |
5,8 |
1;2;3 |
|
Acetato de geranilo |
|
1379 |
1756 (H) |
MO |
|
|
|
2;3 |
|
β-Bourboneno |
1385 |
1387 |
1510 (H,T) |
S |
t |
t |
|
1;2;3 |
|
β-Cubebeno |
1387 |
1387 |
1531 (H) |
S |
t |
t |
|
1;2;3 |
|
β-Elemeno |
1388 |
1389 |
|
S |
0,2 |
t |
1,3 |
1;3 |
|
Sativeno |
1392 |
1390 |
1515 (H) |
S |
0,2 |
t |
|
1;2;3 |
|
(Z)-Cariofileno |
|
1408 |
1585 (H,R) |
S |
|
|
|
2;3 |
|
α-Gurjuneno |
1406 |
1409 |
1519 (H,T,R) |
S |
t |
0,2 |
3,4 |
1;2;3 |
|
α-cis-Bergamoteno |
|
1411 |
1728 (R) |
S |
|
|
|
2;3 |
|
(E)-Cariofileno |
1418 |
1417 |
1587 (H,T,R) |
S |
0,7 |
3,3 |
6,1 |
1;2;3;4 |
|
β-Ylangeno |
|
1419 |
1419 (H) |
S |
|
|
|
2;3 |
|
2,5-Dimetoxi-p-cimeno |
|
1424 |
1866 (H,R) |
MO |
|
|
|
2;3 |
|
β-Copaeno |
1425 |
1430 |
|
S |
0,1 |
|
t |
1;3 |
|
α-trans-Bergamoteno |
1431 |
1432 |
1581 (H,T) |
S |
0,2 |
1,1 |
0,3 |
1;2;3 |
|
β-Elemeno |
1428 |
1434 |
|
S |
|
0,1 |
|
1;3 |
|
α-Guaieno |
|
1437 |
1677 (R) |
S |
|
|
|
2;3 |
|
6,9-Guaiadieno |
|
1442 |
1532 (R) |
S |
|
|
|
2;3 |
|
α-Humuleno |
1450 |
1452 |
1659 (H,T,R) |
S |
2,2 |
5,8 |
|
1;2;3;4 |
|
Geranil acetona |
|
1453 |
1849 (H) |
TI |
|
|
|
2;3 |
|
(Z)-β-Farneseno |
1453 |
1454 |
1670 (H,T,R) |
S |
|
t |
15,7 |
1;2;3 |
|
α-Patchouleno |
1451 |
1454 |
|
S |
0,1 |
|
|
1;3 |
|
(E)-β-Farneseno |
1459 |
1457 |
|
S |
|
|
29,5 |
1;3 |
|
Rotundeno |
1460 |
1457 |
1621 (R) |
S |
|
|
t |
1;2;3 |
|
allo-Aromadendreno |
1458 |
1458 |
1631 (H,T,R) |
S |
|
0,2 |
|
1;2;3 |
|
epi-Biciclosesquifelandreno |
|
1469 |
1606 (H) |
S |
|
|
|
2;3 |
|
Dodecanol |
|
1469 |
1966 (R) |
A |
|
|
|
2;3 |
|
Dauca-5,8-dieno |
1468 |
1471 |
|
S |
4,0 |
|
- |
1;3 |
|
4,11-Selinadieno |
1477 |
1473 |
|
S |
|
|
4,0 |
1;3 |
|
γ-Gurjuneno |
|
1475 |
1641 (T) |
S |
|
|
|
2;3 |
|
γ-Muuroleno |
1471 |
1478 |
1701 (H,T) |
S |
|
t |
|
1,2 |
|
ar-Curcumeno |
|
1479 |
1767 (R) |
S |
|
|
|
2;3 |
|
γ-Curcumeno |
|
1481 |
1688 (R) |
S |
|
|
|
2;3 |
|
α-Amorfeno |
|
1483 |
1477 (R) |
S |
|
|
|
2;3 |
|
Germacreno D |
1478 |
1484 |
|
S |
|
0,4 |
0,3 |
1;3 |
|
(E)-β-Ionona |
|
1487 |
1922 (H,T) |
TI |
|
|
|
2;3 |
|
β-Selineno |
1486 |
1489 |
1705 (H,T,R) |
S |
|
0,5 |
|
1;2;3 |
|
Eremofileno |
1489 |
1489 |
1701 (R) |
S |
|
|
1,6 |
1;2;3 |
|
cis-β-Guaieno |
|
1492 |
1519 (R) |
S |
|
|
|
2;3 |
|
Viridifloreno |
1493 |
1496 |
|
S |
0,1 |
|
|
1;3 |
|
α-Selineno |
1500 |
1498 |
1710 (H,T,R) |
S |
t |
0,7 |
0,7 |
1;2;3 |
|
α-Muuroleno |
1500 |
1500 |
1715 (H,R) |
S |
0,7 |
|
0,5 |
1;2;3 |
|
β-Bisaboleno |
1509 |
1505 |
1722 (R) |
S |
|
|
1,4 |
1;2;3 |
|
Germacreno A |
1504 |
1508 |
|
S |
|
0,1 |
|
1;3 |
|
γ-Cadineno |
1513 |
1513 |
|
S |
0,1 |
0,1 |
0,2 |
1;3 |
|
Cubebol |
|
1514 |
1875 (H,R) |
SO |
|
|
|
2;3 |
|
trans-Calameneno |
|
1521 |
1817 (T) |
S |
|
|
|
2;3 |
|
β-Sesquifelandreno |
1521 |
1521 |
1761 (R) |
S |
|
|
t |
1;2;3 |
|
δ-Cadineno |
1521 |
1522 |
1748 (H,T,R) |
S |
0,1 |
2,1 |
1,4 |
1;2;3 |
|
cis-Calameneno |
|
1528 |
2105 (R) |
S |
|
|
|
2;3 |
|
Kessano |
1528 |
1529 |
|
SO |
|
|
t |
1;3 |
|
(Z)-Nerolidol |
|
1531 |
2040 (H) |
SO |
|
|
|
2;3 |
|
α-Cadineno |
1541 |
1537 |
1776 (H) |
S |
t |
|
|
1;2;3 |
|
α-Calacoreno |
|
1544 |
1896 (H,R) |
S |
|
|
|
2;3 |
|
Selina-3,7(11)-dieno |
1543 |
1545 |
1761 (H,T) |
S |
0,1 |
1,3 |
|
1;2;3 |
|
Germacreno B |
1555 |
1559 |
1807 (H,T,R) |
S |
t |
1,0 |
0,1 |
1;2;3 |
|
(E)-Nerolidol |
1560 |
1561 |
2040 (T,R) |
SO |
t |
0,2 |
0,2 |
1;2;3;4 |
|
β-Calacoreno |
|
1564 |
1938 (T) |
S |
|
|
|
2;3 |
|
Dendrolasina |
1568 |
1570 |
1930 (R) |
SO |
|
|
0,1 |
1;2;3 |
|
Espatulenol |
1574 |
1577 |
2107 (H) |
SO |
0,1 |
|
|
1;2;3 |
|
Óxido de cariofileno |
1581 |
1582 |
1954 (H,T,R) |
SO |
0,1 |
0,7 |
0,6 |
1;2;3 |
|
β-Copaen-4α-ol |
|
1590 |
2149 (T) |
SO |
|
|
|
2;3 |
|
Epóxido II de humuleno |
1611 |
1608 |
2009 (H,T,R) |
SO |
0,1 |
0,8 |
0,7 |
1;2;3 |
|
Tetradecanal |
1612 |
1611 |
1917 (R) |
A |
|
|
0,1 |
1;2;3 |
|
Junenol |
1624 |
1618 |
2022 (H) |
SO |
t |
|
|
1;2;3 |
|
1-epi-Cubenol |
|
1627 |
2044 (H) |
SO |
|
|
|
2;3 |
|
epi-α-Cadinol |
1640 |
1638 |
2156 (H,T,R) |
SO |
|
0,4 |
1,0 |
1;2;3 |
|
epi-α-Muurolol |
1632 |
1640 |
2171 (H,R) |
SO |
t |
|
|
1;2;3 |
|
α-Muurolol |
1636 |
1644 |
2183 (T) |
SO |
t |
|
|
1;2;3 |
|
β-Eudesmol |
|
1649 |
2207 (T) |
SO |
|
|
|
2;3 |
|
α-Cadinol |
1644 |
1652 |
2214 (H,R) |
SO |
0,2 |
|
t |
1;2;3 |
|
Selin-11-en-4-ol |
1657 |
1658 |
2232 (R) |
SO |
|
|
0,4 |
1;2;3 |
|
neo-Intermedeol |
1662 |
1658 |
|
SO |
|
|
0,2 |
1;3 |
|
Tetradecanol |
1677 |
1671 |
|
A |
|
|
0,1 |
1;3 |
|
Mustakona |
1678 |
1676 |
|
SO |
|
t |
|
1;3 |
|
Eudesma-4(15),7-dien-1β-ol |
1686 |
1687 |
|
SO |
|
|
t |
1;3 |
|
β-Sinensal |
1692 |
1699 |
|
SO |
|
|
t |
1;3 |
|
Pentadecanal |
1713 |
1717 |
2021 (T,R) |
A |
|
0,2 |
0,3 |
1;2;3 |
|
Eremofilona |
1742 |
1734 |
|
SO |
|
|
0,3 |
1;3 |
|
Sulfuro de menta |
1742 |
1740 |
2122 (H) |
SS |
0,1 |
|
|
1;2;3 |
|
Ácido tetradecanoico |
1762 |
1765 |
2786 (T,R) |
A |
|
0,1 |
0,1 |
1;2;3 |
|
epi-Ciclocolorenona |
|
1774 |
2067 (R) |
SO |
|
|
|
2;3 |
|
Neofitadieno |
1835 |
1839 |
1926 (T) |
D |
1,1 |
0,4 |
|
1;2;3 |
|
Hexahidrofarnesil acetona |
1838 |
1843 |
|
TI |
|
t |
|
1;3 |
|
Acetato de (2E,6E)-farnesilo |
|
1845 |
2221 (R) |
SO |
|
|
|
2;3 |
|
Ácido pentadecanoico |
1860 |
1867 |
2894 (T,R) |
A |
|
0,1 |
0,1 |
1;2;3 |
|
(5E,9E)-Farnesil acetona |
1905 |
1913 |
2365 (T) |
TI |
|
t |
|
1;2;3 |
|
Hexadecanoato de metilo |
1922 |
1921 |
2213 (T) |
A |
|
t |
|
1;2;3;4 |
|
Ácido (E)-9-hexadecanoico |
1939 |
1940 |
|
A |
|
|
0,1 |
1;3 |
|
(E)-Fitol |
|
1942 |
2613 (H) |
D |
|
|
|
2;3 |
|
Ácido (Z)-9-hexadecanoico |
1949 |
1952 |
|
A |
|
|
0,1 |
1,2 |
|
Ácido hexadecanoico |
1971 |
1970 |
2979 (H,T,R) |
A |
0,2 |
2,1 |
1,0 |
1;2;3;4 |
|
Hexadecanoato de etilo |
1989 |
1993 |
2253 (T) |
A |
|
0,4 |
|
1;2;3 |
|
(Z,E)-Geranil linalol |
1998 |
1998 |
|
D |
|
t |
|
1;3 |
|
Linoleato de metilo |
2087 |
2095 |
2484 (T) |
A |
|
0,1 |
|
1;2;3;4 |
|
Oleato de metilo |
2094 |
2095 |
2473 (T) |
A |
|
0,1 |
|
1;2;3;4 |
|
(Z)-Fitol |
2106 |
2107 |
2614 (T,R) |
D |
|
0,5 |
0,2 |
1;2;3 |
|
Estearato de metilo |
2128 |
2128 |
|
A |
|
t |
|
1;3;4 |
|
Ácido linoleico |
2130 |
2132 |
|
A |
|
0,2 |
t |
1;3;4 |
|
Ácido oleico |
2137 |
2141 |
|
A |
|
0,1 |
|
1;3;4 |
|
Linoleato de etilo |
2155 |
2159 |
2530 (T) |
A |
|
0,3 |
|
1;2;3 |
|
Linolenato de etilo |
2161 |
2166 |
2583 (T) |
A |
|
0,2 |
|
1;2;3 |
|
Total |
|
|
|
|
96,4 |
94,9 |
96,2 |
|
|
Clase de compuesto |
|
|
|
|
|
|
|
|
|
Hidrocarburos monoterpénicos (M) |
|
|
|
|
80,7 |
53,5 |
16,5 |
|
|
Monoterpenos oxigenados (MO) |
|
|
|
|
0,2 |
0,3 |
1,5 |
|
|
Hidrocarburos sesquiterpénicos (S) |
|
|
|
|
13,0 |
34,1 |
72,6 |
|
|
Sesquiterpenos oxigenados (SO) |
|
|
|
|
0,5 |
2,1 |
3,5 |
|
|
Compuestos alifáticos (A) |
|
|
|
|
0,7 |
3,9 |
1,9 |
|
|
Terpenoides irregulares (TI) |
|
|
|
|
0,1 |
0,1 |
|
|
|
Diterpenos (D) |
|
|
|
|
1,1 |
0,9 |
0,2 |
|
|
Sesquiterpeno azufrado (SS) |
|
|
|
|
0,1 |
|
|
|
aCompuestos listados en orden de elución en una columna tipo 5 % fenil - 95 % dimetilpolisiloxano. bIR = Índice de retención en relación con una serie homóloga de C8-C32 n-alcanos en una columna tipo 5 % fenil - 95 % dimetilpolisiloxano. cIRLit = Índice de retención en DB-5 (Adams, 2007; Wallace, 2019). dIR = Índice de retención en Supelcowax 10™. eMétodo de identificación: 1 = Índice de retención experimental (DB-5); 2 = Índice de retención experimental (Supelcowax 10™); 3 = Espectro de masa (MS); 4 = Estándar. t = Trazas (<0,05 %). Compuestos mayoritarios en negritas. Nota: Los datos porcentuales fueron determinados únicamente en la columna tipo DB-5.
Estudio de campo: La mayoría de las plantas observadas empezaron su desarrollo entre mayo y junio. El crecimiento vegetativo se prolongó hasta agosto y septiembre, con aumento evidente de los parámetros medidos de altura de las plantas y longitud más anchura de las hojas. Al final de este período generalmente cesó el crecimiento vegetativo en el tallo principal y aparecieron los primeros botones florales, tanto en tallo principal como en ramas laterales. En el sitio 1 se hicieron las mediciones indicadas una vez por mes en junio, julio, agosto y septiembre; sin embargo, a partir de octubre no se midieron tallos ni hojas por estar muy dañados por herbivoría. Además, entre octubre y diciembre la mayoría de las plantas desarrollaron principalmente inflorescencias e infrutescencias.
Plantas en activo crecimiento generalmente tienen el tallo de color morado en los 8 a 12cm basales. La base es a menudo rastrera y curvada, como en jota (J), y tiene casi siempre raíces caulinares de soporte, pivotantes, en uno o más nudos, sobre todo si el tallo crece inclinado. Un par de cotiledones opuestos son evidentes todavía en plantas de dos meses (Fig. 2A); en general se secan y caen pronto, o sufren por herbivoría, o bien se secan, se ponen amarillos y permanecen, en ocasiones solo uno, pero en plantas de unos tres meses ya no existen rastros de cotiledones.
En el sitio 1 (invernadero) los cotiledones midieron (junio y julio) 0,9 - 1,3cm de largo y 0,5 – 0,7cm de ancho (n = 16). En algunas plantas pronto se perdió un cotiledón y en el mismo nudo se desarrollaron raíces caulinares opuestas al cotiledón presente.
La altura promedio de las plantas del sitio 1 fue 12,0cm [ámbito: (1,6-) 2,5 – 24,9 (n = 24)] a finales de junio y 56cm [ámbito: (12,4-) 18,2 – 106 (n = 22)] a finales de septiembre; esto significa que en promedio esas plantas aumentaron la altura 4,7 veces en 3 meses. Las plantas de los sitios 2 y 3 (ambos matorrales abiertos y soleados) midieron en promedio 111cm [ámbito: 43 – 160cm] a inicios de diciembre.
Las primeras 2 a 5 hojas que se forman después de los cotiledones fueron más pequeñas, más redondeadas, más enteras y aparentemente más delgadas que las hojas maduras. En el sitio 1 las láminas de hojas maduras alcanzaron en promedio 10,6 cm de largo [ámbito: (2,4-) 5,3 – 18,7cm] y 4,4cm de ancho [ámbito: (1,1-) 2,2 – 7,7cm] (n = 22). Además, en promedio se desarrollaron 20 hojas por planta [ámbito: (8-) 13 – 38] a lo largo de su ciclo anual (n = 22; Fig. 2B). A medida que las plantas crecen, especialmente hasta producir las primeras inflorescencias, las hojas inferiores se secan y las de la parte media del tallo aparecen dañadas con manchas grises desde los bordes, pero no desarrollan lóbulos. En matorrales bajos y abiertos expuestos al sol (sitios 2 y 3) se observó que las hojas maduras de la parte superior de las plantas desarrollaron lóbulos laterales profundos, mientras en el sitio 1 con abundante sombra lateral muy pocas hojas desarrollaron uno o más lóbulos pequeños (Fig. 2C, F).

Fig. 2. Desarrollo de Crassocephalum crepidioides (Asteraceae). A: planta juvenil todavía con cotiledones cerca de la base del tallo; B: desarrollo de hojas en una planta sana (escala en cm); C: hoja con un solo lóbulo basal (escala en cm); D: planta moderadamente dañada por herbivoría; E: planta severamente dañada por herbivoría; F: planta con hojas superiores profundamente lobuladas, en matorral abierto y soleado; G: hábito de dos plantas maduras con inflorescencias nutantes; H: detalle de capítulos con flores en antesis y algunos botones florales. (Fotos de COM).
En el sitio 1 el 68% de las plantas sobrevivientes iniciaron la floración en agosto y septiembre, mientras el 32% restante inició la floración después, entre octubre y noviembre (muy raro en diciembre). Vale anotar que los botones florales con frecuencia son erectos, pero casi todos los capítulos maduros son nutantes (inclinados hacia abajo, Fig. 2G, H). En ca. 75% de las plantas observadas la floración y fructificación abarcaron un período desde agosto hasta diciembre; solo en pocos casos se observó floración todavía en enero. La floración se inició generalmente en plantas de 3 o 4 meses de edad (ca. 25%), pero la planta No. 8 del sitio 1 desarrolló 5 botones de capítulos en julio con dos meses de edad. Otras plantas (ca. 50%) florecieron con 5 o 6 meses de edad. A mediados de diciembre algunas plantas mantuvieron un desarrollo comparativamente raquítico, muy por debajo del promedio; en general con menos de 30cm de altura y hojas más pequeñas y menos numerosas. En total, 36% de las plantas del sitio 1 murieron antes de haber completado el ciclo de vida, en la mayoría de casos por herbivoría.
El 50% de todas las plantas observadas florecieron solamente en la parte apical del tallo principal; es decir, no desarrollaron ramas laterales, mientras las de mayor crecimiento desarrollaron entre 2 y 5 ramas floríferas laterales. La herbivoría afectó más de 80% de todas las plantas y 100% de los órganos del vástago (Fig. 2D, E), quedando las hojas en algunos casos reducidas solo al pecíolo (por ej. 9 de 18 hojas en la planta No. 5 del sitio 1); sin embargo, la época de desarrollo de botones florales fue la más vulnerable a herbívoros, con hasta 50% de la biomasa de ciertas inflorescencias completamente devorada por insectos. No fue posible identificar las especies de organismos herbívoros, pero en las plantas afectadas aparecieron algunos áfidos, otros chupadores de savia fijos en partes apicales de tallos, saltamontes y larvas de algunas mariposas.
El número total de capítulos varió en plantas sanas entre 25 y 69; sin embargo, en plantas severamente dañadas por herbivoría o en plantas de crecimiento raquítico se contaron solo 1 a 5 capítulos; en casos raros no se desarrolló ninguno o todos los botones de capítulos fueron devorados por herbívoros. En noviembre y diciembre se produjo la máxima floración y fructificación, especialmente en los dos sitios de matorrales (Fig. 2H); allí 60% de las plantas mostraron a inicios de diciembre tanto flores en antesis como frutos maduros, además de pocos botones florales. En esa época gran número de frutos ya se habían desprendido de las infrutescencias, lo que fue evidente por la presencia de capítulos vacíos (receptáculos secos todavía con brácteas, pero sin flores ni frutos).
DISCUSIÓN
Los resultados han mostrado que los aceites esenciales de C. crepidioides están constituidos principalmente por terpenos. El mirceno y el β-felandreno (Fig. 3) son los monoterpenos que se encuentran en mayor cantidad en el aceite de flores procedente de SRMO. Estos resultados concuerdan con los obtenidos previamente en aceites de flores recolectadas en India (Joshi, 2011) y Vietnam (Hung et al., 2019), pero en el material de SRMO de Costa Rica la concentración de ambos constituyentes es muy alta, y representa el 89% de los constituyentes totales del aceite.
También en el aceite esencial de hojas los constituyentes mayoritarios son mirceno y β-felandreno, igual que en un estudio realizado con material de Vietnam (Hung et al., 2019); sin embargo, existe una marcada diferencia en el aceite del material de Camerún, donde el β-felandreno parece ser sustituido por limoneno y este último es el componente mayoritario en los aceites esenciales de las muestras de Yaundé (Zollo et al., 2000). En un estudio de las hojas de material de Guangzhou, China (Wang et al., 2014), se indica la presencia de mirceno y α-pineno como compuestos principales del aceite, pero el estudio es poco fiable porque para la identificación de los compuestos no se utilizaron índices de retención y el orden de elución de muchos de los compuestos es incorrecto. Así mismo, un informe de la composición de aceites esenciales de material de Akure, Nigeria (Owokotomo et al., 2012), muestra datos erróneos.
En nuestro análisis, el componente mayoritario del aceite esencial de tallos fue mirceno, igual que en el estudio de material de Vietnam (Hung et al., 2019), acompañado por cantidades menores de α-copaeno, α-pineno, α-humuleno, β-felandreno y (E)-cariofileno. En términos generales nuestro estudio coincide cualitativamente con los resultados de Vietnam.
El aceite esencial obtenido de las raíces registró los sesquiterpenos acíclicos (E)-β-farneseno y (Z)-β-farneseno (Fig. 3) como compuestos mayoritarios en ambas localidades costarricenses (SRMO y MMO). El aceite esencial obtenido de material recolectado en Ghats Occidentales (India) (Joshi, 2014) concuerda con el compuesto mayoritario de nuestro material, pero no se indica la presencia del isómero (Z)-β-farneseno, que sí está presente como el segundo compuesto principal en las muestras de Costa Rica. No obstante, hay coincidencia entre ambos estudios en la presencia de otros componentes menores, como (E)-cariofileno y β-chamigreno. El (E)-β-farneseno se ha encontrado previamente en gran cantidad en Hemizygia petiolata Ashby de Sudáfrica (Bruce et al., 2005) y en H. bracteosa (Benth.) Briq. (Lamiaceae) de Benín (Kpoviessi et al., 2016). Una diferencia interesante es la presencia, en las muestras de SRMO, de 11 farnesanos en cantidades diversas, representando un total de 61,9% del total del aceite, mientras que en las muestras de MMO se identificaron en el aceite esencial de raíces solamente seis farnesanos, sumando en total 45,6%.
Los terpenos y terpenoides sintetizados por plantas cumplen una función importante en las interacciones con insectos. Es interesante notar el hecho de que el sesquiterpeno acíclico (E)-β-farneseno, que solamente se encuentra en gran cantidad en el aceite esencial de raíces (incluida la base rastrera y curvada del tallo), tiene función como feromona de alarma contra muchas especies de áfidos (pulgones), que causa que otros áfidos cercanos dejen de alimentarse y se dispersen (Beale et al., 2006). Los áfidos se encuentran entre las plagas de insectos más destructivas en campos agrícolas, especialmente en climas templados. Además, el (E)-β-farneseno también funciona como una kairomona para la atracción de depredadores de plagas de insectos (Al Abassi et al., 2000) y mejora el comportamiento de búsqueda de alimento por los parasitoides (Foster et al., 2005). La presencia de áfidos y otros insectos chupadores de savia en algunas de las plantas de Crassocephalum crepidioides observadas en el presente estudio podría estar relacionada con la concentración de (E)-β-farneseno registrada en raíces.
Un estudio efectuado con aceites esenciales de material (aparentemente planta entera) recolectado en los Himalayas Occidentales, India (Thakur, 2019), concuerda con el nuestro en que tanto el mirceno como el β-felandreno son los compuestos principales, acompañados por una pequeña cantidad de α-pineno. El mirceno (Fig. 3) es un monoterpeno insaturado ampliamente distribuido en aceites esenciales de diversas especies de plantas, como Myrcia cuprea (O. Berg) Kiaersk., Myrtaceae (Zoghbi et al., 2003), Clausena dentata (Willd.) M. Roem., Rutaceae (Trung et al., 2014), algunas variedades de Humulus lupulus L., Cannabaceae (Poleć et al., 2020) y un quimiotipo de Lippia alba (Mill.) N.E. Brown, Verbenaceae (Montero-Villegas et al., 2018). El mirceno posee propiedades sedantes y ansiolíticas (Rao et al., 1990), antiinflamatorias (Rufino et al., 2015), así como antioxidantes y citoprotectoras (Xanthis et al., 2021); también tiene propiedades antienvejecimiento (Surendran et al., 2021) y actividad anti-invasiva en una línea de células epiteliales humanas de cáncer de mama, MDA-MB-231 (Lee et al., 2015). Este compuesto es un valioso material renovable para la síntesis industrialmente sustentable de gran número de productos de la química fina, que tienen alto valor agregado y son utilizados en múltiples aplicaciones (Behr & Johnen, 2009).

Fig. 3. Terpenos principales de los aceites esenciales de Crassocephalum crepidioides: (1) mirceno; (2) β-felandreno; (3) (Z)-β-farneseno, (4) (E)-β-farneseno.
El β-felandreno (Fig. 3) es un monoterpeno cíclico insaturado perteneciente al grupo de los p-mentadienos, que forma parte de aceites esenciales obtenidos de diversas especies vegetales, como Petroselinum crispum (Mill.) Fuss, Apiaceae (Zhang et al., 2006), Canarium schweinfurthii Engl., Burseraceae (Nagawa et al., 2015), Sideritis cypria Post, Lamiaceae (Lytra et al., 2020) y las asteráceas Perymenium grande Hemsl. var. nelsonii (B.L. Rob. & Greenm.) J.J. Fay (Cicció & Chaverri, 2012), Santolina chamaecyparissus L. (Demirci et al., 2000), S. corsica Jord. & Fourr. (Liu et al., 2007), S. rosmarinifolia L. ssp. rosmarinifolia (Palá-Paúl et al., 2001) y Smallanthus quichensis (J.M. Coult.) H. Rob. (Chaverri & Cicció, 2015). El β-felandreno posee propiedades antimicóticas y antibacterianas (Touma et al., 2020).
Es importante notar que en ambos sitios de recolecta (SRMO y MMO) los compuestos principales de los aceites esenciales fueron, en términos generales, los mismos. Aunque Crassocephalum crepidioides tiene polinización cruzada y reproducción sexual, al comparar nuestros resultados con los de India y Vietnam (Joshi, 2011; 2014; Thakur et al., 2019; Hung et al., 2019) parece que los aceites esenciales de esta especie son notablemente homogéneos. Una excepción es el estudio de Benín, donde el β-felandreno es sustituido por limoneno (Zollo et al., 2000). No obstante, de los 231 compuestos identificados en total en este estudio, solamente 76 se hallaron en común en los aceites esenciales de las dos localidades de Costa Rica, lo que indica que esta especie exhibe una gran plasticidad en la biosíntesis de compuestos detectables en cantidades menores y a nivel de trazas.
Nuestros datos muestran que dos tercios de las plantas de Crassocephalum crepidioides observadas no fueron estrictamente anuales, contrario a lo indicado en la literatura (Lisowski, 1991), sino que completaron su ciclo de vida en cuatro a seis meses. Numerosas plantas maduras en plena floración tenían el tallo tan suave y tan débil, que no podían mantenerse erectas y estaban apoyadas en la vegetación vecina; esto parece indicar que esta especie no invierte biomasa ni energía en tejidos rígidos de soporte, sino que después de tres a cinco meses de crecimiento vegetativo, la mayoría de plantas empiezan cuanto antes a producir estructuras reproductivas. Con base en información y mediciones de especímenes de herbarios, el Manual de Plantas de Costa Rica (Rodríguez, 2020) indica que estas hierbas miden 0,3 a 1,3 m de altura y las láminas foliares 1,5 a 19(-25) cm de largo × 0,4 a 10 cm de ancho. Estos valores están mayormente dentro de los ámbitos medidos en nuestra investigación, con excepción de la cifra más baja de largo y ancho de hojas, lo que podría deberse a un sesgo de herbario: al ser las hojas relativamente carnosas, pierden abundante agua y se reduce su área en el proceso de secado.
Entre octubre y diciembre, al acercarse el final del ciclo de vida de la mayoría de plantas, se determinó que ya no tenía sentido seguir haciendo mediciones tales como longitud de tallos, longitud y anchura de hojas, dado el gran daño provocado por herbívoros y la evidente reducción o suspensión del crecimiento vegetativo para concentrar la energía en producir capítulos, cipselas y semillas. Se sabe que las hierbas anuales mueren después de la maduración de las semillas según un programa interno de desarrollo (Sitte et al., 1994). Además de cortes en tallos y hojas y reducción de área foliar por herbivoría, en láminas foliares se observaron puntos y manchas de color gris o amarillento, probablemente por la acción de insectos, pero no se descartan otros agentes, tales como hongos o virus. En África tropical Denton (2004) cita las siguientes plagas de C. crepidioides: los hongos Aecidium crassocephali y Cercospora sp.; las larvas de lepidópteros Psara pallidalis, Lobesia aedopai, Nyctemera perspicua y Sylepta derogata; los coleópteros Lagria villosa y Chrysolagria sp.; la langosta ortóptera Zonocerus variegatus, y afidoideos o pulgones, como Aphis spiraecola. Chen et al. (2008) identificaron molecularmente los geminivirus que provocan amarilleamiento de venas foliares en C. crepidioides, mientras en India el “virus de enación de Ageratum” (Ageratum enation virus) se halló infectando plantas de esta especie (Kumar et al., 2011).
Como C. crepidioides posee hojas con textura suave, con frecuencia fueron evidentes también rupturas en láminas foliares debidas a caída de ramitas, frutos pequeños y otras partes desprendidas de plantas grandes de los alrededores. Así, es probable que cuanto más diverso y complejo es el ambiente donde crecen estas plantas, menos probable será que sigan propagándose masivamente como invasoras. Algunos estudios indican que la diversidad natural de una región es una de las mejores defensas contra especies vegetales invasoras (Elton, 1958; Morales, 2020). Sin embargo, este punto de vista ha sido ampliamente cuestionado por algunos autores (Levine & D’Antonio, 1999), que han hallado evidencias de lo contrario o ninguna tendencia clara. Aparentemente no solo la diversidad, sino también algunos factores ambientales intervienen al mismo tiempo en el éxito o el fracaso de una especie invasora. Lo que sí parece indudable es que las especies herbáceas heliófilas tienen muy pocas posibilidades de invadir exitosamente los bosques neotropicales más complejos, que muestran un dosel muy cerrado y varios estratos verticales. Al contrario, en bosques alterados y en ambientes más abiertos y soleados, como las sabanas, hierbas como C. crepidioides pueden hallar hábitats y nichos apropiados. Cuando hemos visto esta especie en áreas protegidas, siempre ha sido junto a caminos de ingreso y en otros sitios abiertos a orillas de bosques naturales.
En el sitio 1 (invernadero) murieron el 36% de las plantas antes de haber completado el ciclo de vida y sin florecer. Estas plantas estaban a la sombra de otras herbáceas más grandes, de crecimiento más rápido, como Achyranthes aspera L. (Amaranthaceae), Aristolochia grandiflora Sw. (Aristolochiaceae), Canna sp. (Cannaceae), Heliconia tortuosa Griggs (Heliconiaceae) y Neurolaena lobata (L.) Cass. (Asteraceae), o estaban en la base de plantas leñosas, con las que no pudieron competir, como Aphelandra leonardii McDade (Acanthaceae), Cecropia obtusifolia Bertol. (Cecropiaceae), Cupania glabra Sw. (Sapindaceae), Licaria triandra (Sw.) Kosterm. (Lauraceae) y Lonchocarpus oliganthus F.J. Herm. (Fabaceae). Es probable una combinación de sombra, competencia de plantas más grandes y herbivoría para explicar el menor desarrollo de ciertas plantas. Además, estos tres factores podrían explicar la menor altura promedio (56 cm) de las plantas medidas en el sitio 1, comparadas con las de dos sitios de matorrales abiertos y más soleados (111 cm). Aunque la última medición de altura en el sitio 1 se hizo a finales de septiembre y la medida de altura total de los dos sitios de matorrales se hizo a inicios de diciembre, en ambos casos se trata aproximadamente de un parámetro del máximo desarrollo vegetativo, porque a partir de octubre predominó el desarrollo de capítulos y frutos. Nuestras observaciones indican que el mayor desarrollo lo alcanzan las plantas que crecen en sitios abiertos, soleados, con suelo húmedo durante todo el período de crecimiento vegetativo, con poca o ninguna competencia de plantas más grandes. Un rasgo distintivo de plantas que crecen en áreas abiertas y soleadas es que las hojas superiores se vuelven profundamente lobuladas, especialmente en el tercio proximal de la lámina, contrario a lo observado en el sitio 1 con abundante sombra lateral. Esto parece indicar que una mayor radiación solar estimula el desarrollo de lóbulos laterales que aumentan el área foliar; de este modo las hojas se vuelven ± pinnatisectas (Fig. 2 F, H). Un modelo experimental podría diseñarse con control y medición de intensidad lumínica y área foliar en varios ambientes donde crece esta especie o bien en condiciones de laboratorio.
En varios sitios observamos numerosas plantas de Crassocephalum crepidioides en la estación lluviosa de un año, pero en los dos o tres años siguientes allí no se hallaron plantas de esta especie o crecieron muy pocas. En el marco de este estudio no fue posible explicar este fenómeno, que además impidió hacer un muestreo de más de un año en cada sitio estudiado. Dos posibles explicaciones serían que las semillas que caen junto a las plantas progenitoras no germinan por ser subdesarrolladas o porque existe algún factor de rechazo por alelopatía; así, solo germinarían las que son transportadas por viento y otros factores a ciertas distancias. Estas hipótesis podrían someterse a experimentación en el futuro.
Después de analizar la germinación de las semillas, Chen et al. (2009) argumentaron que la capacidad de dispersión de semillas de C. crepidioides es limitada y por eso esta especie tendría un potencial invasor moderado. Estas observaciones válidas en China no parecen igualmente válidas en Costa Rica y otros países neotropicales, donde C. crepidioides apareció en la década de 1990 como una hierba invasora muy agresiva. Sin embargo, observamos daños debidos a herbivoría en más del 80% de las plantas, abarcando el cien por ciento de las estructuras aéreas. Algunas plantas llegaron a desaparecer por completo y el desarrollo de otras (> 50%) se redujo por herbivoría y competencia de plantas más grandes. En consecuencia, una fase invasora inicial parece haberse superado y esta especie ahora tiende a integrarse en la flora moderna de Costa Rica (Morales, 2020). Allí donde han colonizado, las plantas de esta especie pronto se convierten en una buena fuente de alimento para numerosos herbívoros pequeños, lo que podría favorecer las cadenas y redes tróficas locales, especialmente en áreas degradadas y florísticamente empobrecidas por actividades humanas. Un estudio reveló actividad antimalárica, antituberculosa y antifúngica de tres compuestos de Geotrichum sp., un hongo endófito de Crassocephalum crepidioides (Kongsaeree et al., 2003). Esto revela que hasta las especies de plantas consideradas invasoras son útiles, incluso de modos inesperados. Además, el concepto antropocéntrico tradicional de malezas o “malas hierbas” [inglés “weeds”] debería erradicarse por ser negativamente sesgado contra elementos bióticos naturales. En su lugar, podría hablarse de plantas acompañantes (Fernández-Quintanilla & Dorado, 2007) o plantas coexistentes (Chandrasena, 2014), para así aceptar y reconocer la existencia de una mayor diversidad biológica en campos de cultivo y otras áreas antrópicas. También podemos llamarlas arvenses, el término latino para plantas (no cultivadas) de campos de labranza.
Aunque esta especie se reconoce como anual, 2/3 de las plantas observadas completaron su ciclo de vida en 4 a 6 meses y debido a herbivoría y otros factores ambientales su propagación se ha reducido notablemente.
AGRADECIMIENTOS
A la Vicerrectoría de Investigación de la Universidad de Costa Rica que financió parte del estudio con el proyecto 809-B5-A48. Agradecemos también a los revisores anónimos por sus valiosos comentarios, sugerencias y correcciones que enriquecieron el presente trabajo.
ÉTICA, CONFLICTO DE INTERESES Y DECLARACIÓN DE FINANCIAMIENTO
Declaramos haber cumplido con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en la preparación de este documento; que no hay conflictos de interés de ningún tipo, y que todas las fuentes financieras se detallan plena y claramente en la sección de agradecimientos. Asimismo, estamos de acuerdo con la versión editada final de esta publicación. El respectivo documento legal firmado se encuentra en los archivos de la revista.
La declaración de la contribución de cada autor al manuscrito fue la siguiente: C. C. y J. F. C. realizaron todo el trabajo químico (2/3 del total); C. O. M. hizo el trabajo fenológico y de interacciones bióticas (1/3 del total).
REFERENCIAS
Adams, R.P. (2007). Identification of Essential Oil Components by Gas Chromatography/ Quadrupole Mass Spectrometry, (4a. ed.). Allured Publishing Corporation.
Adjatin, A., Dansi, A., Badoussi, E., Sanoussi, A. F., Dansi, M., Azokpota, P., Ahissou, H., Akouegninou, A., Akpagana, K., & Sanni, A. (2013). Proximate, mineral and vitamin C composition of vegetable Gbolo [Crassocephalum rubens (Juss. ex Jacq.) S. Moore and C. crepidioides (Benth.) S. Moore] in Benin. International Journal of Biological and Chemical Sciences, 7(1), 319-331. http://dx.doi.org/10. 4314/ijbcs.v7iLi.27
Al Abassi, S., Birkett, M.A., Pettersson, J., Pickett, J.A., Wadhams, L.J., & Woodcock, C.M. (2000). Response of the seven-spot ladybird to an aphid alarm pheromone inhibitor is mediated by paired olfactory cells. Journal of Chemical Ecology, 26(7), 1765-1771. http://dx.doi.org/10.1023/A:1005555300476
Aniya, Y., Koyama, T., Miyagi, C., Miyahira, M., Inomata, C., Kinoshita, S., & Ichiba, T. (2005). Free radical scavenging and hepatoprotective actions of the medicinal herb, Crassocephalum crepidioides from the Okinawa Islands. Biological and Pharmaceutical Bulletin, 28(1), 19-23. https://doi.org/10.1248/bpb.28.19
Arawande, J.O., Amoo, I.A., & Lajide, L. (2012). Phytochemical and antioxidant characterization of fireweed (Crassocephalum crepidioides) and African lettuce (Lactuca taraxacifolia). Journal of Applied Technology in Environmental Sanitation, 2(4), 191-196.
Asada, Y., Shiraishi, M., Takeuchi, T., Osawa, Y., & Furuya, T. (1985). Pyrrolizidine alkaloids from Crassocephalum crepidioides. Planta Medica, 51(6), 539-540. https://doi.org/10.1055/s-2007-969597
Bahar, E., Akter, K.M., Lee, H.Y., Rashid, H.O., Choi, M.K., Bhattarai, K.R., Hossain, M.M.M., Ara, J., Mazumder, K., Raihan, O., Chae, H.J., & Yoon, H. (2017). β-Cell protection and antidiabetic activities of Crassocephalum crepidioides (Asteraceae) Benth. S. Moore extract against alloxan-induced oxidative stress via regulation of apoptosis and reactive oxygen species (ROS). BMC Complementary and Alternative Medicine, 17, 179. https://doi.org/10.1186/s12906-017-1697-0
Beale, M.H., Bierkett, M.A., Bruce, T.J.A., Chamberlain, K., Field, L.M., Huttly, A.K., Martin, J.L., Parker, R., Phillips, A.L., Pickett, J.A., Prosser, I.M., Shewry, P., Smart, L.E., Wadhams, L.J., Woodcock, C.M., & Zhang, Y. (2006). Aphid alarm pheromone produced by transgenic plants affects aphid and parasitoid behavior. Proceedings of the National Academy of Sciences, 103(27), 10509-105013. https://doi.org/10.1073/pnas.0603998103
Behr, A., & Johnen, L. (2009). Myrcene as a natural base chemical in sustainable chemistry: a critical review. Chemistry-Sustainability-Energy-Materials (ChemSusChem), 2, 1072-1095. https://doi.org/10.1002/cssc.200900186
Belcher, R.O. (1955). The typification of Crassocephalum Moench and Gynura Cass. Kew Bulletin, 10(3), 455-465.
Bruce, T.J.A., Birkett, M.A., Blande, J., Hooper, A.M., Martin, J.L., Khambay, B., Prosser, I., Smart, E., & Wadhams, L.J. (2005). Response of economically important aphids to components of Hemizygia petiolata essential oil. Pest Management Science, 61(11), 1115-1121. https://doi.org/10.1002/ps.1102
Chandrasena, N. (2014). Living with weeds – A new paradigm. Indian Journal of Weed Science, 46(1), 96-110. http://isws.org.in/IJWSn/File/2014_46_Issue-1_96-110.pdf
Chaverri, C., & Cicció, J.F. (2015). Composition of the essential oil from leaves of Smallanthus quichensis (Asteraceae) from Costa Rica. Boletin Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas. 14(5), 355-363. https://redalyc.org/articulo.oa?id=85641105002
Chen, G., Guo, S., & Huang, Q. (2009). Invasiveness evaluation of fireweed (Crassocephalum crepidioides) based on its seed germination features. Weed Biology and Management, 9(2), 123-128.
Chen, J., Li, F., Li, Y., Yi, S., Guo, J., & Chen, H. (2008). Molecular identification of geminiviruses inducing vein yellowing in Crassocephalum crepidioides. Journal of Yunnan Agricultural University, 23(1), 29-32.
Cicció, J.F., & Chaverri, C. (2012). Chemical composition of the leaf and branch oils of Perymenium grande Hemsl. var. nelsonii (Robins. & Greenm.) Fay (Asteraceae-Heliantheae) from Costa Rica. Records of Natural Products, 6(4), 371-375. https://www.acgpubs.org/RNP/2012/Volume%206/Issue%201/52-RNP-1108-736.pdf
Dairo, F.A.S., & Adanlawo, I.G. (2007). Nutritional Quality of Crassocephalum crepidioides and Senecio biafrae. Pakistan Journal of Nutrition, 6(1), 35-39. https://doi.org/10.3923/pjn.2007.35.39
Denton, O.A. (2004). Crassocephalum crepidioides (Benth.) S. Moore. In G.J.H. Grubben & O.A. Denton (Eds.), Plant Resources of Tropical Africa 2: Vegetables/Légumes (pp. 226-228). PROTA Foundation.
Demirci, B., Özek, T., & Baser, K. H. C. (2000). Chemical composition of Santolina chamaecyparissus L. essential oil. Journal of Essential Oil Research, 12(5), 625-627. https://doi.org/10.1080/10412905.2000.9712173
Elton, C. S. (1958). The ecology of invasions by animals and plants. Methuen.
Fernández-Quintanilla, C., & Dorado, J. (2007). Daños y beneficios causados por las malas hierbas. Phytoma, 193, 12-16. https://bit.ly/3PIFD7M
Fidèle, N., Rodrigue, T. E., Christian, B., Romain, K. A. D., & Emmanuel, T. (2019). Diuretic activity of the aqueous extract leaves of Crassocephalum crepidioides (Asteraceae) in rats. International Journal of Current Microbiology and Applied Sciences, 8(4), 2649-2667. https://doi.org/10.20546/ijcmas.2019.804.309
Foster, S.P., Denholm, I., Thompson, R., Poppy, G.M., & Powell, W. (2005). Reduced response on insecticide-resistant aphids and attraction of parasitoids to aphid alarm pheromone; a potential fitness trade-off. Bulletin of Entomological Research, 95(1), 37-46. https://doi.org/10.1079/BER2004336
Funk, V.A., Susanna, A., Stuessy, T.F., & Robinson, H. (2009). Chap. 11. Classification of Compositae. In V.A. Funk, A. Susanna, T.F. Stuessy & R.J. Bayer (Eds.), Systematics, evolution, and biogeography of Compositae (pp. 171-189). IAPT.
Hung, N.H., Satyal, P., Dai, D, N., Tai, T.A., Huong, L.T., Chuong, N.T.H., Hieu, H.V., Tuan, P.A., Vuong, P.V., & Setzer, W.N. (2019). Chemical compositions of Crassocephalum crepidioides essential oils and larvicidal activities against Aedes aegypti, Aedes albopictus, and Culex quinquefasciatus. Natural Product Communications, 14(6), 1-5. https://doi.org/10.1177/1934578X19850033
Instituto Meteorológico Nacional (IMN). (2021). Clima de Costa Rica y variabilidad climática: Valle Central. https://bit.ly/3IYDouJ
Joshi, R.K. (2011). Terpene composition of Crassocephalum crepidioides from Western Ghats region of India. International Journal of Natural Products Research, 1(2), 19-22.
Joshi, R.K. (2014). Study on essential oil composition of the roots of Crassocephalum crepidioides (Benth.) S. Moore. Journal of the Chilean Chemical Society, 59(1), 2363-2365. https://doi.org/10.4067/S0717-97072014000100025
Kongsaeree, P., Prabpai, S., Sriubolmas, N., Vongvein, C., & Wiyakrutta, S. (2003). Antimalarial dihydroisocoumarins produced by Geotrichum sp., an endophytic fungus of Crassocephalum crepidioides. Journal of Natural Products, 66(5), 709-711. https://doi.org/10.1021/np0205598
Kpoviessi, S., Agbani, P., Gbaguidi, F., Gbénou, J., Sinsin, B.A., Accrombessi, G., Bero, J., Moudachirou, M., & Quetin-Leclercq, J. (2016). Seasonal variations of volatile constituents of Hemizygia bracteosa (Benth.) Briq. aerial parts from Benin. Comptes Rendus Chimie, 19(7), 890-894. http://dx.doi.org/10.1016/j.crci.2016.03.013
Kumar, Y., Hallan, V., & Zaidi, A.A. (2011). First report of Ageratum enation virus infecting Crassocephalum crepidioides (Benth.) S. Moore and Ageratum conyzoides L. in India. Journal of General Plant Pathology, 77(3), 214-216. https://doi.org/10.1007/s10327-011-0308-z
Lee, J.-H., Lee, K., Lee, D.H., Shin, S.Y., Yong, Y., & Lee, Y.H. (2015). Anti-invasive effect of b-myrcene, a component of the essential oil from Pinus koraiensis cones, in metastatic MDA-MB-231 human breast cancer cells. Journal of the Korean Society for Applied Biological Chemistry, 58(4), 563-569. https://doi.org/10.1007/s13765-015-0081-3
Levine, J.M., & D’Antonio, C.M. (1999). Revisited: A review of evidence linking diversity and invasibility. Oikos, 87(1), 15-26. https://doi.org/10.2307/3546992
Lisowski, S. (1991). Les Asteraceae dans la flore d`Afrique Centrale. Vol. 2. Fragmenta Floristica et Geobotanica, 36(1, Suppl. 1), 251-627.
Liu, K., Rossi, P-G., Ferrari, B., Berti, l., Casanova, J., & Tomi, F. (2007). Composition, irregular terpenoids, chemical variability and antibacterial activity of the essential oil from Santolina corsica Jordan et Fourr. Phytochemistry, 68(12), 1698-1705. https://doi.org/10.1016/j.phytochem.2007.04.027
Lytra, K., Tomou, E.-M., Chrysargyris, A., Drouza, C., Skaltza, H., & Tzortzakys, N. (2020). Traditionally used Sideritis cypria Post.: Phytochemistry, nutritional content, bioactive compounds of cultivated populations. Frontiers in Pharmacology, 11, 650. https//doi.org/10.3389/fphar.2020.00650
Montero-Villegas, S., Crespo, R., Rodenak-Kladniew, B., Castro, M.A., Galle, M., Cicció, J.F., García de Bravo, M., & Polo, M. (2018). Cytotoxic effects of essential oils from four Lippia alba chemotypes in human liver and lung cancer cell lines. Journal of Essential Oil Research, 30, 167–181. https://doi.org/10.1080/ 10412905.2018.1431966 167–181
Morales, C.O. (2020). Origen, historia natural y usos de las plantas introducidas en Costa Rica. Cuadernos de Investigación UNED, 12(2), e3098. https://doi.org/10.22458/urj.v12i2.3098
Nagawa, C., Böhmdorfer, S., & Rosenau, T. (2015). Chemical composition and anti-termitic activity of essential oil from Canarium schweinfurthii Engl. Industrial Crops and Products, 71, 75-79. http://dx.doi.org/10.1016/j.indcrop.2015.03.078
Newman, M.G., Cohen, L.B., Opris, M., Nanau, R., & Jeong, H. (2015). Hepatotoxicity of pyrrolizidine alkaloids. Journal of Pharmacy and Pharmaceutical Sciences, 18(4), 825-843. https://doi.org/10.18433/j3bg7j
Nordenstam, B. (2007). Crassocephalum crepidioides (Asteraceae-Senecioneae) in the Dominican Republic. Moscosoa, 15, 61-64.
Owokotomo, I.A., Ekundayo, O., Oladosu, I.A. & Aboaba, S. (2011). Analysis of the essential oils of leaves and stems of Crassocephalum crepidioides growing in South Western Nigeria. International Journal of Chemistry, 4(2), 34-37. https://doi.org/10.5539/ijc.v4n2p34
Palá-Paúl, J., Pérez-Alonso, M.J., Velasco-Negueruela, A., Palá-Paúl, R., Sanz, J., & Conejero, F. (2001). Seasonal variation in chemical constituents of Santolina rosmarinifolia L. ssp. rosmarinifolia. Biochemical Systematics and Ecology, 29(7), 663-672. https://doi.org/10.1016/S0305-1978(01)00032-1
Panero, J.L., & Crozier, B.S. (2012). Asteraceae. Sunflowers, daisies. http://tolweb.org/Asteraceae/20780/2012.01.27
Poleć, K., Broniatowski, M., Wydro, P., & Hac-Wydro, K. (2020). The impact of β-myrcene -the main component of the hop essential oil- on the lipid films. Journal of Molecular Liquids, 308, 113028. https://doi.org/10.1016/j.molliq.2020.113028
Randall, R. P. (2012). A Global Compendium of Weeds (2nd ed). Shannon Books.
Rao, V.S., Menezes, A.M., & Viana, G.S. (1990). Effect of myrcene on nociception in mice. Journal of Pharmacy and Pharmacology, 42(12), 877-878. https://doi.org/10.1111/j.2042-7158.1990.tb07046.x
Rodríguez, A. (2020). Asteraceae. In B.E. Hammel, M.H. Grayum, C. Herrera & N. Zamora (Eds.), Manual de Plantas de Costa Rica (vol. 4, parte 1, pp. 516–878). Missouri Bot. Garden Press.
Royal Botanic Gardens Kew. (s.f.) Crassocephalum Moench. Plants of the World Online. https://bit.ly/3zogKc5
Rozhon, W., Kammermeier, L., Schramm, S., Towfique, N., Adedeji, N.A., Ajayi, S.A., & Poppenberger, B. (2017). Quantification of the pyrrolizidine alkaloid jacobine in Crassocephalum crepidioides by cation exchange high-performance liquid chromatography. Phytochemical Analysis, 29(1), 48-58. https://doi.org/10.1002/pca.2713
Rufino, A.T., Ribeiro, M., Sousa, C., Judas, F., Salgueiro, L., Cavaleiro, C., & Mendes, A.F. (2015). Evaluation of the anti-inflammatory, anti-catabolic and pro-anabolic effects of E-caryophyllene, myrcene and limonene in a cell model of osteoarthritis. European Journal of Pharmacology, 750, 141-150. https://doi.org/10.1016/j.ejphar.2015.01.018
Schramm, S., Rozhon, W., Adedeji-Batmus, A.N., Liang, Y., Nayem, S., Winkelmann, T., & Poppenberger, B. (2021). The orphan crop Crassocephalum crepidioides accumulates the pyrrolizidine alkaloid jacobine in response to nitrogen starvation. Frontiers in Plant Science, 12, 702985. https://doi.org/10.3389/fpls.2021.702985
Sitte, P., Ziegler, H., Ehrendorfer, F., & Bresinsky, A. (1994). Strasburger. Tratado de Botánica (8th. Ed.) Editorial Omega.
Stenhagen, E., Abrahamsson, S., & McLafferty, F.W. (1974). Registry of Mass Spectral Data. John Wiley & Sons.
Surendran, S., Qassadi, F., Surendran, G., Lilley, D., & Heinrich, M. (2021). Myrcene - What are the potential health benefits of this flavouring and aroma agent? Frontiers in Nutrition, 8, 699666. https://doi.org/10.3389/fnut.2021.699666
Swigar, A.A., & Silvertein, R.M. (1981). Monoterpenes. Infrared, Mass, 1N-NMR, and 13C-NMR Spectra, and Kováts Indices. Aldrich Chemical Company Inc.
Thakur, S., Koundal, R., Kumar, D., Maurya, A.K., Padwad, Y.S., Lal, B., & Agnihotri, V.K. (2019). Volatile composition and cytotoxic activity of aerial parts of Crassocephalum crepidioides growing in Western Himalaya, India. Indian Journal of Pharmaceutical Sciences, 81(1), 167-172. https://doi.org/10.4172/pharmaceutical-sciences.1000494
The Plant List. (2010). A working list of all plant species. www.theplantlist.org
Tomimori, K., Nakama, S., Kimura, R., Tamaki, K., Ishikawa, C., & Mori, N. (2012). Antitumor activity and macrophage nitric oxide producing action of medicinal herb, Crassocephalum crepidioides. BMC Complementary and Alternative Medicine, 12, 78, 2012. http://www.biomedcentral.com/1472-6882/12/78
Touma, J., Navarro, M., Sepúlveda, B., Pavon, A., Corsini, G., Fernández, K., Quezada C., Torres, A., Larrazabal-Fuentes, M. J., Paredes, A., Neira, I., Ferrando, M., Bruna, F., Venegas, A., & Bravo. J. (2020). The chemical compositions of essential oils derived from Cryptocarya alba and Laurelia sempervirens possess antioxidant, antibacterial and antitumoral activity potential., Molecules, 25, 5600. https://doi.org/10.3390/molecules25235600
Trung, H.D., Thang, T.D., Ban, P.H., Hoi, T.M., Dai, D.N., & Ogunwande, I.A. (2014). Terpene constituents of the leaves of five Vietnamese species of Clausena (Rutaceae). Natural Product Research, 28(9), 622-630. https://doi.org/10.1080/14786419.2014.888555
van den Dool, H., & Kratz, P.D. (1963). A generalization of the retention index including linear temperature programmed gas-liquid partition chromatography. Journal of Chromatography A, 11, 463-471. https://doi.org/10.1016/S0021-9673(01)80947-X
Wallace, W.E. (dir.). 2019. Mass spectra (by NIST Mass Spec Data Center). In P.J. Linstrom & W.G. Mallard (Eds.), Nits Chemistry WebBook: NIST Standard Reference Database Number 69. National Institute of Standards and Technology. http://webbook.nist.gov.
Wang, R., Zheng, Z., Wang, G., & Kong, X. (2014). Allelopatic potential and antifeeding activity of Crassocephalum crepidioides against native plants and Spodoptera litura. Allelopathy Journal, 33(2), 245-254.
Xanthis, V., Fitsiou, E., Voulgaridou, G.-P., Bogadakis, A., Chlichlia, K., Galanis, A., & Pappa, A. (2021). Antioxidant and cytoprotective potential of the essential oil Pistacia lentiscus var. chia and its major components myrcene and α-pinene. Antioxidants, 10, 127. https://doi.org/10.3390/antiox10010127
Zhang, H., Chen, F., Wang, X., & Yao, H-Y. (2006). Evaluation of antioxidant activity of parsley (Petroselinum crispum) essential oil and identification of its antioxidant constituents. Food Research International, 39(8), 833-839. https://doi.org/10.1016/j.foodres.2006.03.007
Zoghbi, M. d. G.B., Andrade, E.H.A., Silva, M.H.L. d., Carreira, L.M.M., & Maia, J.G.S. (2003). Essential oils from three Myrcia species. Flavour and Fragrance Journal, 18, 421-424. https://doi.org/10.1002/ffj.1242
Zollo, P.H.A., Kuiate, J.R., Menut, C. & Bessiere, J.M. (2000). Aromatic plants of tropical Central Africa. XXXVI. Chemical composition of essential oils from seven Cameroonian Crassocephalum species. Journal of Essential Oil Research, 12(5), 533-536. https://doi.org/10.1080/10412905.2000.9712152