
UNED Research Journal (e-ISSN 1659-441X), Vol. 14(2): e4070, December, 2022
ESTUDIO DE CASO
Evaluación de riesgo por arsénico, en bajas concentraciones, para trabajadores agrícolas de Cartago, Costa Rica
Eric Morales-Mora1![]() , Kenia Barrantes-Jiménez1
, Kenia Barrantes-Jiménez1![]() , Wilson Beita-Sandí2
, Wilson Beita-Sandí2![]() & Luz Chacón-Jiménez1
& Luz Chacón-Jiménez1![]()
1. Universidad de Costa Rica, Instituto de Investigaciones en Salud, San José, Costa Rica. eric.morales@ucr.ac.cr; kenia.barrantes@ucr.ac.cr; luz.chacon@ucr.ac.cr
2. Universidad de Costa Rica, Centro de Investigación en Contaminación Ambiental, San José, Costa Rica. wilson.beita@ucr.ac.cr
Recibido 15-III-2022 Corregido 23-VI-2022 Aceptado 26-VI-2022
DOI: https://doi.org/10.22458/urj.v14i2.4070
|
ABSTRACT. “Case study: Risk assessment for arsenic, in low concentrations, for agricultural workers in Cartago, Costa Rica”. Introduction: Arsenic, an element that can be harmful to human health, is abundant in the environment. It was among the first substances recognized as carcinogenic, and its presence in water is common in Latin America. Its levels in water sources are relevant for decision-making and sanitary control. This study is the first in Latin America with a mathematical model of the risk and burden of disease. Objective: To evaluate the exposure to low levels of arsenic in agricultural workers in a Costa Rican basin with this new technique. Methods: We sampled arsenic in three points along the Purires River, Cartago, between September 2011 and August 2012. We used “censored value” estimates; risk assessment with quadratic exponential models and Monte Carlo simulations to determine the risk of cancer, for agricultural workers, by type and route of exposure during irrigation. Results: Concentrations did not differ by site, but were higher in the dry season. The risk level and burden of disease were not acceptable. Disease burden is a more rigorous indicator than the individual calculation of probability of occurrence. Our estimated risk level is low compared to other studies outside the region, but not comparable to previous work in Latin America, which used a different method. Conclusion: A decade ago, in the Purires basin, arsenic concentrations were higher in the dry season and the risk level and burden of disease were not acceptable.
Keywords: Disease burden, water quality, DALY, environmental health, occupational health.
|
RESUMEN. Introducción: El arsénico, elemento que puede ser nocivo para la salud humana, es abundante en el ambiente. Fue una de las primeras sustancias reconocidas como cancerígenas y su presencia en el agua es común en América Latina. Sus niveles en fuentes de agua son relevantes para la toma de decisiones y control sanitario. Este estudio es el primero en América Latina con un modelo matemático de riesgo y carga de enfermedad. Objetivo: Evaluar la exposición a niveles bajos de arsénico en trabajadores agrícolas, de una cuenca costarricense, con esta nueva técnica. Métodos: Muestreamos arsénico en tres puntos a lo largo del río Purires, Cartago, entre septiembre de 2011 y agosto de 2012. Usamos estimaciones de “valor censurado”; evaluación de riesgos con modelos exponenciales cuadráticos y simulaciones de Monte Carlo para determinar el riesgo de cáncer, según tipo y vía de exposición durante el riego, para trabajadores agrícolas. Resultados: Las concentraciones no difirieron por sitio, pero fueron mayores en la época seca. El nivel de riesgo y la carga de enfermedad no fueron aceptables. La carga de enfermedad es un indicador más riguroso que el cálculo individual de probabilidad. Nuestro nivel de riesgo estimado es bajo en comparación con estudios hechos fuera de la región, pero no es comparable con trabajos anteriores en América Latina, basados en un método diferente. Conclusión: Hace una década, en la cuenca Purires, las concentraciones de arsénico eran más altas en la época seca y el nivel de riesgo y la carga de enfermedad no eran aceptables.
Palabras clave: carga de enfermedad, calidad de agua, AVAD, salud ambiental, salud ocupacional.
|
El arsénico es uno de los elementos más abundantes de origen natural y se encuentra ampliamente extendido en la corteza terrestre (Sharma et al., 2016). El arsénico ambiental proviene de dos fuentes: natural (e.g., meteorización, emisiones volcánicas y actividad biológica) y antropogénica (e.g., minería, procesos industriales, fundición de metales, producción de pesticidas y uso de combustibles fósiles) (Alonso et al., 2014). Específicamente, actividades como la irrigación con pesticidas con arsénico o procesos de reducción y disolución de minerales naturales, pueden dispersar y aumentar sus concentraciones en ambientes acuáticos (Sharma et al., 2016). Otros factores como alteraciones climáticas extremas o estacionales pueden causar gran variabilidad en las concentraciones de arsénico ambiental, principalmente en cuerpos de agua (Savarimuthu et al., 2006).
Este elemento químico fue una de las primeras sustancias en ser reconocida como cancerígena en seres humanos (Smith et al., 2009). Durante las dos últimas décadas la presencia de arsénico en el ambiente ha sido clasificada como un problema global de la salud y el ambiente (Bundschuh et al., 2020). La Agencia Internacional de Investigación en Cáncer (IARC, por sus siglas en inglés) ha clasificado al arsénico como un cancerígeno del Grupo 1 confirmando riesgo de cáncer de pulmón, vejiga y piel, mientras otros como el cáncer de riñón se encuentra bajo sospecha (Smith et al., 2009; Tsuji et al., 2021). Particularmente, el arsénico en el agua utilizada para uso humano causa un gran número de efectos adversos sobre la salud de las poblaciones como por ejemplo lesiones en la piel, daños en órganos internos, y el antes mencionado cáncer, principalmente de piel, vejiga y pulmón (McClintock et al., 2012). Las principales rutas de acceso del arsénico en agua al cuerpo humano son la ingestión, inhalación y absorción dermal (Smith et al., 2009; Lamm et al., 2021).
Dada la importancia de los efectos en la salud causados por la exposición a arsénico, las autoridades alrededor del mundo han puesto atención a su presencia en diferentes ambientes, principalmente en los cuerpos de agua. En América Latina para el año 2020 se informó la presencia de contaminación e impactos en la salud pública en cerca de veinte países con variados niveles de gravedad (Bundschuh et al., 2020). En estudios realizados en la región se han encontrado casos de exposición a arsénico y sus efectos sobre las poblaciones humanas en México, Argéntica, Chile, Bolivia, Ecuador, Paraguay y Costa Rica, entre otros (Bundschuh et al., 2012; McClintock et al., 2012; Khan et al., 2020).
Ciertos escenarios de exposición resultan especialmente riesgosos, como los ocupacionales, principalmente en la industria minera, producción y manipulación de pesticidas (Palma-Lara et al., 2020). Anteriormente, este tipo de exposición ocupacional al arsénico y consumo de agua con altos contenidos de este elemento se ha relacionado con la presencia de cáncer de pulmón, vejiga y piel (Tsuji et al., 2019). En las últimas décadas se ha incrementado el debate científico entorno a las acciones y mecanismos regulatorios para la determinación del nivel de exposición aceptable al arsénico. El debate se centra en la aplicación de métodos de dosis-respuesta y la poca idoneidad de utilizar modelos lineales para la estimación del riesgo como los tradicionalmente utilizados en la evaluación de riesgos químicos (Robson & Toscano, 2007; Gentry et al., 2014). Los modelos tradicionales tienen una baja sensibilidad para estimar potenciales efectos a bajas concentraciones y son inespecíficos en cuanto al resultado en salud, aun cuando los mecanismos para desarrollar la enfermedad sean específicos (e.g., miden el riesgo de cáncer, pero no que tipo de cáncer se podría presentar, lo cual varía sustancialmente en función del agente y tipo de exposición) (Palma-Lara et al., 2020; Tsuji et al., 2015, 2019).
En este estudio se aplicó una evaluación cuantitativa de riesgo por exposición a bajas concentraciones de arsénico en los trabajadores agrícolas de la microcuenca del río Purires, mediante la aplicación de métodos de supervivencia, modelos exponenciales cuadráticos de dosis-respuesta y simulaciones de Monte Carlo para la estimación del riesgo de cáncer de pulmón, vejiga y piel. Lo anterior resulta novedoso, puesto que es la primera evaluación de riesgos por arsénico con esta metodología en Costa Rica y la región Latinoamérica.
MATERIALES Y MÉTODOS
Área de estudio: La microcuenca del río Purires se localiza en la provincia de Cartago, Costa Rica. La altitud de la microcuenca varía entre 1 380 y 2 200m.s.n.m., con un área total de 76,25km2 (Astorga, 2007). Las muestras fueron recolectadas en tres puntos a lo largo del curso principal del río, delimitados en función de la altitud (Fig. 1). El punto alto presenta una elevación de 1 599m.s.n.m., localizado a 9°83’ norte y 84° 01’ oeste; el punto medio se encuentra a 1 415m.s.n.m., localizado 9°85’N- 83°99’W; y el punto bajo se encuentra a 1 381 m.s.n.m., localizado 9°83’N-83°95W.
En la microcuenca del río Purires hay gran diversidad de uso de suelo: agrícola, ganadero, industrial, domiciliar de alta y baja densidad, y bosques secundarios (Veas, 2011). Los usos agrícolas y ganaderos se encuentran predominantemente en las zonas alta e intermedia de la microcuenca, mientras las actividades industriales y urbanas predominantemente en la zona baja (Córdoba, 2012). Previo al estudio, se demostró que el principal aporte de contaminantes que influye en la calidad del agua es el arrastre de sedimentos y las descargas de aguas residuales de las zonas urbanas (Astorga, 2007; Barrantes et al., 2013).

Fig. 1. Ubicación de los puntos de muestro en la microcuenca del río Purires.
Recolección y análisis de muestras: Las muestras de agua fueron recolectadas mensualmente en los tres puntos de muestreo entre septiembre del 2011 y agosto del 2012, para un total de 36 muestras. El comportamiento climático de este periodo se vio influenciado por el fenómeno de La Niña (Chacón et al., 2018). La concentración de arsénico fue medida mediante espectrometría de absorción atómica electrotérmica según el método estándar 3113B (Eaton et al., 2005). El límite de detección del método fue de <0,0029mg/L.
Análisis estadístico: El análisis de datos se realizó con el método no paramétrico de supervivencia con la técnica estimación de máxima verosimilitud y análisis descriptivos de las estimaciones. La elección de la técnica se determinó según el tamaño de conjunto de datos y la proporción de valores censurados (valores por debajo del límite de detección) (Quitanilla, 2017). Todos los análisis fueron realizados con el paquete NADA (https://cran.r-project.org/web/packages/NADA/index.html) del lenguaje de programación R de CRAN (Helsel, 2012). Para el estudio se establecieron dos grupos de análisis: puntos de muestreo (alto, medio y bajo) y época climática (seca y lluviosa). Las diferencias entre grupos se analizaron con el método no paramétrico de Peto-Prentice con un nivel de significancia de p<0,05. Posteriormente, se construyó un gráfico de intervalos de la concentración de arsénico para cada grupo de análisis con el límite de detección, la media, el límite superior y límite inferior de las concentraciones estimadas mediante el análisis de datos censurados.
Evaluación de riesgos: En el presente estudio se estimó el riesgo para desarrollar cáncer de pulmón, vejiga y piel por la exposición a agua de irrigación con arsénico para trabajadores agrícolas en la microcuenca del río Purires, los cuales se caracterizan por una alta edad promedio en comparación con los trabajadores de otros sectores y son principalmente hombres (Tabla 1). Para el desarrollo de la evaluación de riesgo considerando la exposición, probabilidad de desarrollar cáncer y la carga de enfermedad (años de vida ajustados por discapacidad), se construyó un modelo de riesgo en el lenguaje de programación R, el cual fue realizado mediante la aplicación de las ecuaciones que se presentan a continuación y simulaciones de Monte Carlo con 10 000 iteraciones por corrida. Los parámetros utilizados para la estimación del riesgo de cáncer para un trabajador agrícola de la microcuenca del río Purires de las Ecuaciones 1, 2, 3 y 4 se detallan en la Tabla 1.
Las vías de exposición del arsénico en agua son oral, dermal y aérea, considerando que la transferencia de agua a aire de arsénico es altamente variable, no se consideró la vía aérea dentro del análisis (United States Environmental Protection Agency [US EPA], 1988). Para la estimación de la exposición se calculó la ingesta diaria crónica (CDI, por sus siglas en inglés), para ingestión oral y absorción dermal para la exposición de trabajadores agrícolas durante el riego, en este caso se omitió la ingestión directa de agua, puesto que no se cuenta con datos de consumo directo en la zona, con el método propuesto por la Agencia de Protección Ambiental de los Estados Unidos (US EPA, por sus siglas en inglés) (Robson & Toscano, 2007; United States Environmental Protection Agency [US EPA], 2011); como se muestra a continuación:
![]() [1]
[1]
![]() [2]
[2]
Para la estimación de la relación dosis-respuesta en la exposición al arsénico en agua y carcinoma visceral (pulmón y vejiga en el presente caso) se utilizó la propuesta por el Consejo Nacional de Investigación Canadiense (NRC, 2001) (Tabla 1). En el caso del cáncer de piel se utilizó la relación de dosis-respuesta propuesta por la US EPA (US EPA, 1988) (Tabla 1). Tras la definición de cada uno de los parámetros dosis-respuesta, se procedió a la estimación de la probabilidad de desarrollar cáncer de manera individual para cada tipo de cáncer y la probabilidad agregada de desarrollar cualquier cáncer por la exposición a arsénico en el agua, para ello, se utilizó Ecuación 3 y parámetros descritos en la Tabla 1. En el caso de la probabilidad agregada se utilizó el teorema de adición de probabilidades para su cálculo.
![]() [3]
[3]
Los años de vida ajustados por discapacidad (AVAD), es una medida de salud pública ampliamente utilizada para estimar la carga de enfermedad por una determinada condición considerando la severidad y duración en años de causa en estudio (Dore, 2015). La lógica de esta métrica, es que cada persona tiene un potencial número de años de vida al nacer, el cual se ve reducido por la presencia de enfermedades a lo largo de su vida que implican años de vida perdidos por discapacidad o mortalidad prematura (Devleesschauwer et al., 2014). En este estudio las condiciones de salud criterio para evaluar la carga de enfermedad por exposición a bajas concentraciones de arsénico son los cánceres de pulmón, vejiga y piel, que han sido previamente comprobados por esta causa. La estimación de la carga de enfermedad se construye en las dimensiones de morbilidad y mortalidad, por tanto, los AVAD resultan de la sumatoria de los años de vida perdida (AVP) y los años de vida con discapacidad (AVD) (Zhang et al., 2020). En la Ecuación 4 y la Tabla 1 se detalla el cálculo y parámetros de los AVAD utilizado en este estudio.
![]() [4]
[4]
TABLA 1
Parámetros para el análisis de la exposición, dosis-respuesta y años de vida ajustados por discapacidad utilizados en la evaluación de riesgos
|
Parámetro |
Unidad |
Valor/distribución |
Fuente |
|
Análisis de la exposición |
|||
|
Concentración de arsénico (CW) |
mg/l |
Media y desviación estándar obtenida por análisis de datos censurados con el algoritmo de estimación por máxima verosimilitud/ distribución gaussiana |
Este estudio |
|
Tasa de ingestión accidental para agricultores (IRW) |
l |
0,01-0,05 / distribución uniforme |
(WHO, 2006) |
|
Frecuencia de exposición (EF) |
Días trabajados |
max=343, min=30, moda=200/distribución triangular, Días trabajados en Costa Rica considerando días feriados y festividades |
Este estudio |
|
Duración de la exposición (ED) |
Años |
1 año de trabajo, un año de exposición |
NA |
|
Peso corporal medio (BW) |
kg |
Media= 80,9 y desviación estándar= 9,8/ distribución gaussiana |
(NCD Risk C, 2021) |
|
Tiempo promedio de exposición (AT) |
días/año |
365 un año de exposición |
NA |
|
Área media de la piel (SA) |
cm2 |
16522 |
(US EPA, 1988) |
|
Constante de permeabilidad de la piel (CP) |
- |
0,0001 |
(US EPA, 1988) |
|
Fracción del área de la piel en contacto (F) |
- |
min=0,4, max=0,9 / distribución uniforme |
(US EPA, 1988) |
|
Tiempo de exposición diaria promedio (ET) |
horas |
min=1, max=8 / distribución uniforme, jornada laboral en Costa Rica |
Este estudio |
|
Análisis de la dosis-respuesta |
|||
|
Edad promedio de la población (x) |
años |
52,4 |
(INEC, 2015) |
|
Parámetros dosis-respuesta |
|||
|
Función Heaviside’s (H) |
- |
1 |
(NRC, 2001; US EPA, 1988; Zhang et al., 2018) |
|
q1 pulmón |
- |
1,47E-10 |
(NRC, 2001; US EPA, 1988; Zhang et al., 2018) |
|
q2 pulmón |
- |
0 |
(NRC, 2001; US EPA, 1988; Zhang et al., 2018) |
|
k pulmón |
- |
3,92 |
(NRC, 2001; US EPA, 1988; Zhang et al., 2018) |
|
m pulmón |
- |
21,49 |
(NRC, 2001; US EPA, 1988; Zhang et al., 2018) |
|
q1 vejiga |
- |
0 |
(NRC, 2001; US EPA, 1988; Zhang et al., 2018) |
|
q2 vejiga |
- |
7,34E-13 |
(NRC, 2001; US EPA, 1988; Zhang et al., 2018) |
|
k vejiga |
- |
5,13 |
(NRC, 2001; US EPA, 1988; Zhang et al., 2018) |
|
m vejiga |
- |
14,7 |
(NRC, 2001; US EPA, 1988; Zhang et al., 2018) |
|
q1 piel |
- |
7,94E-10 |
(NRC, 2001; US EPA, 1988; Zhang et al., 2018) |
|
q2 piel |
- |
1,64E-12 |
(NRC, 2001; US EPA, 1988; Zhang et al., 2018) |
|
k piel |
- |
2,95 |
(NRC, 2001; US EPA, 1988; Zhang et al., 2018) |
|
m piel |
- |
6,87 |
(NRC, 2001; US EPA, 1988; Zhang et al., 2018) |
|
Años de vida ajustados por discapacidad |
|||
|
Edad promedio ponderada de la población |
años |
52,4 para trabajadores agrícolas en la provincia de Cartago |
(INEC, 2015) |
|
Esperanza de vida |
años |
80,3 |
(INEC, 2021) |
|
Severidad cáncer de piel (S) |
- |
0,2 |
(Havelaar & Melse, 2003) |
|
Severidad otros cánceres (S) |
- |
0,2 |
(Havelaar & Melse, 2003) |
|
Duración media del cáncer de piel (D morb) |
años |
4 |
(Havelaar & Melse, 2003) |
|
Duración media otros cánceres (D morb) |
años |
2 |
(Havelaar & Melse, 2003) |
|
Duración mortalidad anticipada (D mort) |
años |
Esperanza de vida - edad promedio ponderada |
Este estudio |
RESULTADOS
Concentraciones de arsénico: En total se obtuvo un 20% (7/36) de muestras sobre el límite de detección por arsénico entre los tres puntos. La concentración media estimada para la totalidad de las muestras fue de 0,0033 (IC 95%: 0,0019-0,0047) mg/L. Para el punto alto de la microcuenca la media estimada fue de 0,0027 (IC 95%: 0,0011-0,0043) mg/L, para el punto medio de 0,0034 (IC 95%: 0,0015-0,0053) mg/L; y para el punto bajo de 0,0038 (IC 95%: 0,0014-0,0073) mg/L. Tras aplicar la prueba de Peto-Prentice no se encontraron diferencias significativas entre los puntos de muestreo (p=0,9), se encontró un patrón uniforme entre las concentraciones de arsénico en los diferentes estratos altitudinales (Fig. 2).

Fig. 2. Media e intervalo de confianza al 95% estimado para la concentración de arsénico por punto de muestreo y límite de detección inferior (LDI) del método de medición
Para las concentraciones por estación de arsénico en la microcuenca del río Purires se observó que la media estimada durante la época seca fue de 0,0045 (IC 95%: 0,0025-0,0064) mg/L, mientras para la época lluviosa fue de 0,0027 (IC 95%: 0,0009-0,0046) mg/L. Tras la aplicación de la prueba Peto-Prentice se encontraron diferencias significativas entre las épocas climáticas (p=0,04), donde se observan concentraciones más altas de arsénico durante la época seca (Fig. 3).
Riesgo de presentar cáncer por exposición a bajas concentraciones de arsénico para trabajadores agrícolas durante la irrigación: De acuerdo con las Ecuaciones 1-3 y la aplicación de simulaciones de Monte Carlo se obtuvo el riesgo medio, el límite inferior (LI 95%) y el límite superior (LS 95%) de presentar cáncer por exposición a bajas concentraciones de arsénico (Tabla 2). El riesgo total de presentar alguno de los tipos de cáncer en evaluación fue de 1,20E-06 (1,10E-06 - 1,30E-06), ligeramente superior al nivel de riesgo aceptable por la US EPA de 1E-06 por la condición de salud en estudio (United States Environmental Protection Agency [US EPA], 1989). Adicionalmente, la ruta de exposición de mayor importancia es la ingestión accidental que presenta un riesgo 28 veces mayor que la absorción dermal, siendo la ruta de exposición con un mayor nivel de riesgo para todos los tipos de cáncer. Particularmente, en el caso del cáncer de pulmón y piel el riesgo por ingestión oral es al menos un orden de magnitud mayor que por absorción dermal, y tres órdenes de magnitud mayores para el riesgo de presentar cáncer de vejiga (Tabla 2).
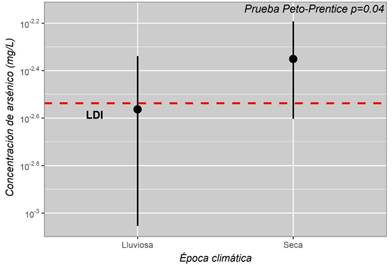
Fig. 3. Media e intervalo de confianza al 95% estimado para la concentración de arsénico por época climática y límite de detección inferior (LDI) del método de medición
TABLA 2
Riesgo medio, límite inferior (LI 95%) y límite superior (LS 95%) de presentar cáncer de pulmón, vejiga y piel por exposición a bajas concentraciones de arsénico para trabajadores agrícolas durante la irrigación
|
Tipo de cáncer |
Ruta de exposición |
Media |
LI 5% |
LS 95% |
|
Pulmón |
Total |
6,32E-07 |
5,80E-07 |
6,87E-07 |
|
Ingestión oral |
6,11E-07 |
5,59E-07 |
6,64E-07 |
|
|
Absorción dermal |
2,19E-08 |
2,04E-08 |
2,34E-08 |
|
|
Vejiga |
Total |
1,37E-10 |
1,15E-10 |
1,62E-10 |
|
Ingestión oral |
1,28E-10 |
1,07E-10 |
1,51E-10 |
|
|
Absorción dermal |
1,64E-13 |
1,43E-13 |
1,88E-13 |
|
|
Piel |
Total |
5,68E-07 |
5,20E-07 |
6,16E-07 |
|
Ingestión oral |
5,48E-07 |
5,01E-07 |
5,96E-07 |
|
|
Absorción dermal |
1,96E-08 |
1,83E-08 |
2,10E-08 |
|
|
Total |
Total |
1,20E-06 |
1,10E-06 |
1,30E-06 |
|
Ingestión oral |
1,16E-06 |
1,06E-06 |
1,26E-06 |
|
|
Absorción dermal |
4,15E-08 |
3,86E-08 |
4,44E-08 |
El cáncer de vejiga presenta un riesgo cuatro órdenes de magnitud menor que el cáncer de pulmón y piel. El nivel de riesgo por cáncer de pulmón es ligeramente mayor que el nivel de riesgo por cáncer de piel. A pesar de ello, de manera individual ninguno de los tres tipos de cáncer evaluados se encuentra por encima del límite máximo permisible 1E-06, pero en el caso del cáncer de pulmón y piel el riesgo se encuentra cerca de este límite (US EPA, 1989) (Tabla 2). Lo anterior, es relevante considerando que se utilizó para la modelación de riesgo el valor medio de edad de los trabajadores agrícolas de la zona de Cartago y peso corporal de los hombres costarricenses, el nivel de riesgo puede variar en función de la edad y el peso corporal, por lo cual, para personas de mayor edad y menor peso corporal a la media el riesgo por cáncer puede ser mayor (Instituto Nacional de Estadistica y Censos [INEC], 2015; NCD Risk Factor Collaboration [NCD RisC], 2017; Zhang et al., 2018; Lamm et al., 2021;).
Estimación de la carga de enfermedad para bajas concentraciones de arsénico para trabajadores agrícolas durante la irrigación: La estimación de la carga de enfermedad fue llevada a cabo utilizando el riesgo de presentar cáncer calculado con la Ecuación 3 y los AVAD con la Ecuación 4. Los años de vida ajustados por discapacidad totales fueron de 3,40E-05 (3,11E-05 – 3,69E-05) años-persona, por encima del límite permitido (1E-06) por la Organización Mundial de la Salud (OMS) (Tabla 3) (World Health Organization [WHO], 2017). En todos los escenarios AVP tuvieron un mayor peso que AVD en la carga de enfermedad, presentando 2,0 órdenes de magnitud más en el caso del cáncer de pulmón, vejiga y total; a diferencia del cáncer de piel que presentó 1,5 órdenes de magnitud más. Al comparar el nivel de la carga de enfermedad entre los tres tipos de cáncer en estudio los AVAD de cáncer de vejiga se encuentran por debajo de cuatro ordenes de magnitud con respecto a los de cáncer de pulmón y piel (Tabla 3). Se observó que la carga de enfermedad por cáncer de pulmón (1,79E-05) y piel (1,63E-05) es muy similar, ambos los AVAD se encuentran por encima de límite permitido por la OMS (1E-06) (Tabla 3) (WHO, 2017). En el caso de la presente evaluación los años de vida perdidos por una muerte prematura tienden a presentar un mayor impacto, puesto que es el desenlace más probable para los tipos de cáncer en estudio.
TABLA 3
Carga de enfermedad media, límite inferior (LI 95%) y límite superior (LS 95%) en años-persona por cáncer de pulmón, vejiga y piel por exposición a bajas concentraciones de arsénico para trabajadores agrícolas durante la irrigación
|
Ruta de exposición |
Años de vida perdida (AVP) |
Años vividos con discapacidad (AVD) |
Años de vida ajustados por discapacidad (AVAD) |
|||||||
|
Media |
LI 5% |
LS 95% |
Media |
LI 5% |
LS 95% |
Media |
LI 5% |
LS 95% |
||
|
Pulmón |
Total |
1,76E-05 |
1,62E-05 |
1,92E-05 |
2,53E-07 |
2,32E-07 |
2,75E-07 |
1,79E-05 |
1,64E-05 |
1,94E-05 |
|
Ingestión oral |
1,70E-05 |
1,56E-05 |
1,85E-05 |
2,44E-07 |
2,23E-07 |
2,66E-07 |
1,73E-05 |
1,58E-05 |
1,88E-05 |
|
|
Absorción dermal |
6,10E-07 |
5,69E-07 |
6,53E-07 |
8,75E-09 |
8,15E-09 |
9,37E-09 |
6,19E-07 |
5,77E-07 |
6,63E-07 |
|
|
Vejiga |
Total |
3,83E-09 |
3,22E-09 |
4,52E-09 |
5,50E-11 |
4,62E-11 |
6,48E-11 |
3,89E-09 |
3,27E-09 |
4,59E-09 |
|
Ingestión oral |
3,57E-09 |
2,99E-09 |
4,23E-09 |
5,12E-11 |
4,29E-11 |
6,06E-11 |
3,62E-09 |
3,03E-09 |
4,29E-09 |
|
|
Absorción dermal |
4,58E-12 |
3,98E-12 |
5,25E-12 |
6,57E-14 |
5,71E-14 |
7,53E-14 |
4,65E-12 |
4,04E-12 |
5,33E-12 |
|
|
Piel |
Total |
1,58E-05 |
1,45E-05 |
1,72E-05 |
4,54E-07 |
4,16E-07 |
4,93E-07 |
1,63E-05 |
1,49E-05 |
1,77E-05 |
|
Ingestión oral |
1,53E-05 |
1,40E-05 |
1,66E-05 |
4,38E-07 |
4,01E-07 |
4,77E-07 |
1,57E-05 |
1,44E-05 |
1,71E-05 |
|
|
Absorción dermal |
5,47E-07 |
5,10E-07 |
5,86E-07 |
1,57E-08 |
1,46E-08 |
1,68E-08 |
5,63E-07 |
5,25E-07 |
6,03E-07 |
|
|
Total |
Total |
3,35E-05 |
3,07E-05 |
3,64E-05 |
4,80E-07 |
4,40E-07 |
5,21E-07 |
3,40E-05 |
3,11E-05 |
3,69E-05 |
|
Ingestión oral |
3,23E-05 |
2,96E-05 |
3,52E-05 |
4,63E-07 |
4,24E-07 |
5,04E-07 |
3,28E-05 |
3,00E-05 |
3,57E-05 |
|
|
Absorción dermal |
1,16E-06 |
1,08E-06 |
1,24E-06 |
1,66E-08 |
1,55E-08 |
1,78E-08 |
1,17E-06 |
1,09E-06 |
1,26E-06 |
|
Por su parte, la comparación entre el nivel de riesgo (Tabla 2) y carga de enfermedad (Tabla 3), mantiene el mismo patrón con respecto a los diferentes niveles entre las rutas de exposición; sin embargo, en este caso los AVAD resultan ser más rigurosos que la estimación de riesgo en términos de aceptabilidad. Para la carga de enfermedad, el cáncer de pulmón y piel se encuentran por encima de los criterios de aceptabilidad, lo cual, les clasifica con un exceso de riesgo para las personas trabajadoras. A diferencia de la estimación de riesgo, los AVAD consideran variables demográficas como la composición etaria de la población expuesta y propias de la enfermedad en estudio, como la severidad, para evaluar un resultado en salud bajo determinadas condiciones de exposición, esto le convierte en un indicador más robusto para la evaluación de riesgos en salud que el cálculo de la dosis o probabilidad cruda de observar efectos (Devleesschauwer et al., 2014).
DISCUSIÓN
El patrón de las concentraciones de arsénico en la microcuenca del río Purires (Figuras 1 y 2), muestra que la fuente de contaminación es natural o antrópica de origen difuso, puesto que no hay diferencias espaciales entre las concentraciones de arsénico y se presentan niveles más altos durante la época seca. Particularmente, la ausencia de diferencias espaciales de las concentraciones de arsénico describe que no existe una adición de contaminantes a lo largo del cuerpo de agua, contrario a lo observado si la fuente del contaminante fuesen vertidos industriales o domiciliares que presentarían un aumento gradual entre los puntos de muestreo (Ogamba et al., 2021; Wilbers et al., 2014) (Figura 2). Lo anterior, puede ser consecuencia de la liberación natural de arsénico en el agua proveniente de zonas ricas en material volcánico, como el presente en la zona en estudio (Montero-Campos et al., 2010). Por otro lado, en la literatura se ha descrito que una de las principales fuentes de arsénico de origen antrópico son los plaguicidas utilizados en actividades agrícolas (Bundschuh et al., 2020), lo cual, si bien no se ha informado en el caso de Costa Rica, podría ser una fuente a considerar en el Río Purires ya que el comportamiento uniforme y difuso de las concentraciones de arsénico encontrado es característico de este tipo de fuentes (Figuras 2 y 3) (Herrera-Murillo et al., 2019).
Adicionalmente, se observó la presencia de diferencias significativas entre las épocas climáticas, con mayores concentraciones de arsénico durante la época seca, lo cual indica que las concentraciones ambientales tienen aportes constantes (Figura 3). Las variaciones de contaminantes en los cuerpos de agua tienden a tener variaciones estacionales por cambios climáticos como tormentas o lluvias torrenciales que propician el arrastre de sedimentos a los cuerpos de agua y la dilución de contaminantes; así como periodos secos donde hay un aumento de la evaporación que propicia la concentración de los contaminantes (Salles et al., 2016). Estos procesos pueden explicar mayores concentraciones de arsénico en la época seca en comparación con la época lluviosa en el río Purires, máxime que las concentraciones a lo largo del cuerpo de agua tienen un comportamiento uniforme.
En cuanto al nivel de riesgo de presentar cáncer de pulmón, vejiga y piel por exposición a bajas concentraciones de arsénico para trabajadores agrícolas durante la irrigación, fue posible observar que la principal ruta exposición es la ingestión oral (Tabla 1). El mayor riesgo de cáncer por ingestión ha sido previamente descrito en múltiples escenarios como: consumo de alimentos, ingestión accidental en trabajadores agrícolas, consumo directo y aspiración de aerosoles (Morales et al., 2000; Nasrabadi et al., 2015; Zhang et al., 2018, 2020). En el presente estudio cerca del 97% del riesgo atribuible se debe a ingestión oral, lo cual está muy por encima de otros estudios de evaluación de riesgos, donde el riesgo atribuible por ingestión fluctúa entre el 80-90% del riesgo atribuible (Nasrabadi et al., 2015; Zhang et al., 2018, 2020). Lo anterior, se puede deber a la evaluación específica de un trabajador agrícola que implica la cobertura de la piel para evitar la exposición al sol, en contraposición con los trabajos recién comparados que consideraron poblaciones inespecíficas (Robson & Toscano, 2007).
En este estudio el nivel de riesgo entre los tipos de cáncer evaluados presentó diferencias, principalmente, entre el cáncer de vejiga y los otros dos tipos de cáncer en estudio (Tabla 1). Este hallazgo es congruente con el comportamiento de la dosis-respuesta del cáncer de vejiga a bajas concentraciones de arsénico, donde el riesgo se reduce drásticamente y hasta puede presentar un comportamiento inverso al aumento leve de la dosis, lo cual se debe a que la curva de dosis-respuesta de arsénico para este cáncer ha sido ajustada en concentraciones de moderadas a altas (Tsuji et al., 2021). Por su parte, el riesgo por cáncer de pulmón a bajas concentraciones de arsénico presenta un comportamiento proporcional entre el aumento de la dosis y la respuesta (Tsuji et al., 2019). En el caso del cáncer de piel, los resultados son consistes con un aumento proporcional entre la dosis-respuesta; sin embargo, los parámetros para el ajuste presentan diferencias sustanciales en comparación con el cáncer de pulmón y vejiga, principalmente por las diferencias en los mecanismos de desarrollo de este tipo de cáncer (National Reasearch Council [NRC], 2001; US EPA, 1988; Zhang et al., 2018).
Adicionalmente, como parte de la evaluación de riesgos en este estudio se estimaron los AVAD, a diferencia de las estimaciones de riesgo unidireccional que consideran solamente la fuente de exposición, la carga de enfermedad considera la severidad de la enfermedad y los años potencialmente perdidos por discapacidad y mortalidad en la población expuesta (Timm et al., 2016). Esta cualidad del indicador resulta muy conveniente para ponderar el riesgo atribuible por morbilidad o mortalidad, en este estudio en promedio el 98% de la carga en salud es atribuible a una mortalidad prematura por presentar alguno de los tipos de cáncer en estudio, en el caso del cáncer de piel la carga atribuible es menor que en el resto de los casos, menor al 97%, lo cual se explica porque este tipo de cáncer tiene mayores probabilidades de recuperación que los otros cánceres en estudio (Tabla 1) (Havelaar & Melse, 2003).
En cuanto al nivel de aceptabilidad entre el nivel de riesgo convencional y la carga de enfermedad, la segunda resultó más rigurosa, donde se observa un exceso de riesgo para el cáncer de pulmón, piel y total, a diferencia de la medición de riesgo convencional que solo presentó un exceso de riesgo para el total (Tablas 1 y 2). Estimaciones de carga de enfermedad similares han sido descritas con las mismas ecuaciones para la estimación del riesgo, donde se observa que la medida de riesgo convencional es aceptable, pero la carga de enfermedad no lo es (Zhang et al., 2018, 2020). De esta manera, los AVAD son un indicador de riesgo con mayor conveniencia para la toma de decisiones, puesto tienen delimitaciones de riesgo más rigurosas en función del peso y severidad de la enfermedad (e.g. el peso de la mortalidad por cáncer es mayor que por diarrea, porque es más probable morir al padecer cáncer) (Devleesschauwer et al., 2014; Timm et al., 2016).
En este estudio la aplicación de los AVAD permitió delimitar los tipos de cáncer de mayor importancia en función de la carga de enfermedad (pulmón y piel) y la principal ruta de exposición (ingestión oral) (Tabla 2). Considerando que se trata de un escenario de exposición ocupacional y se ha determinado un exceso de riesgo, se debe considerar la jerarquización de las medidas para su control desde la más deseable a la menos deseable: eliminación, sustitución, soluciones tecnológicas, soluciones administrativas y uso de equipo personal (Cherrie, 2010). En el escenario de exposición de las personas agricultoras de la microcuenca del río Purires la eliminación y sustitución de la fuente de exposición no son opciones viables, puesto que el riego es vital para el desarrollo de las actividades agrícolas y no hay otra fuente de agua en la microcuenca para tal propósito.
Por tanto, la siguiente opción en la jerarquía de control es la aplicación de soluciones tecnológicas, como alternativa al presente caso, considerando que se trata de exposición a bajas concentraciones, la transición de un sistema de riego por aspersión a uno de riego por goteo directo en el suelo disminuiría casi por completo la ingestión accidental de agua y es viable para la producción de verduras y hortalizas (Montazar et al., 2019). Otras alternativas convencionales para la remoción del arsénico en agua como coagulación, filtración o intercambio iónico no son viables para cuerpos de agua como ríos, puesto que se trata de sistemas dinámicos (WHO, 2017).
Los resultados obtenidos presentan niveles de riesgo más bajos a los descritos en estudios similares en Estados Unidos, Canadá, China e India (Laskar et al., 2015; Morales et al., 2000; Zhang et al., 2018, 2020). A nivel regional se han realizado evaluaciones de riesgo por arsénico en México y Argentina; sin embargo, el modelo para la estimación difiere del utilizado en el presente estudio, por lo cual, los resultados no son comparables, ambos casos describen un exceso de riesgo para las poblaciones expuestas (Fernández-Macías et al., 2020; Leonarduzzi et al., 2020; Martínez-Acuña et al., 2016; Mendoza et al., 2017; Navoni et al., 2014).
En Costa Rica se ha realizado una evaluación cuantitativa de riesgo por exposición a arsénico en agua en las regiones Chorotega y Huetar Norte en sistemas de abastecimiento de agua para consumo determinando un exceso de riesgo; sin embargo, la metodología utilizada para la estimación de riesgo difiere de la utilizada en el presente estudio, por lo cual, los resultados tampoco son comparables (Herrera-Murillo et al., 2019). Las diferencias metodológicas en ambos casos, a nivel regional y local, es que estos estudios utilizaron modelos estáticos de riesgo y sin parámetros específicos por tipo de cáncer, de ahí que los resultados obtenidos no puedan ser comparados, además, el presente estudio utiliza como métrica en salud los AVAD, indicador no estimado estos estudios (Robson & Toscano, 2007; US EPA, 1989).
En consideración de lo anterior, el principal aporte de este estudio es la aplicación de una estructura metodológica que engloba modelos de riesgo dinámicos y multidimensionales con el potencial de ser utilizados para la evaluación de la exposición a arsénico y otros contaminantes químicos, tanto en altas como pequeñas concentraciones con alto grado robustez y específicos por tipo de cáncer o etiología en estudio (Robson & Toscano, 2007). Además, de la incorporación de los AVAD como indicador de riesgo, lo cual, permite la comparación de la carga de salud por la causa en estudio con otras causas, facilitando la priorización de acciones en salud y el proceso de comunicación del riesgo (Timm et al., 2016). Su divulgación y aplicación a nivel regional y local sería de gran importancia para la toma de decisiones, tomando en cuenta la alta frecuencia del arsénico en las fuentes de agua en América Latina y en Costa Rica (Bundschuh et al., 2020; McClintock et al., 2012).
Entre las principales limitaciones del presente estudio se encuentra que evalúa solamente un grupo etario y poblacional en condiciones muy específicas de exposición, por lo cual, los presentes resultados no pueden ser extrapolados a la población en general ni a otros escenarios de ingestión oral o absorción dermal como consumo directo del agua o actividades recreativas en el cuerpo de agua. Además, los resultados son aplicables para la media de los agricultores de la provincia de Cartago, puesto que el modelaje fue realizado para la edad, peso corporal y sexo predominante de este grupo poblacional. Adicionalmente, los casos de exceso de riesgo no implican que necesariamente habrá desarrollo de cáncer, sino que la probabilidad de presentar la enfermedad es mayor en este escenario de exposición.
AGRADECIMIENTOS
Se agradece a la Vicerrectoría de Investigación de la Universidad de Costa Rica por su apoyo a los proyectos “Agentes microbiológicos patógenos y contaminantes químicos en el agua superficial de la microcuenca del río Purires, Cartago” y “Análisis de riesgo de contaminantes microbiológicos y químicos en el agua superficial de la microcuenca del río Purires, Cartago.” mediante los cuales fue posible elaborar este manuscrito.
ÉTICA, CONFLICTO DE INTERESES Y DECLARACIÓN DE FINANCIAMIENTO
Declaro/declaramos haber cumplido con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en la preparación de este documento; que no hay conflictos de interés de ningún tipo, y que todas las fuentes financieras se detallan plena y claramente en la sección de agradecimientos. Asimismo, estoy/estamos de acuerdo con la versión editada final de esta publicación. El respectivo documento legal firmado se encuentra en los archivos de la revista.
La declaración de contribución de cada autor es la siguiente:
E.M.M., K.B.J. y L.M.C.J: conceptualización y diseño de estudio. E.M.M.: recopilación de información, análisis de datos, programación y diseño del modelo de riesgo. K.B.J., W.B.S. y L.M.C.J: recolección y procesamiento de muestras. Todos los coautores: preparación y aprobación final del manuscrito.
REFERENCIAS
Alonso, D. L., Latorre, S., Castillo, E., & Brandão, P. F. B. (2014). Environmental occurrence of arsenic in Colombia: A review. Environmental Pollution, 186, 272–281. https://doi.org/10.1016/j.envpol.2013.12.009
Astorga, Y. (2007). Diagnóstico de la Microcuenca del Río Purires. https://fdocuments.es/document/diagnostico-micro-cuenca-rio-purires.html?page=1
Barrantes, K., Chacon, L., Solano, M., & Achí, R. (2013). Contaminación fecal del agua superficial de la microcuenca del río Purires, Costa Rica, 2010-2011. Revista de La Sociedad Venezolana de Microbiología, 33, 40–45.
Bundschuh, J., Armienta, M. A., Morales-Simfors, N., Alam, M. A., López, D. L., Delgado Quezada, V., Dietrich, S., Schneider, J., Tapia, J., Sracek, O., Castillo, E., Marco Parra, L. M., Altamirano Espinoza, M., Guimarães Guilherme, L. R., Sosa, N. N., Niazi, N. K., Tomaszewska, B., Lizama Allende, K., Bieger, K., … Ahmad, A. (2020). Arsenic in Latin America: New findings on source, mobilization and mobility in human environments in 20 countries based on decadal research 2010-2020. Critical Reviews in Environmental Science and Technology, 51(16), 1–139. https://doi.org/10.1080/10643389.2020.1770527
Bundschuh, J., Litter, M. I., Parvez, F., Román-Ross, G., Nicolli, H. B., Jean, J. S., Liu, C. W., López, D., Armienta, M. A., Guilherme, L. R. G., Cuevas, A. G., Cornejo, L., Cumbal, L., & Toujaguez, R. (2012). One century of arsenic exposure in Latin America: A review of history and occurrence from 14 countries. Science of the Total Environment, 429, 2-35. https://doi.org/10.1016/j.scitotenv.2011.06.024
Chacón, L., Arias, V., Barrantes, K., Beita-Sandí, W., Reyes, L., & Achí, R. (2018). Enterococci as a key parameter for water quality index: Purires River, Costa Rica. Journal of Water and Health, 16(6), 1007–1017. https://doi.org/10.2166/wh.2018.087
Cherrie, J. W. (2010). Assessing the effectiveness of control. In J. Cherrie, R. Howie & S. Semple (Eds.). Monitoring for Health Hazards at Work (4th ed. Pp:225-272). Wiley-Blackwell
Córdoba, J. (2012). Análisis de vulnerabilidad de las comunidades de Coris y Tablón, Provincia de Cartago, Costa Rica. Revista Ciencias Espaciales, 8(1), 231-259. https://www.lamjol.info/index.php/CE/article/view/2051/1846
Devleesschauwer, B., Havelaar, A. H., Maertens De Noordhout, C., Haagsma, J. A., Praet, N., Dorny, P., Duchateau, L., Torgerson, P. R., Van Oyen, H., & Speybroeck, N. (2014). DALY calculation in practice: A stepwise approach. International Journal of Public Health, 59(3), 571–574. https://doi.org/10.1007/s00038-014-0553-y
Dore, M. H. (2015). Global drinking water management and conservation: Optimal decision-making. Springer International Publishing. https://doi.org/10.1007/978-3-319-11032-5
Eaton, A., Clesceri, L.S., Franson, M. A. H., Rice, E. W., & Greanberg, A. E. (Eds.). (2005). Standard Methods of Examination Water and Wastewater (Vol 21). American Public Health Association.
Fernández-Macías, J. C., González-Mille, D. J., García-Arreola, M. E., Cruz-Santiago, O., Rivero-Pérez, N. E., Pérez-Vázquez, F., & Ilizaliturri-Hernández, C. A. (2020). Integrated probabilistic risk assessment in sites contaminated with arsenic and lead by long-term mining liabilities in San Luis Potosi, Mexico. Ecotoxicology and Environmental Safety, 197, 110568. https://doi.org/10.1016/j.ecoenv.2020.110568
Gentry, P. R., Clewell, H. J., Greene, T. B., Franzen, A. C., & Yager, J. W. (2014). The impact of recent advances in research on arsenic cancer risk assessment. Regulatory Toxicology and Pharmacology, 69(1), 91–104. https://doi.org/10.1016/j.yrtph.2014.02.006
Havelaar, A. H., & Melse, J. M. (2003). Quantifying public health risk in the WHO Guidelines for Drinking Water Quality. https://bit.ly/3zt74xg
Helsel, D. R. (2012). Statistics for censored environmental data using Minitab® and R (2nd ed.). John Wiley & Sons, Inc. https://doi.org/10.1002/9781118162729
Herrera-Murillo, J., Mora-Campos, D., Suarez-Serrano, A., Chaves-Villalobos, M., Salas-Jiménez, P., Gamboa-Jiménez, A., & Anchía-Leitón, D. (2019). Determinación de los niveles de arsénico presentes en sistemas de abastecimiento de agua de las regiones Chorotega y Huetar Norte de Costa Rica, América Central. Revista Geográfica de América Central, 4(61E), 101. https://doi.org/10.15359/rgac.61-4.5
Instituto Nacional de Estadística y Censos (INEC). (2015). VI Censo Nacional Agropecuario. https://bit.ly/3QybnNs
Instituto Nacional de Estadística y Censos (INEC). (2021). Estimaciones y proyecciones de población. https://bit.ly/3Ac97Gh
Khan, K. M., Chakraborty, R., Bundschuh, J., Bhattacharya, P., & Parvez, F. (2020). Health effects of arsenic exposure in Latin America: An overview of the past eight years of research. Science of the Total Environment, 710, 136071. https://doi.org/10.1016/j.scitotenv.2019.136071
Lamm, S. H., Boroje, I. J., Ferdosi, H., & Ahn, J. (2021). A review of low-dose arsenic risks and human cancers. Toxicology, 456, 152768. https://doi.org/10.1016/j.tox.2021.152768
Laskar, M., Gazi, E., Basu, B., Chowdhury, S., Ahmad, S., & Khan, M. (2015). Disability adjusted life years among arsenicosis patients in an arsenic-affected area of southern Bangladesh. Mediscope, 2(1), 4–12. https://doi.org/10.3329/mediscope.v2i1.24733
Leonarduzzi, E., Lunguni, I., & Colussi, C. (2020). Evaluación de poblaciones rurales expuestas a arsénico en el agua de consumo en la Provincia de Santa Fe, Argentina. Estrategias de comunicación y prevención de riesgos. Revista de Salud Ambiental, 20(2), 150–159.
Martínez-Acuña, M. I., Mercado-Reyes, M., Alegría-Torres, J. A., & Mejía-Saavedra, J. J. (2016). Preliminary human health risk assessment of arsenic and fluoride in tap water from Zacatecas, México. Environmental Monitoring and Assessment, 188, 476. https://doi.org/10.1007/s10661-016-5453-6
McClintock, T. R., Chen, Y., Bundschuh, J., Oliver, J. T., Navoni, J., Olmos, V., Lepori, E. V., Ahsan, H., & Parvez, F. (2012). Arsenic exposure in Latin America: Biomarkers, risk assessments and related health effects. Science of the Total Environment, 429, 76–91. https://doi.org/10.1016/j.scitotenv.2011.08.051
Mendoza, O., Sánchez, R., Barrón, J., Cuevas, H., Escalante, P., & Solano, R. (2017). Riesgos potenciales de salud por consumo de agua con arsénico en Colima , México. Salud Pública De México, 59(1), 34-40
Montazar, A., Cahn, M., & Putman, A. (2019). Research advances in adopting drip irrigation for california organic spinach: Preliminary findings. Agriculture, 9(8), 1–14. https://doi.org/10.3390/agriculture9080177
Montero-Campos, V., Quesada-Kimsey, J., Ledezma-Espinoza, A., & Sandoval-Mora, J. A. (2010). Determinación de arsénico en abastecimientos de agua para consumo humano de la provincia de Cartago, Costa Rica. Acta Médica Costarricense, 52(2), 96-101. https://doi.org/10.51481/amc.v52i2.642
Morales, K. H., Ryan, L., Kuo, T. L., Wu, M. M., & Chen, C. J. (2000). Risk of internal cancers from arsenic in drinking water. Environmental Health Perspectives, 108(7), 655–661. https://doi.org/10.1289/ehp.00108655
Nasrabadi, T., Abbasi Maedeh, P., Sirdari, Z. Z., Shirani Bidabadi, N., Solgi, S., & Tajik, M. (2015). Analyzing the quantitative risk and hazard of different waterborne arsenic exposures: case study of Haraz River, Iran. Environmental Earth Sciences, 74(1), 521–532. https://doi.org/10.1007/s12665-015-4058-7
Navoni, J. A., De Pietri, D., Olmos, V., Gimenez, C., Bovi Mitre, G., de Titto, E., & Villaamil Lepori, E. C. (2014). Human health risk assessment with spatial analysis: Study of a population chronically exposed to arsenic through drinking water from Argentina. Science of the Total Environment, 499, 166–174. https://doi.org/10.1016/j.scitotenv.2014.08.058
NCD Risk Factor Collaboration (NCD RisC). (2017). Country profile: Costa Rica. https://www.ncdrisc.org/country-profile.html
National Reasearch Council (NRC). (2001). Arsenic in Drinking Water: 2001 Update The National Academies Press. https://doi.org/10.17226/10194
Ogamba, E. N., Charles, E. E., & Izah, S. C. (2021). Distributions, pollution evaluation and health risk of selected heavy metal in surface water of Taylor creek, Bayelsa State, Nigeria. Toxicology and Environmental Health Sciences, 13(2), 109–121. https://doi.org/10.1007/s13530-020-00076-0
Palma-Lara, I., Martínez-Castillo, M., Quintana-Pérez, J. C., Arellano-Mendoza, M. G., Tamay-Cach, F., Valenzuela-Limón, O. L., García-Montalvo, E. A., & Hernández-Zavala, A. (2020). Arsenic exposure: A public health problem leading to several cancers. Regulatory Toxicology and Pharmacology, 110, 104539. https://doi.org/10.1016/j.yrtph.2019.104539
Quintanilla, B. (2017). Estadística en variables con censura: aplicación a datos medioambientales [Tesis de Maestria, Universitat Oberta de Catalunya]. https://bit.ly/3b6lTw2
Robson, M., & Toscano, W. (2007). Risk assessment for environmental health. John Wiley & Sons, Inc.
Salles, F. J., de Toledo, M. C. B., César, A. C. G., Ferreira, G. M., & Barbério, A. (2016). Cytotoxic and genotoxic assessment of surface water from São Paulo State, Brazil, during the rainy and dry seasons. Ecotoxicology, 25(4), 633–645. https://doi.org/10.1007/s10646-016-1622-1
Savarimuthu, X., Hira-Smith, M. M., Yuan, Y., von Ehrenstein, O. S., Das, S., Ghosh, N., Guha Mazumder, D. N., & Smith, A. H. (2006). Seasonal variation of arsenic concentrations in Tubewells in West Bengal, India. Journal of Health, Population and Nutrition, 24(3), 277–281. https://doi.org/10.3329/jhpn.v24i3.713
Sharma, S., Kaur, J., Nagpal, A. K., & Kaur, I. (2016). Quantitative assessment of possible human health risk associated with consumption of arsenic contaminated groundwater and wheat grains from Ropar Wetand and its environs. Environmental Monitoring and Assessment, 188(9), 506. https://doi.org/10.1007/s10661-016-5507-9
Smith, A. H., Ercumen, A., Yuan, Y., & Steinmaus, C. M. (2009). Increased lung cancer risks are similar whether arsenic is ingested or inhaled. Journal of Exposure Science and Environmental Epidemiology, 19(4), 343–348. https://doi.org/10.1038/jes.2008.73
Timm, C., Luther, S., Jurzik, L., Hamza, I. A., & Kistemann, T. (2016). Applying QMRA and DALY to assess health risks from river bathing. International Journal of Hygiene and Environmental Health, 219(7), 681-692. https://doi.org/10.1016/j.ijheh.2016.07.017
Tsuji, J. S., Chang, E. T., Gentry, P. R., Clewell, H. J., Boffetta, P., & Cohen, S. M. (2019). Dose-response for assessing the cancer risk of inorganic arsenic in drinking water: the scientific basis for use of a threshold approach. Critical Reviews in Toxicology, 49(1), 36-84. https://doi.org/10.1080/10408444.2019.1573804
Tsuji, J. S., Garry, M. R., Perez, V., & Chang, E. T. (2015). Low-level arsenic exposure and developmental neurotoxicity in children: A systematic review and risk assessment. Toxicology, 337, 91–107. https://doi.org/10.1016/j.tox.2015.09.002
Tsuji, J. S., Lennox, K. P., Watson, H. N., & Chang, E. T. (2021). Essential concepts for interpreting the dose-response of low-level arsenic exposure in epidemiological studies. Toxicology, 457, 152801. https://doi.org/10.1016/j.tox.2021.152801
United States Environmental Protection Agency (US EPA). (1988). Special report on ingested inorganic arsenic: skin cancer; nutritional essentiality (EPA/625/3-89/013). https://archive.epa.gov/raf/web/pdf/epa_625_3-87_013.pdf
United States Environmental Protection Agency (US EPA). (1989). Risk Assessment Guidance for Superfund. Volume I Human Health Evaluation Manual (Part A). EPA/540/1-89/002. https://www.epa.gov/sites/default/files/2015-09/documents/rags_a.pdf
United States Environmental Protection Agency (US EPA). (2011). Exposure factors handbook 2011 Edition (Final Report). (EPA/600/R-090/052F). https://cfpub.epa.gov/ncea/risk/recordisplay.cfm?deid=236252
Veas, N. (2011). Gestión del agua para consumo humano en la microcuenca del río Purires, [Tesis Maestria, Cetro Agonómico Tropical de Investigación y Enseñanza (CATIE)]. https://bit.ly/3v8jwQo
World Health Organization (WHO). (2006). Who Guidelines for the safe use wastewater, excreta and greyewater. Volumen I policy and regulatory aspects. https://www.who.int/publications/i/item/9241546824
World Health Organization (WHO). (2017). Guidelines for drinking-water quality: fourth edition incorporating the first addendum. https://bit.ly/2MUdxrb
Wilbers, G. J., Becker, M., Nga, L. T., Sebesvari, Z., & Renaud, F. G. (2014). Spatial and temporal variability of surface water pollution in the Mekong Delta, Vietnam. Science of the Total Environment, 485-486(1), 653–665. https://doi.org/10.1016/j.scitotenv.2014.03.049
Zhang, H., Chang, S., Wang, L., & Wang, W. (2018). Estimating and comparing the cancer risks from THMs and low-level arsenic in drinking water based on disability-adjusted life years. Water Research, 145, 83-93. https://doi.org/10.1016/j.watres.2018.08.012
Zhang, H., Wang, L., Wang, Y., & Chang, S. (2020). Using disability-adjusted life years to estimate the cancer risks of low-level arsenic in drinking water. Journal of Environmental Science and Health, Part A, 55(1), 63–70. https://doi.org/10.1080/10934529.2019.1667167