
Diversidad de avifauna en matrices mixtas de ecosistemas alterados por ganadería y acuicultura en una zona costera de Cañas, Costa Rica
Esmeralda Arévalo-Huezo1![]() , Silvio Boyat1
, Silvio Boyat1![]() , Hilary Calderón-Marín1
, Hilary Calderón-Marín1![]() , Valeria Castillo-Gamboa1
, Valeria Castillo-Gamboa1![]() , Dayana Pérez-Zúñiga1
, Dayana Pérez-Zúñiga1![]() & Steve Stephens-Cárdenas1
& Steve Stephens-Cárdenas1![]()
1. Universidad Latina de Costa Rica Escuela de Ciencias Biológicas, Sede San Pedro. San Pedro, Montes de Oca, San José, Costa Rica esmeralda.arevalo@ulatina.net, silvio.bsdr@gmail.com, calderon.marin97@gmail.com, casvaleria1995@gmail.com, dayanaperez0476@gmail.com, stephens333@gmail.com
Recibido 18-I-2022 □ Corregido 04-V-2022 □ Aceptado 19-V-2022
DOI: https://doi.org/10.22458/urj.v14i2.3968
|
ABSTRACT. “Avian diversity of a mixed ecosystem matrix altered by cattle raising and aquaculture in a coastal zone of Cañas, Costa Rica¨ Introduction: Fragmentation due to the change in land use because of anthropogenic pressures has caused loss of habitats for many bird species, causing from population mobilizations to local extinctions. Níspero in Cañas, is a coastal community in Costa Rica, which presents a mixed landscape, made up of mangrove patches and tropical dry forest, highly vulnerable due to aquaculture, industrialization, and the increase in the cattle frontier. One of the proposed strategies for the conservation of these ecosystems is the sustainable use of natural resources. However, there is still profound lack of knowledge about the bird communities present in these heterogeneous ecological matrices Objective: to characterize the diversity of birdlife in a fragmented landscape. Methods: From July 2018 to January 2019, bird counts were carried out. The sampling sites were classified into four categories: mangrove, pasture, shrimp farms and deciduous forest. General alpha richness, abundance, and diversity were determined for each site. Results: A total 1109 individuals distributed in 42 families, 97 genera and 125 species were registered. The most representative families were Ardeidae and Tyrannidae. Shrimp farms had the highest richness indexes, followed by mangrove and pasture areas. In terms of diversity, no significant differences were found. Conclusion: This first approach demonstrates the importance of efforts to integrate disturbed landscapes into conservation programs, given that they present new ecological configurations that can be exploited by various bird species.
Keywords: birds, disturbed ecosystems, biodiversity, shrimp farms, mangrove.
|
RESUMEN. Introducción: La fragmentación debido al cambio de uso de suelos por presiones antropogénicas ha provocado pérdida de hábitats para muchas especies de aves, causando desde movilizaciones poblacionales hasta extinciones locales. Níspero de Cañas, es una comunidad costera de Costa Rica, que presenta un paisaje mixto, compuesto por fragmentos de mangle y bosque seco tropical, altamente vulnerables debido a la acuicultura, industrialización y aumento de la frontera ganadera. Una de las estrategias propuestas para la conservación de estos ecosistemas es el uso sostenible de los recursos naturales. Sin embargo, aún hay profundo desconocimiento de las comunidades de aves presentes en estas matrices ecológicas heterogéneas. Objetivo: caracterizar la diversidad de la avifauna en un paisaje fragmentado. De julio del 2018 a enero del 2019, se llevaron a cabo conteos mensuales de aves. Los sitios de muestreo se clasificaron en cuatro categorías: mangle, potrero, camaroneras y bosque caducifolio. Se determinó la riqueza, abundancia y diversidad alfa general para cada sitio. Resultados: Se registraron 1109 individuos distribuidos en 42 familias, 97 géneros y 125 especies. Las familias más representativas fueron Ardeidae y Tyrannidae. Las camaroneras presentaron los mayores índices de riqueza, seguido del mangle y los potreros. En términos de diversidad no se encontraron diferencias significativas. Conclusión: Este primer abordaje evidencia la importancia de los esfuerzos por integrar paisajes perturbados a los programas de conservación, ya que presentan configuraciones ecológicas nuevas que pueden ser aprovechadas por diversas especies de aves.
Palabras clave: aves; ecosistemas perturbados; biodiversidad; camaroneras; manglar.
|
La pérdida de biodiversidad se ha convertido en una de las problemáticas más apremiantes a nivel global en las últimas décadas. Estamos enfrentando una alarmante disminución en la riqueza y abundancia de especies a través de la mayoría de grupos taxonómicos, incluidos mamíferos, reptiles, anfibios, aves y artrópodos (Medina et al., 2004; Tellería, 2013; Sánchez-Bayo & Wyckhuys, 2019). La fragmentación y pérdida de hábitat se cuentan entre los principales factores causales de la pérdida de diversidad a nivel global (Janzen, 1988), siendo estas, resultado directo de las actividades antropogénicas. Los cambios de uso de suelos que tradicionalmente acompañan los procesos de desarrollo económico humano, implican la transformación o eliminación de cobertura vegetal en extensas áreas, fragmentando los bosques (Cuevas et al., 2010); para generar matrices productivas que permitan suplir la creciente demanda de espacio y recursos necesarios para las poblaciones humanas ( Haddad et al., 2015; Wilson et al., 2016; Otavo & Echeverría, 2017; World Wild Fund for Nature [WWF], 2018)
La fragmentación de hábitat es un proceso que no solo reduce el tamaño de los fragmentos de vegetación que aprovechan las especies, también altera los procesos de conectividad biológica y funcional, deteriorando la calidad de los ecosistemas (Andrén, 1994). Múltiples estudios presentan evidencia controversial de que estos cambios en el ecosistema también crean nuevas configuraciones de hábitats que eventualmente pueden ser aprovechadas por especies locales o exóticas que logran adaptarse a estas nuevas condiciones (Fakheran et al., 2010; Villegas-Arguedas, 2019). Estos nuevos espacios son fragmentos del ecosistema cuyas condiciones no existían previamente o que, de existir, no ofrecen condiciones aptas para las especies nativas (Sebastián-González & Green, 2016). El grupo de las aves es uno de los grupos más impactados por la trasformación del uso de suelo, por lo que se hace especialmente relevante identificar el impacto de la fragmentación para desarrollar procesos de conservación. Lo anterior puede tener efectos de importancia ecológica, ya que las aves cumplen funciones de polinización, dispersión de semillas y controladores biológicos (González-Martín del Campo et al., 2019).
En Mesoamérica grandes áreas de bosque han sido deforestadas, como resultado de la expansión de la frontera agrícola (Food and Agriculture Organization [FAO], 2016; Jadin et al., 2016). El bosque seco tropical es uno de los ecosistemas que se ve más afectado por estas transformaciones debido a su alta fragilidad, a sus características ecológicas, tales como un notable déficit hídrico estacional, la vulnerabilidad a incendios y su alto grado de endemismos (Collazos-González & Echeverry-Galvis, 2017). Por otro lado, los manglares comprenden otro de los ecosistemas altamente amenazados por el cambio de uso de suelo. Los manglares son ecosistemas altamente productivos y con gran biodiversidad, estos sitios son utilizados como áreas de reproducción, refugio y alimentación para distintas especies de aves acuáticas, migratorias y terrestres (Chaves-Fonnegra et al., 2005; Zamora-Trejos & Cortés, 2009).
En Costa Rica, a pesar de los esfuerzos en conservación y los procesos de recuperación de los bosques (Calvo-Alvarado et al., 2009; Algeet-Abarquero et al., 2015), la información disponible sobre la estructura y diversidad de aves en matrices productivas y paisajes fragmentados en Mesoamérica, aún es incipiente (Cárdenas et al., 2003). En particular, en las zonas costeras del pacífico central de Costa Rica, el avance de la frontera productiva indujo la transformación del bosque seco e importantes áreas de manglar aledañas. Lo anterior ha generado una matriz heterogénea de ecosistemas, constituida por pastizales para producción de ganado, fragmentos remanentes de manglar, salineras y granjas productoras de camarones (Cifuentes-Jara et al., 2014).
El objetivo de este estudio fue evaluar la diversidad de aves presentes en un paisaje fragmentado en las zonas costeras del pacifico central específicamente en la comunidad del Níspero en Cañas, Guanacaste, Costa Rica, con el fin de determinar el impacto de la fragmentación sobre la comunidad de aves de la zona y generar una línea base de información, que permita el diseño a futuro de estrategias de conservación, aprovechamiento sostenible de los ecosistemas y la diversidad faunística local.
MATERIALES Y MÉTODOS
Área de Estudio: El estudio se desarrolló entre julio del 2018 y enero del 2019, en una matriz mixta de bosques de mangle y bosque tropical seco, intervenida por áreas transformadas para desarrollo de actividades humanas de carácter productivo. El área de interés abarca desde la desembocadura del río Tempisque en la zona interna del Golfo de Nicoya, hasta la zona terrestre en el costado oeste del río; en inmediaciones de la localidad de Níspero de Cañas, Guanacaste, Costa Rica (Fig. 1). Se caracteriza por tener una gran variedad de flora y fauna producto de la diversidad de ecosistemas predominantes como manglares, bosque seco tropical y bosque seco tropical en transición a bosque subhúmedo, ríos y esteros que allí se encuentran. La región presenta elevación máxima de 70 m.s.n.m., temperatura media anual de 27,67°C y una precipitación media anual de 1 544mm.
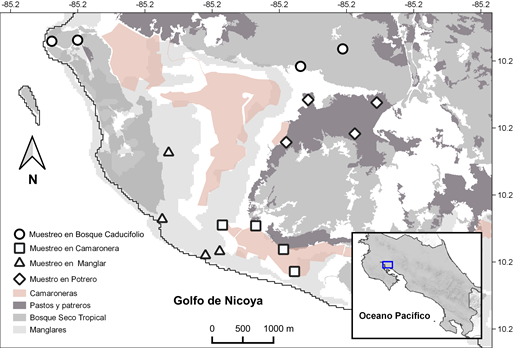
Fig. 1. Área de estudio indicando los puntos de conteo de aves según fragmentos ecosistemas en inmediaciones de Níspero de Cañas, Costa Rica.
Muestreo de aves: El área de muestreo evaluada se clasificó en cuatro categorías definidas por el tipo de uso de suelo o el tipo de cobertura vegetal asociada: granjas productoras de camarones o camaroneras (CM), bosque caducifolio (BC), mangle (MG) y potrero (PT). Las categorías de bosques, tanto BC como MG, fueron claramente identificadas según sus características ambientales y su composición vegetal. Las granjas camaroneras (CM) se identificaron como zonas que contienen uno o más estanques de tierra ubicados en áreas previamente ocupadas por bosques de mangle, producto de los eventos de deforestación de mangle ocurrida en el periodo de 1956 – 1985, en la zona (Cifuentes-Jara et al., 2014). Los potreros (PT) se definieron como áreas de pastizales de origen antropogénico, producto del cambio de uso de suelo para fines de producción pecuaria. Para cada categoría, se establecieron aleatoriamente cuatro puntos de observación, para un total de 16, utilizando el programa QGIS 3.16 (QGIS Development Team, 2020). Como criterio de selección de los puntos de observación, se priorizó el fácil acceso y se garantizó representatividad de todas las áreas definidas; procurando una distancia de al menos 200m entre sitios, para evitar solapamiento espacial.
Durante el periodo de estudio, se visitó cada uno de los puntos de observación una vez cada mes para un total de siete muestreos. Los censos se desarrollaron mediante la detección visual, con apoyo de binoculares Bushnell 10 × 50, y auditiva de especies, siguiendo el método de transepto en franjas (Ralph et al., 1997). Específicamente, se desarrollaron caminatas lineales, de una extensión promedio de 200m, en las cuales se registró la hora del censo, el número de punto de muestreo, la especie y el número de individuos por especie durante 20 minutos (Vergara et al., 2017). Las observaciones de aves se desarrollaron en tres periodos, los cuales abarcaban: mañana 6:00 – 11:00 h, tarde 15:00 - 18:00 h y noche 19:00 - 22:00 h. El último periodo se realizó con el fin de detectar aves nocturnas presentes en la zona. Todas las especies observadas o escuchadas dentro del rango del ecosistema definido, fueron tomadas corroboradas mediante el cotejo de imágenes con la guía de aves de Garrigues y Dean (2014).
Análisis de datos: Para evitar el efecto de correlación temporal en los análisis, se utilizó la totalidad de datos de cada punto de muestreo. Se estimaron indicadores de riqueza y abundancia de las especies registradas, utilizando los índices de equitatividad de Shannon (H), dominancia de Simpson (S), y el índice de diversidad de Simpson (1-S). Se realizaron pruebas t-student, entre sitios, para determinar diferencias significativas (α=0,05) entre los índices de diversidad evaluados (Cárdenas et al., 2003). Para determinar el grado de diferenciación, así como los factores (especies) que determinan la diferenciación entre las áreas de trabajo, se ejecutaron análisis multivariados: el análisis de similitud ANOSIM, un análisis de conglomerados basados en el estimador de Bray-Curtis (Cluster) y el análisis de porcentaje de similitud (SIMPER) (Pacheco-Vargas et al., 2018). Todos los procedimientos de diversidad se ejecutaron en el programa estadístico PAST 4.0 (Hammer et al., 2001). Los modelos de estadística multivariada se ejecutaron en el utilizando los módulos disponibles en el paquete VEGAN, en el programa R (Wagner, 2015) .
RESULTADOS
Se identificaron un total de 1 110 individuos distribuidos en 39 familias, 79 géneros y 105 especies (Tabla 1 en Apéndice), equivalentes al 13,5% de las 923 especies registradas para el país (Garrigues et al., 2021). Las familias más representativas fueron Ardeidae y Tyrannidae, cada una con 12 especies. Sin embargo, en términos de la abundancia las familias con mayor representatividad de individuos fueron Scolopacidae y Ardeidae, las cuales, a pesar de presentar 1 y 2 especies, respectivamente, presentaron registros de 189 y 159 individuos, respectivamente (Fig. 2).
En términos de la abundancia y riqueza de aves asociadas a los hábitats registrados, el mangle presentó la mayor abundancia (547), seguido de las camaroneras (344), potreros (134) y el bosque caducifolio (85). La evaluación de la riqueza de especies determinó que camaroneras presentaron el mayor número de especies registradas, seguido del manglar (Tabla 1). Se encontró que los hábitats de camaroneras, manglar y potreros presentaron familias exclusivas, es decir, que solo se registran en uno de los hábitats previamente mencionados. En el caso del bosque caducifolio, no se registraron especies exclusivas, pues todas las especies allí registrados fueron igualmente registrados en al menos uno de los restantes hábitats. Al registrar las especies, se encontró que las camaroneras presentan la mayor cantidad de especies únicas, seguido de los espacios de potrero y mangle (Tabla 2).

Fig. 2. Número total de especies e individuos por familia registrados en la matriz completa de ecosistemas evaluada (camaroneras, bosque caducifolio, manglar y potrero).
TABLA 1
Resumen categorías taxonómicas registradas en los cuatro hábitats de la matriz ecosistémica. Número de especies totales (número de especies excesivas)
|
Categorías |
Abundancia |
Familias |
Genero |
Especies |
|
Bosque caducifolio (BC) |
85 |
19 (-) |
37 (5) |
39 (5) |
|
Camaroneras (CM) |
344 |
27 (5) |
61 (19) |
37 (18) |
|
Mangle (MA) |
547 |
24 (4) |
52 (13) |
61 (11) |
|
Potrero (PO) |
134 |
18 (1) |
39 (14) |
51 (14) |
Los índices de diversidad determinaron que en gran medida los distintos hábitats no son diferentes entre sí, dado que las pruebas t no registraron diferencias significativas (p>0,05), entre los índices de dominancia Simpson estimados por hábitat. Para el índice de Shannon, solo se registró diferencia significativa (t = 2,15, p = 0,0311) en la diversidad estimada entre camaroneras (H = 3.481) y manglares (H = 3.315) (Tabla 2).
TABLA 2
Abundancia, riqueza y diversidad de comunidades de aves registradas en cuatro hábitats de una matriz de mangle intervenida.
|
Índices |
Bosque caducifolio |
Camaroneras |
Mangle |
Potrero |
|
N |
85 |
344 |
547 |
134 |
|
Riqueza (S) |
37 |
61 |
52 |
39 |
|
Simpson (D) |
0,04471 |
0,0555 |
0,05106 |
0,04622 |
|
Diversidad Simpson (1-D) |
0,9553 |
0,9445 |
0,9489 |
0,9538 |
|
Diversidad Shannon (H) |
3,351 |
3,481 |
3,315 |
3,342 |
Al evaluar la composición por categoría de área, se determinó una diferencia significativa entre todos los sitios (ANOSIM R = 1, p = 0,0098). El análisis de SIMPER, permitió identificar que dichas diferencias son producto del grado de estructuración en el uso del espacio por especies como Himantopus mexicanus, Actitis macularis, Stelgidopteryx serripennis, Stelgidopteryx wilsonia y Egretta caerulea, principalmente (anexo 1). De acuerdo con el análisis de conglomerados o clusters, los hábitats más similares en términos de su constitución fueron las camaroneras y el bosque de mangle, mientas que los paisajes de potrero se asociaron con el bosque caducifolio (Fig. 3).

Fig. 3. Similitud entre ecosistemas de acuerdo con la estructura de las comunidades de aves censadas durante el estudio. Análisis de conglomerados basado en distancias euclideanas.
DISCUSIÓN
La elevada heterogeneidad del paisaje, producto de la fragmentación del ecosistema para la producción camaronera, salinera o ganadera; impacta de forma drástica la riqueza y la estructura de la comunidad de aves de la zona (González-Martín del Campo et al., 2019). La dominancia de especies de la familia Ardeidae y Tyrannidae, típicamente caracterizadas por presentar hábitos generalistas refleja el grado de intervención en los ecosistemas. Ardeidae es una familia tradicionalmente ligada a hábitats de humedales, que puede aprovechar una variedad de hábitats, entre los cuales ha encontrado una estrecha asociación a fragmentos de vegetación emergente o humedales alterados por actividades humanas (Figuerola & Green, 2003; Choi et al., 2007). Las especies de la familia Tyrannidae pueden aprovechar espacios conservados e intervenidos. Se encuentran típicamente asociadas a hábitats abiertos y secos, lo que las hace comunes en bosques, claros o agroecosistemas fragmentados (Medina et al., 2004; Vergara et al., 2017).
Si bien los fragmentos de manglar presentaron la mayor abundancia de individuos entre todos los componentes de la matriz de ecosistemas alterados, seguido de las camaroneras, estos patrones se invierten cuando se examina la riqueza de especies. Este patrón se soporta, además, con el alto número de especies generalistas identificadas en la zona. Este resultado es contrario a lo esperado, donde los fragmentos de hábitats conservados habitualmente son los que dominan en términos de riqueza y abundancia, estudios previos demuestran que este puede ser un patrón común (González et al.,2019). Esto se debe particular a la respuesta diferencial de las especies a los procesos de pérdida y fragmentación de hábitat. La pérdida de hábitat, entendida como el área disponible, tiene un efecto directo sobre abundancia de aves pero no en la diversidad; mientras que la fragmentación del ecosistema esta correlacionada con la riqueza de aves (De Camargo et al., 2018).
Debido al contexto geográfico y a la cercanía entre estos sistemas, una hipótesis que explica este patrón en la matriz de estudio es que dichos fragmentos aún conservan en algún grado, la similitud en términos de la calidad del suelo y del agua; sin contar el recurso biótico adicional que generan las prácticas de acuicultura. Esto se puede considerar como una extensión del mangle con grandes detrimentos en sus variables edáficas, pero con un relativo aumento en la disponibilidad y acceso a recursos alimenticios (Sebastián-González & Green, 2016).
Los fragmentos conservados de bosque caducifolio presentan el menor grado de abundancia y riqueza de especies, aún por debajo de los fragmentos de potrero. Este resultado responde no solo al grado de intervención de la zona, sino también a la naturaleza misma de estos ecosistemas. Estos bosques se caracterizan por presentar valores de abundancia y diversidad discretos, relativos a ecosistemas circundantes como bosques de mangle o bosques lluviosos (Janzen, 1988); con un componente de avifauna reducido y mayoritariamente compuesta por especies en transición entre zonas áridas y húmedas (Collazos-González & Echeverry-Galvis, 2017).
Al considerar los estimadores de biodiversidad, se determina una muy baja dominancia y altos valores de diversidad por ecosistemas; y en términos generales, diferencias mínimas de dichos valores entre sitios, excepto entre camaroneras y fragmentos de manglar. Esto indica que a pesar de que existieran diferencias estructurales significativas se logró identificar a través de análisis multinomiales entre los elementos que componen la matriz de paisaje que la composición de avifauna se presenta en equilibrio dinámico. Considerando que la composición general, las especies exclusivas, y porcentajes de contribución diferencial de la abundancia de especies en cada tipo de ecosistema es diferente, se evidencian altos valores de diversidad que merecen ser considerados a la hora de diseñar estrategias de conservación. Adicionalmente, la cercanía de la matriz de ecosistemas evaluados facilita la movilidad de la avifauna y favorece la diversidad general debido a una alta heterogeneidad en cobertura vegetal existente (Gutiérrez-Pineda & Méndez-Carvajal, 2020).
El análisis de similitud entre ecosistemas asociado el componente faunístico, presenta una asociación clara entre los ecosistemas conservados y los ecosistemas derivados de sus alteraciones. A pesar de las diferencias significativas en su composición, los sistemas de camaroneras son más parecidos a los arreglos de manglar, y los potreros son más parecidos a los fragmentos de bosque caducifolio. Este hallazgo indica que el mosaico de paisajes presente en la zona rural del Níspero, presenta un alto grado de heterogeneidad que puede resultar favorable para la supervivencia de las especies de la zona (Tellería, 2013). A pesar de sus diferencias estructurales, estos fragmentos pueden funcionar como refugios o zonas de transición entre fragmentos, permitiendo a las especies dependientes de coberturas especificas utilizar los hábitats intervenidos como espacios de movilidad entre zona favorables (Vergara et al., 2017).
La conservación de la diversidad faunística en presencia de las transformaciones de los ecosistemas, producto de las actividades humanas, representa un reto para la conservación. En este estudio, se da el primer paso hacia el conocimiento de la estructura de la comunidad ornitológica presente en la matriz de fragmentos de bosque caducifolio, potreros, camaroneras y manglares que compone el paisaje de la zona rural de El Níspero de Cañas. Esta zona, a pesar de las alteraciones que presenta, cuenta con una riqueza de avifauna importante, presente en la mayoría de sus componentes ecosistémicos, a tal punto que pueden considerarse como unidades con estructuras independientes que se ven favorecidas por la heterogeneidad de los fragmentos cercanos. Estos resultados refuerzan la necesidad de comprender los procesos ecológicos que se dan en ecosistemas alterados, con el fin de entender el comportamiento de las especies que aprovechan dichos recursos.
Se recomienda una segunda etapa de estudios, dirigida a la evaluación de la avifauna a través de parámetros específicos, que permitan comprender la historia natural de las aves que allí se encuentran, las dinámicas temporales de la composición y el estado de vulnerabilidad de las comunidades de aves presentes. Se sugiere que estos procesos integren a los pobladores de las comunidades humanas aledañas, favoreciendo la integración entre la academia y la ciudadanía que permita un empoderamiento en los procesos de conservación y aprovechamiento sustentable de los recursos biológicos.
AGRADECIMIENTOS
Los autores agradecen a la Escuela de Ciencias Biológicas (ECB) y la Vicerrectoría de Investigación (VI) de la Universidad Latina de Costa rica, por el apoyo en la realización del proyecto. Esta investigación se realizó como parte del Proyecto de Pesca Responsable, financiada por ECB y VI. Los autores agradecen a la Estación Biológica Cipancí, SINAC por el apoyo brindado y a la comunidad del Níspero de Nicoya, por facilitar el acceso a los sitios de observación de aves. Se agradece también a Héctor Perdomo Velázquez por la revisión del artículo.
ÉTICA, CONFLICTO DE INTERESES Y DECLARACIÓN DE FINANCIAMIENTO
Declaramos haber cumplido con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en la preparación de este documento; que no hay conflictos de interés de ningún tipo, y que todas las fuentes financieras se detallan plena y claramente en la sección de agradecimientos. Asimismo, estamos de acuerdo con la versión editada final de esta publicación. El respectivo documento legal firmado se encuentra en los archivos de la revista.
La declaración de contribución de cada autor es la siguiente: E.A.H.: Conceptualización, metodología, investigación, administración del proyecto, escritura, preparación del manuscrito, redacción, revisión y edición final. S.B.: Metodología, análisis estadístico formal, escritura, preparación del borrador original, redacción, revisión y edición final. H.C.M.: Investigación, metodología, escritura, preparación del borrador original, redacción, revisión y edición final. V.C.G.: Investigación, metodología, escritura, preparación del borrador original, redacción, revisión y edición final. D.P.Z.: Investigación, metodología, escritura, preparación del borrador original, redacción, revisión y edición final. S.S.C.: Investigación, metodología, análisis estadístico formal, escritura, preparación del borrador original, redacción, revisión y edición final. Todos los coautores.: preparación y aprobación final del manuscrito.
REFERENCIAS
Algeet-Abarquero, N., Sánchez-Azofeifa, A., Bonatti, J., & Marchamalo, M. (2015). Land cover dynamics in Osa Region, Costa Rica: secondary forest is here to stay. Regional Environmental Change, 15, 1461-1472. https://doi.org/10.1007/s10113-014-0714-9
Andrén, H. (1994). Effects of Habitat Fragmentation on Birds and Mammals in Landscapes with Different Proportions of Suitable Habitat: A Review. Oikos, 71(3), 355-366. https://doi.org/10.2307/3545823
Calvo-Alvarado, J., McLennan, B., Sánchez-Azofeifa, A., & Garvin, T. (2009). Deforestation and forest restoration in Guanacaste, Costa Rica: Putting conservation policies in context. Forest Ecology and Management, 258(6), 931-940. https://doi.org/10.1016/j.foreco.2008.10.035
De Camargo, R. X., Boucher-Lalonde, V., & Currie, D. J. (2018). At the landscape level, birds respond strongly to habitat amount but weakly to fragmentation. Diversity and Distributions 24(5), 629-639. https://doi.org/10.1111/ddi.12706
Cárdenas, G., Harvey, C.A., Ibrahim, M., & Finegan, B. (2003). Diversidad y riqueza de aves en diferentes hábitats en un paisaje fragmentado en Cañas, Costa Rica. Agroforestería en las Americas, 10, 39-40. https://repositorio.catie.ac.cr/handle/11554/6080
Chaves-Fonnegra, A., Fiorenzano, M., Pantaleón-Lizarazú, A. M., Rodríguez-Gacha, D. F., Franco-Herrera, A., & López-Victoria, M. (2005). Aves De Un Manglar En El Pnn Tayrona, Caribe Colombiano. Boletín Sociedad Antioqueña de Ornitología - SAO, 15(1), 3-12. http://hdl.handle.net/20.500.12010/13503
Choi, Y.-S., Kwon, I.-K., & Yoo, J.-C. (2007). Foraging Habitat Preferences of Herons and Egrets. Journal of Ecology and Environment, 30(3), 237-244. https://doi.org/10.5141/JEFB.2007.30.3.237
Cifuentes-Jara, M., Brenes, C., Manrow, M., & Torres, D. (2014). Dinámica de uso de la tierra y potencial de mitigación de los manglares del Golfo de Nicoya. Conservación Internacional, CATIE.
Collazos-González, S. A., & Echeverry-Galvis, M. Á. (2017). Comunidad de aves del bosque seco tropical en la mesa de Xéridas, Santander, Colombia. Ornitologia Neotropical, 28, 223-235. https://bit.ly/3AdDagT
Cuevas, M., Garrido, A., Pérez, J., & Iura, D. (2010). Procesos de cambio de uso de suelo y degradación de la vegetación natural. In H. Cotler (Ed.), Las Cuencas Hidrográficas De México: Diagnóstico y priorización (pp 96-103). Pluralia Ediciones e Impresiones S. A.
Fakheran, S., Paul-Victor, C., Heichinger, C., Schmid, B., Grossniklaus, U., & Turnbull, L. A. (2010). Adaptation and extinction in experimentally fragmented landscapes. Proc Natl Acad Sci U S A, 107(44), 19120-19125. https://doi.org/10.1073/pnas.1010846107
Food and Agriculture Organization (FAO). (2016). El Estado de los bosques del mundo 2016. Los bosques y la agricultura: desafíos y oportunidades en relación con el uso de la tierra. FAO. https://www.fao.org/3/i5588s/i5588s.pdf
Figuerola, J., & Green, A. (2003). Aves acuáticas como bioindicadores en los humedales. In M. Paracuellos (Ed.), Ecología, manejo y conservación de los humedales (pp. 47-60). Instituto de Estudios Almerienses.
Garrigues, R., Camacho-Varela, P., Montoya, M., O’Donnell, P., Ramírez-Alán, O., & Zook, J. (2021). Lista Oficial de las Aves de Costa Rica – Actualización 2021. Comité de Especies Raras y Registros Ornitológicos de Costa Rica (Comité Científico), Asociación Ornitológica de Costa Rica. https://bit.ly/3AeON7i
Garrigues, R., & Dean, R. (2014). Birds of Costa Rica: a field guide. Cornell University Press.
González-Martín del Campo, F., Navarrete-Gutiérrez, D. A., Enríquez, P. L., & Gordillo-Pérez, G. (2019). Diversidad de aves en sitios con distinto uso de suelo en Nuevo Conhuas, Calakmul, México. Acta Zoológica Mexicana (N.S.) 35, 1-18. https://doi.org/10.21829/azm.2019.3501233
González, A., Acosta Cruz, M., Mugica Valdés, L., & García-Lau, I. (2016). Variación temporal del ensamble de aves acuáticas de Las Salinas (Ciénaga de Zapata, Cuba) durante el periodo 2012-2013. Revista Cubana de Ciencias Biológicas, 5(1), 71-81.
Gutiérrez-Pineda, K. M., & Méndez-Carvajal, P. G. (2020). Diversidad ecológica de aves en un hábitat fragmentado en la comunidad de Rincón Largo, Chiriquí, Panamá. Huitzil Revista Mexicana de Ornitología, 22(1), e-610. https://doi.org/10.28947/hrmo.2021.22.1.492
Haddad, N. M., Brudvig, L. A., Clobert, J., Davies, K. F., Gonzalez, A., Holt, R. D., Lovejoy, T. E. Sexton, J. O., Austin, M. P., Collins, C. D., Cook, W. M., Damschen, E. I., Ewers, R. M., Foster, B. L., Jenkins, C. N., King, A. J., Laurance, W. F., Levey, D. J., Margules, C. R., … Townshend, J. R. (2015). Habitat fragmentation and its lasting impact on Earth’s ecosystems. Science Advances 1: e1500052. https://doi.org/10.1126/sciadv.1500052
Hammer, Ø., Harper, D. A. T., & Ryan, P. D. (2001). PAST: Paleontological statistics software package for education and data analysis. Palaeontologia electronica, 4(1) 1-9.
Jadin, I., Meyfroidt, P., & Lambin, E. F. (2016). International trade, and land use intensification and spatial reorganization explain Costa Rica’s forest transition. Environmental Research Letters, 11(3), 049502. https://doi.org/10.1088/1748-9326/11/4/049502
Janzen, D. (1988). Tropical dry forests: The most endangered major tropical ecosystem. In O. Wilson (Ed.), Biodiversity, pp. 130-137. National Academy Press.
Medina, A., Harvey, C., Sánchez, D., Vílchez, S., & Hernández, B. (2004). Diversidad de aves en un paisaje fragmentado de bosque seco en Rivas, Nicaragua. Encuentro, 68, 60-75. https://doi.org/10.5377/encuentro.v0i68.4257
Otavo, S., & Echeverría, C. (2017). Fragmentación progresiva y pérdida de hábitat de bosques naturales en uno de los hotspot mundiales de biodiversidad. Revista Mexicana de Biodiversidad, 88(4), 924-935. https://doi.org/10.1016/j.rmb.2017.10.041
Pacheco-Vargas, G., Sánchez-Guzmán, J., & Losada-Prado, S. (2018). Caracterización de la comunidad de aves asociada a los humedales de zonas bajas del departamento del Tolima, Colombia. Biota Colombiana, 19(1), 190-201. https://doi.org/10.21068/c2018.v19n01a12
QGIS Development Team (2020). QGIS Geographic Information System. http://www.qgis.org
Ralph, C. J., Geupel, G. R., Pyle, P., Martin, T. E., DeSante, D. F., & Milá, B. (1997). Manual de métodos de campo para el monitoreo de aves terrestres (Gen. Tech. Rep. PSW-GTR-159-Web). US Department of Agriculture, Forest Service.
Sánchez-Bayo, F., & Wyckhuys, K. A. G. (2019). Worldwide decline of the entomofauna: A review of its drivers. Biological Conservation, 232, 8-27. https://doi.org/10.1016/j.biocon.2019.01.020
Sebastián-González, E., & Green, A. J. (2016). Reduction of avian diversity in created versus natural and restored wetlands. Ecography, 39(12)., 1176-1184. https://doi.org/10.1111/ecog.01736
Tellería, J. L. (2006). Pérdida y fragmentación del hábitat : efecto sobre la conservación de las especies. Ecosistemas, 15(2), 3-12. https://www.revistaecosistemas.net/index.php/ecosistemas/article/view/180
Tellería, J. L. (2013). Pérdida de biodiversidad: Causas y consecuencias de la desaparición de las especies. Bol. R. Soc. Esp. Hist. Nat., 10, 13-25. http://www.rsehn.es/index.php?d=publicaciones&num=30&w=189
Vergara, J. A., Ballesteros, J., González, C., & Linares, J. C. (2017). Diversidad de aves en fragmentos de bosque seco tropical en paisajes ganaderos del Departamento de Córdoba, Colombia. Revista de Biología Tropical, 65(4), 1625-1634. http://dx.doi.org/10.15517/rbt.v65i4.26313
Villegas-Arguedas, J. C. (2019). Diversidad de aves en la zona costera de Bahía Ballena y Puerto Cortés, Costa Rica. Cuadernos de Investigación UNED, 11(2), 145-153. http://dx.doi.org/10.22458/urj.v11i2.2302
Wilson, M. C., Chen, X.-Y., Corlett, R. T., Didham, R. K., Ding, P., Holt, R. D., Holyoak, M., Hu, G., Hughes, A. C., Jiang, L., Laurance, W. F., Liu, J., Pimm, S. L., Robinson, S. K., Russo, S. E., Si, X., Wilcove, D. S., Wu, J., & Yu, M. (2016). Habitat fragmentation and biodiversity conservation: key findings and future challenges. Landscape Ecology, 31, 219-227. https://doi.org/10.1007/s10980-015-0312-3
World Wild Fund for Nature (WWF) (2018). Living Planet Report 2018: Aiming higher. Grooten, M., Almond, R. E. A. (Eds.). WWF.
Zamora-Trejos, P., & Cortés, J. (2009). Los manglares de Costa Rica: El Pacífico norte. Revista de Biologia Tropical, 57(3), 473-488. https://www.scielo.sa.cr/scielo.php?script=sci_arttext&pid=S0034-77442009000300003
APÉNDICE
TABLA 1
Especies registradas en los cuatro hábitats de la matriz ecosistémica. Bosque caducifolio (BC), potrero (PT), camaroneras (CM) y manglar (MG)
|
Familia |
Especie |
Nombre Común |
BC |
PT |
CM |
MG |
Total |
|
Accipitridae |
Buteogallus anthracinus |
Gavilán caracolero |
1 |
- |
1 |
4 |
6 |
|
Buteo plagiatus |
Gavilán gris |
- |
1 |
- |
1 |
2 |
|
|
Buteo platypterus |
Gavilán aludo |
- |
- |
- |
1 |
1 |
|
|
Alcedinidae |
Megaceryle torquata |
Martín pescador |
- |
- |
- |
1 |
1 |
|
Aramidae |
Aramus guarauna |
Carao |
- |
- |
- |
2 |
2 |
|
Burhinus bistriatus |
Alcaraván americano |
- |
- |
2 |
- |
2 |
|
|
Ardea alba |
Garceta grande |
1 |
- |
- |
2 |
3 |
|
|
Butorides virescens |
Garza verde |
- |
- |
2 |
2 |
4 |
|
|
Bubulcus ibis |
Garcilla bueyera |
- |
1 |
- |
- |
1 |
|
|
Tigrisoma mexicanum |
Graza tigre |
- |
- |
3 |
8 |
11 |
|
|
Ardea herodias |
Garzón azulado |
- |
- |
- |
12 |
12 |
|
|
Egretta tricolor |
Garceta tricolor |
- |
- |
1 |
5 |
6 |
|
|
Egretta caerulea |
Graceta azul |
2 |
- |
6 |
37 |
45 |
|
|
Egretta thula |
Garceta nivosa |
- |
- |
4 |
23 |
27 |
|
|
Egretta rufescens |
Garceta rojiza |
- |
- |
2 |
1 |
3 |
|
|
Cochlearius cochlearius |
Chocuaco |
- |
- |
1 |
4 |
5 |
|
|
Nyctanassa violacea |
Martineta cabecipinto |
4 |
- |
2 |
36 |
42 |
|
|
Cardinalidae |
Passerina cyanea |
Azulillo Norteño |
1 |
- |
- |
- |
1 |
|
Passerina caaerulea |
Picogrueso azul |
- |
- |
2 |
- |
2 |
|
|
Caprimulgidae |
Nyctidromus albicollis |
Cuyeo |
- |
- |
8 |
- |
8 |
|
Cathartidae |
Coragyps atratus |
Zopilote cabeza negra |
6 |
8 |
2 |
22 |
38 |
|
Cathartes aura |
Zopilote cabeza roja |
2 |
2 |
9 |
8 |
21 |
|
|
Ciconidae |
Mycteria americana |
Cigüeñón |
- |
- |
- |
1 |
1 |
|
Columbidae |
Leptotila verreauxi |
paloma |
7 |
3 |
6 |
- |
16 |
|
Columbina inca |
Tortolita cola larga |
2 |
16 |
3 |
- |
21 |
|
|
Columbina passerina |
Tortolita común |
- |
2 |
- |
- |
2 |
|
|
Patagioenas flavirostris |
Paloma piquirroja |
- |
- |
2 |
- |
2 |
|
|
Zenaida asiatica |
Paloma aliblanca |
4 |
- |
8 |
- |
12 |
|
|
Columbina talpacoti |
Tortolita rojiza |
1 |
- |
- |
- |
1 |
|
|
Columbina minuta |
Columbina menuda |
- |
4 |
18 |
- |
22 |
|
|
Cuculidae |
Crotophaga sulcirostris |
Tijul |
- |
4 |
17 |
7 |
28 |
|
Piaya cayana |
Cuco ardilla |
- |
2 |
- |
- |
2 |
|
|
Coccyzus minor |
Cuclillo de manglar |
- |
1 |
- |
- |
1 |
|
|
Emberizidae |
Peucaea ruficauda |
Zacatonero Corona Rayada |
- |
3 |
- |
- |
3 |
|
Falconidae |
Milvago chimachima |
Caracara chimachima |
- |
2 |
- |
- |
2 |
|
Caracara cheriway |
Caracara cargahuesos |
- |
3 |
1 |
- |
4 |
|
|
Fregatidae |
Fregata magnificens |
Fregata |
3 |
- |
2 |
14 |
19 |
|
Fringillidae |
Euphonia hirundinacea |
Eufonia Garganta Amarilla |
1 |
- |
2 |
- |
3 |
|
Euphonia affinis |
Eufonia garganta negra |
- |
- |
12 |
- |
12 |
|
|
Hirundinidae |
Stelgidopteryx serripennis |
Golondrina aserrada |
- |
- |
35 |
7 |
42 |
|
Tachycineta albilinea |
Golondrina de manglar |
- |
- |
5 |
9 |
14 |
|
|
Icteridae |
Quiscalus mexicanus |
Zanate |
- |
9 |
- |
10 |
19 |
|
Icterus pustulatus |
Chorcha |
2 |
1 |
- |
1 |
4 |
|
|
Icterus pectoralis |
Turpial de pecho manchado |
2 |
- |
- |
1 |
3 |
|
|
Icterus galbula |
Turpial de Baltimore |
- |
- |
5 |
- |
5 |
|
|
Icterus sp |
Oriole |
1 |
- |
- |
1 |
2 |
|
|
Dives dives |
Tordo cantor |
- |
- |
3 |
- |
3 |
|
|
Momotidae |
Eumomota superciliosa |
Pájaro bobo (momoto cejiazul) |
- |
1 |
5 |
- |
6 |
|
Pandionidae |
Pandion haliaetus |
Aguila pescadora |
3 |
- |
3 |
18 |
24 |
|
Parulidae |
Setophaga petechia |
Reinita amarilla |
1 |
4 |
8 |
6 |
19 |
|
Setophaga ruticilla |
Candelita norteña |
1 |
- |
3 |
- |
4 |
|
|
Protonotaria citrea |
Reinita Cabecidorada |
3 |
- |
- |
- |
3 |
|
|
Geothlypis philadelphia |
Reinita de Tupidero |
1 |
- |
- |
- |
1 |
|
|
Parkesia novebaracensis |
Reinita acuática piquigrande |
1 |
1 |
3 |
1 |
6 |
|
|
Oreothlypis peregrina |
Reinita verdilla o chipe peregrino |
- |
- |
4 |
- |
4 |
|
|
Pelecanidae |
Pelecanus occidentalis |
Pelicanos |
2 |
- |
- |
11 |
13 |
|
Phalacrocoracidae |
Phalacrocorax brasilianus |
Pato chancho |
- |
- |
- |
1 |
1 |
|
Picidae |
Melanerpes hoffmanii |
Carpintero |
1 |
8 |
1 |
3 |
13 |
|
Polioptilidae |
Polioptila albiloris |
Perlita cabecinegra |
1 |
4 |
- |
- |
5 |
|
Polioptilidae |
Polioptila plumbea |
Perlita tropical |
- |
2 |
- |
- |
2 |
|
Psittacidae |
Brotogeris jugularis |
Perico común |
- |
- |
6 |
5 |
11 |
|
Amazona albifrons |
Cotorra |
- |
2 |
12 |
7 |
21 |
|
|
Amazona auropalliata |
Lora nuca amarilla |
- |
- |
8 |
4 |
12 |
|
|
Aratinga canicularis |
Catano |
- |
7 |
- |
- |
7 |
|
|
Scolopacidae |
Limnodromus scolopaceus |
Costurero Pico Largo |
- |
- |
- |
20 |
20 |
|
Numenius phaeopus |
Numenius phaeopus |
1 |
- |
2 |
27 |
30 |
|
|
Tringa melanoleuca |
Patamarilla Mayor |
- |
- |
- |
5 |
5 |
|
|
Tringa semipalmata |
Tigüiza, andarríos solitario |
1 |
- |
1 |
35 |
37 |
|
|
Bartramia longicauda |
Correlimos batitú |
- |
- |
- |
2 |
2 |
|
|
Calidris minutilla |
Correlimos menudo |
- |
- |
3 |
- |
3 |
|
|
Actitis macularis |
Tringa macularia |
3 |
- |
13 |
66 |
82 |
|
|
Calidris pusilla |
Correlimos semipalmado |
- |
- |
1 |
- |
1 |
|
|
Strigidae |
Glaucidium brasilianum |
Mochuelo común |
- |
- |
3 |
- |
3 |
|
Ciccaba virgata |
Lechuza café |
- |
- |
1 |
- |
1 |
|
|
Ciccaba nigolineata |
Lechuza blanco y negro |
- |
- |
1 |
- |
1 |
|
|
Thraupidae |
Sporophila torqueola |
Espiguero collajero |
- |
- |
1 |
- |
1 |
|
Threskiornithidae |
Eudocimus albus |
Ibis blanco |
1 |
- |
7 |
23 |
31 |
|
Platalea ajaja |
Espatula rosada |
- |
- |
- |
3 |
3 |
|
|
Tityridae |
Tityra inquisitor |
Titira corininegra |
- |
- |
2 |
2 |
4 |
|
Pachyramphus aglaiae |
Cabezón plomizo |
- |
1 |
- |
- |
1 |
|
|
Trochilidae |
Amazilia rutila |
Amazilia canela |
1 |
1 |
- |
- |
2 |
|
Amazilia tzacatl |
Amazilia rabirrufa |
- |
1 |
- |
1 |
2 |
|
|
Amazilia boucardi |
Colibrí de mangle |
- |
- |
- |
1 |
1 |
|
|
Amazilia sauncerrottei |
Amazilia verdiazul |
- |
6 |
- |
- |
6 |
|
|
Chlorostilbon canivetii |
Colibrí esmeralda |
- |
3 |
3 |
- |
6 |
|
|
Anthracothorax prevostii |
Colibrí Garganta Negra |
- |
- |
1 |
- |
1 |
|
|
Heliomaster constantii |
Colibrí pochotero |
- |
1 |
- |
- |
1 |
|
|
Archilochus colubris |
Colibrí garganta Rubí |
- |
1 |
3 |
- |
4 |
|
|
Troglodytidae |
Campylorhynchus rufinucha |
Chico piojo |
- |
- |
1 |
- |
1 |
|
Trogonidae |
Trogon melanocephalus |
Trogon |
1 |
4 |
1 |
- |
6 |
|
Tyrannidae |
Pitangus sulfuratus |
Pecho amarillo |
5 |
7 |
7 |
7 |
26 |
|
Tyrannus melancholicus |
Pecho amarillo |
3 |
7 |
9 |
5 |
24 |
|
|
Tyrannus verticalis |
Tirano occidental |
- |
2 |
- |
- |
2 |
|
|
Tyrannus furficatus |
Tijereta rosada |
- |
- |
2 |
- |
2 |
|
|
Myiarchus tuberculifer |
copetón capirotado |
- |
3 |
1 |
- |
4 |
|
|
Myiarchus nuttingi |
Copetón de Nutting |
2 |
4 |
1 |
- |
7 |
|
|
Myozetetes similis |
Mosquero cejiblanco |
- |
- |
5 |
- |
5 |
|
|
Turdidae |
Turdus grayi |
Yigüirro |
- |
1 |
- |
- |
1 |
|
Jacanidae |
Jacana espinosa |
Jacana |
- |
- |
- |
1 |
1 |
|
Charadriidae |
Charadrius wilsonia |
Chorlitejo picudo |
1 |
- |
- |
47 |
48 |
|
Laridae |
Thalasseus maximus |
Gaviota |
9 |
- |
- |
25 |
34 |
|
Leucophaeus atricilla |
Gaviota reidora americana |
3 |
- |
- |
- |
3 |
|
|
Vireonidae |
Vireo philadelphicus |
Vireo |
- |
- |
- |
1 |
1 |
|
Vireo flavifrons |
Vireo pechiamarillo |
- |
1 |
- |
- |
1 |
|
|
Recurvirostridae |
Himantopus mexicanus |
Cigüeñuela cuellinegra |
- |
- |
58 |
- |
58 |