
UNED Research Journal (e-ISSN 1659-441X), Vol. 14(supl.1): e3880, June, 2022
Prevalencia del hongo quitridio en la “especie abanderada” Atelopus varius (Anura, Bufonidae), Zona Protectora las Tablas, Costa Rica
Rocío Seisdedos-de-Vergara1![]() , Diego A. Gómez Hoyos1
, Diego A. Gómez Hoyos1![]() , Gilbert Alvarado2
, Gilbert Alvarado2![]() , Juan G. Abarca3
, Juan G. Abarca3![]() , Josimar Estrella2
, Josimar Estrella2![]() , Jan Schipper1, 4
, Jan Schipper1, 4![]() , & José F. González-Maya1
, & José F. González-Maya1![]()
1. ProCAT Internacional / Sierra to Sea Institute Costa Rica, Finca Las Alturas del Bosque Verde, Coto Brus, Costa Rica. rseisdedosdev@gmail.com, biodiego88@gmail.com, jfgonzalezmaya@gmail.com, jschipper@phoenixzoo.org
2. Universidad de Costa Rica, Escuela de Biología, Laboratorio de Patología Experimental y Comparada. San José, Costa Rica. gilbert.alvarado@ucr.ac.cr, josimar_estrella@hotmail.com
3. Universidad Nacional, Laboratorio de Recursos Naturales y Vida Silvestre, Heredia, Costa Rica. barcazajuan@gmail.com
4. Arizona Center for Nature Conservation, Phoenix Zoo. Phoenix, Arizona, Estados Unidos. Jschipper@phoenixzoo.org
Recibido 15-X-2021 Corregido 21-X-2021 Aceptado 25-X-2021
DOI: https://doi.org/10.22458/urj.v14iS1.3880
|
ABSTRACT. “Prevalence of pathogenic chytrid fungus on a flagship species, Atelopus varius (Anura, Bufonidae), Las Tablas Protection Zone, Costa Rica”. Introduction: The harlequin toad, Atelopus varius, is critically endangered and was declared “apparently extinct” in Costa Rica in 1996. One of the possible causes was the pathogenic fungus Batrachochytrium dendrobatidis. A live population was rediscovered in Las Tablas in 2008 and here we analyze the situation with this fungus. Objective: To evaluate prevalence and probability of infection of the toad by B. dendrobatidis. Methods: We collected swabs skin samples from live individuals (for DNA tests) and histological pieces from dead individuals (for direct microscopic observation). Results: From 363, only 6% had the fungus, particularly subadults. Conclusion: The toad population seems to be stable but care must be taken not to spread the fungus.
Keywords: Amphibians, chytridiomycosis, endangered species, harlequin toad, monitoring, PILA.
|
RESUMEN. Introducción: El sapo arlequín, Atelopus varius, se encuentra en peligro crítico y fue declarada “aparentemente extinta” en Costa Rica en 1996. Una de las posibles causas fue el hongo patógeno Batrachochytrium dendrobatidis. En 2008 se redescubrió una población viva en Las Tablas y aquí analizamos la situación con este hongo. Objetivo: Evaluar prevalencia y probabilidad de infección del sapo por B. dendrobatidis. Métodos: Se recolectaron hisopados de piel de individuos vivos (para pruebas de ADN) y trozos histológicos de individuos muertos (para observación microscópica directa). Resultados: De 363 animales, solo el 6% tenía el hongo, particularmente los subadultos. Conclusión: La población de sapos parece estable, pero se debe tener cuidado de no propagar el hongo, aunque este sea actualmente escaso.
Palabras clave: Anfibios, especies amenazadas, monitoreo, PILA, quitridiomicosis, sapo arlequín.
|
El sapo arlequín, Atelopus varius, es una especie críticamente amenazada. Endémica de Costa Rica y Panamá, fue considerada como posiblemente extinta en Costa Rica en 1996 tras un declive drástico (IUCN, 2020). Entre sus amenazas y causa de su aparente desaparición está el hongo Batrachochytrium dendrobatidis. En 2008 fue redescubierta en la Zona Protectora las Tablas una población de A. varius, la cual ha servido como oportunidad de investigación y conservación (González-Maya et al., 2013).
La quitridiomicosis es una enfermedad causada por el hongo quitridio, el cual es considerado como una posible causante del gran declive de anfibios en el neotrópico (Lips et al., 2003; La Marca et al., 2005; Lips et al., 2006; Whitfield et al., 2016). Este hongo afecta a los anfibios colonizando las superficies queratinizadas de la piel y cuando la enfermedad se extiende puede causar la muerte a los animales infectados (Vásquez-Ochoa et al., 2012). El Batrachochytrium dendrobatidis es un patógeno que se ha detectado en un número considerable de especies de anfibios, sin embargo, se ha demostrado que afecta en mayor proporción a las especies asociadas a cuerpos de agua, ya que es el agua y las zonas húmedas o encharcadas las que favorecen la propagación de las esporas del patógeno (Berger et al., 2005).
La Zona Protectora las Tablas fue uno de los lugares donde se documentaron declives de anfibios asociados a quitridiomicosis en Costa Rica en la década de 1990. El efecto reciente de este patógeno sobre poblaciones de anfibios amenazados como A. varius, no ha sido evaluado. Por esta razón, el objetivo principal de este trabajo fue evaluar la prevalencia y probabilidad de infección del hongo quitridio en la población de A. varius de la Zona Protectora las Tablas, y así proponer una estrategia de conservación.
MATERIALES Y MÉTODOS
El presente estudio se llevó a cabo en la Zona Protectora las Tablas, provincia de Puntarenas, al sureste de Costa Rica, la cual forma parte de la zona de amortiguamiento del Parque Internacional La Amistad (PILA) (González-Maya & Mata-Lorenzen, 2008). La población de A. varius estudiada se encuentra restringida a un tramo del río Cotón, en un área privada que cuenta con aproximadamente 11 600 ha entre los 1 000 y los 2 100msnm dedicadas a la conservación. La precipitación media anual es de 3 500mm y la temperatura media es de 19°C (González-Maya & Mata-Lorenzen, 2008).
El muestreo se llevó a cabo a lo largo de 1,1km del río Cotón entre 2018 y 2019. Se buscaron individuos desde la orilla hasta aproximadamente 6 metros hacia el bosque. Se registraron los datos de todos los individuos encontrados y se tomaron muestras cutáneas con hisopos estériles (Kriger et al., 2006). Los individuos encontrados muertos fueron recolectados y analizados en el laboratorio por presencia de esporangios de Batrachochytrium dendrobatidis, mediante el corte de una sección de tejido de los dedos y observación microscópica, igualmente para los individuos encontrados muertos se tomaron muestras con hisopos estériles para realizar el análisis PCR (Polymerase Chain Reaction) (Boyle et al., 2004; Hyatt et al., 2007). Los datos se analizaron con estadística descriptiva y modelos lineales generalizados de la familia binomial para estimar las probabilidades de infección de acuerdo a las características de los individuos (tamaño y masa). El modelo con mejor ajuste se seleccionó con el Criterio de Información a Akaike corregido para muestras pequeñas (AICc en inglés). Los análisis se realizaron en el lenguaje R (R Core Team, 2020), la selección de modelos se hizo con el paquete AICcmodavg (Mazerolle, 2020) y las gráficas con el paquete ggplot2 (Wickham, 2016).
RESULTADOS
Se colectaron y analizaron 363 muestras, de las cuales 22 resultaron positivas para Batrachochytrium dendrobatidis. Con esto se puede estimar una prevalencia del 6,06 % para la población. Para juveniles (individuos menores a 27mm de LRC, N=188) la prevalencia estimada es de 4,79% y para adultos (LRC mayor a 27mm, N=175) es de 7,43%. Los cuatro individuos encontrados muertos fueron positivos para Batrachochytrium dendrobatidis, todos presentaban la piel descamada, aunque no se puede confirmar que la infección fuese la causa de la muerte.
Los individuos que resultaron positivos para Batrachochytrium dendrobatidis se encuentran principalmente entre los 27mm y los 29mm de LRC (subadultos y machos o hembras jóvenes), mientras que los individuos negativos representan bien la estructura de la población, desde individuos juveniles hasta adultos (Fig. 1). Esta tendencia también está soportada con los modelos, donde los modelos con mejor ajuste muestran que la probabilidad de infección depende de la relación masa/LRC y con menor certidumbre a la edad (Tabla 1), pues tiende a en individuos juveniles con una relación masa/LRC cercana a 0,07g/mm, es decir en individuos subadultos (Fig. 2).
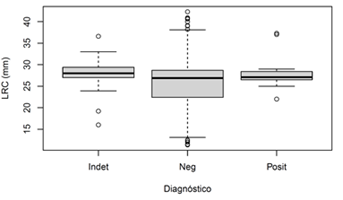
Fig. 1. Distribución de los valores de longitud rostro-cloacal (LRC) (mm) en individuos de Atelopus varius positivos para Batrachochytrium dendrobatidis , negativos e indeterminados (el análisis de ADN no resultó correctamente).
TABLA 1
Selección de modelos lineales generalizados de la familia binomial para explicar la probabilidad de infección de Atelopus varius con el hongo quitridio Batrachochytrium dendrobatidis. en una población de la Zona Protectora Las Tablas, Costa Rica
|
Modelo |
K |
AICc |
Delta AICc |
Peso AICc |
Peso acumulado |
|
Infección ~ masa/LRC |
2 |
137,8579 |
0,0000 |
0,6950 |
0,6950 |
|
Infección ~ masa/LRC + edad |
3 |
139,5074 |
1,6495 |
0,3047 |
0,9997 |
|
Infección ~ 1 |
1 |
154,1551 |
16,2972 |
0,0002 |
0,9999 |
|
Infección ~ edad |
2 |
155,4277 |
17,5698 |
0,0001 |
1 |
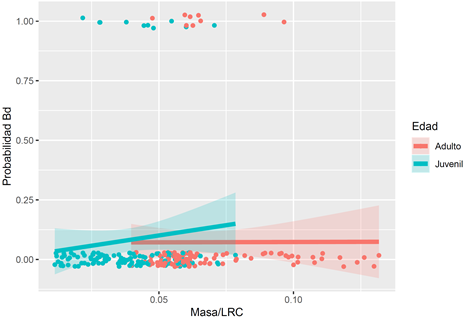
Fig. 2. Probabilidad de infección por Batrachochytrium dendrobatidis en individuos de Atelopus varius según su relación masa-longitud rostro cloacal (LRC) (g/mm) y edad, de una población de la Zona Protectora Las Tablas, Costa Rica.
DISCUSIÓN
La prevalencia estimada para esta población en el presente estudio es baja (˂10%, según Whitfield et al., 2017) y en apariencia no está causando declives en la población, es decir, puede ser enzoótica y no alcanzar una carga de infección lo suficientemente alta como para seguir causando una mortalidad alta, como exponen Zumbado-Ulate et al. (2019). Según un estudio elaborado por Briggs et al. (2010), es posible que haya poblaciones que tras un declive a causa de la llegada del Batrachochytrium dendrobatidis, resistan sin un impacto grave en la probabilidad de supervivencia, al igual que en la población de A. cruciger estudiada por Lampo et al. (2012). Entre 2012 y 2013 González-Maya et al. estimaron una prevalencia del 13,33% (N=15) para esta misma población (González-Maya et al., 2018) y en 2016 se estimó una prevalencia de 13,43% (N=67) (Seisdedos-de-Vergara, 2017). Las diferencias con la prevalencia del estudio actual pueden ser por dos posibles razones, la primera es que realmente refleja la dinámica epidemiológica del hongo y la prevalencia bajó o es un efecto del tamaño de muestra que al aumentar podría estar reduciendo el sesgo de sobreestimación de la prevalencia.
La prevalencia de los adultos es mayor a la de los juveniles, sin embargo, la probabilidad de infección parece tender a ser mayor en los subadultos con relación masa/LRC similar a algunos adultos. Esto podría sugerir que el Batrachochytrium dendrobatidis no causa una mortalidad alta en los adultos infectados. Por otro lado, los juveniles, pese a tener una prevalencia menor en general, tiende a una relación positiva con la relación masa/LRC, por lo que parece que el grupo de edad más afectado por Batrachochytrium dendrobatidis en esta población serían los subadultos o juveniles de mayor tamaño, causando un reclutamiento bajo de adultos, como se presentó en la evaluación poblacional llevada a cabo en 2016 (Seisdedos-de-Vergara, 2017).
El monitoreo poblacional que se lleva a cabo en este sitio refleja que la población de A. varius es estable (Seisdedos-de-Vergara, 2017), sin embargo, es necesario mantener una vigilancia debido a su vulnerabilidad e importancia para la conservación, así como llevar a cabo estudios que relacionen la interacción de la especie con el patógeno y con las variables ambientales (Whitfield et al.,2017). El descubrimiento de más poblaciones de A. varius en Costa Rica en los últimos años (Solano-Cascante et al., 2014; Barrio-Amorós & Abarca, 2016; Jiménez-Monge et al., 2019) es una señal alentadora de que la especie puede estar persistiendo a pesar de las amenazas. Sin embargo, se trata de una especie críticamente amenazada y la viabilidad a largo plazo de sus poblaciones debe ser una prioridad de estudio y conservación, junto con el estudio de amenazas.
Debido a la confirmación de la presencia del hongo en la Zona Protectora las Tablas se implementó un protocolo de bioseguridad en el área de estudio, dentro de la propiedad privada, para evitar la posible entrada y recombinación de otras cepas del hongo que puedan afectar negativamente a la población. Ante incertidumbre de causa de mortalidad se recomienda implementar un protocolo de bioseguridad en aquellas localidades con anfibios vulnerables o en peligro, especialmente en Áreas Silvestres Protegidas, como ha sido implementado para la población de A. varius.
AGRADECIMIENTOS
Agradecemos a Rufford Foundation, Mikelberg Family Foundation y Phoenix Zoo por el financiamiento que hizo posible esta investigación. Este estudio se llevó a cabo bajo los permisos R-014-2018-OT-CONAGEBIO, Pry01-522-2016 y SINAC-ACLAP-GMRN-INV-105-2016
ÉTICA, CONFLICTO DE INTERESES Y DECLARACIÓN DE FINANCIAMIENTO
La declaración de contribución es la siguiente: R.S.V. y D.A.G.H.: diseño de estudio y recolección de datos. D.A.G.H.: análisis estadístico de datos. R.S.V: elaboración del manuscrito. G.A, J.G.A. y J.E.: colaboración análisis y logística de laboratorio. R.S.V., D.A.G.H., G.A., J.G.A., J.E., J.S. y J.F.G.M: preparación y aprobación final del manuscrito.
REFERENCIAS
Barrio-Amorós, C. L., & Abarca, J. (2016). Another surviving population of the critically endangered Atelopus varius (Anura: Bufonidae) in Costa Rica. Mesoamerican Herpetology, 3(1), 128-134.
Berger, L., Hyatt, A. D., Speare, R., & Longcore, J. E. (2005). Life cycle stages of the amphibian chytrid Batrachochytrium dendrobatidis. Diseases of Aquatic Organisms, 68(1), 51-63. https://doi.org/10.3354/dao068051
Boyle, D. G., Boyle, D. B., Olsen, V., Morgan J. A. T., & Hyatt, A. D. (2004). Rapid quantitative detection of chytridiomycosis (Batrachochytrium dendrobatidis) in amphibian samples using real - time Taqman PCR assay. Diseases of aquatic organisms, 60(2), 141-148. https://doi.org/10.3354/dao060141
Briggs, C.J., Knapp, R. A., & Vredenburg, V. T. (2010). Enzootic and epizootic dynamics of the chytrid fungal pathogen of amphibians. Proceedings of the National Academy of Sciences, 107(21), 9695–9700. https://doi.org/10.1073/pnas.0912886107
González-Maya, J. F., & Mata-Lorenzen, J. (2008). Dung-beetles (Coleoptera: Scarabidae) from the Zona Protectora Las Tablas, Talamanca, Costa Rica. Check-List, 4(4), 458-463. https://doi.org/10.15560/4.4.458
González-Maya, J. F., Belant, J. L., Wyatt, S. A., Schipper, J., Cardenal, J., Corrales, D., Cruz-Lizano, I., Hoepker, A. Escobedo-Galván, A. H., Castañeda, F., & Fischer, A. (2013). Renewing hope: the rediscovery of Atelopus varius in Costa Rica. Amphibia-Reptilia, 34(4), 573-578. https://doi.org/10.1163/15685381-00002910
González-Maya, J. F., Gómez-Hoyos, D. A., Cruz-Lizano, I., & Schipper, J. (2018). From hope to alert: demography of a remnant population of the Critically Endangered Atelopus varius from Costa Rica. Studies on Neotropical Fauna and Environment, 53(3), 194-200. https://doi.org/10.1080/01650521.2018.1460931
Hyatt, A. D., Boyle, D. G., Berger, L., Obendorff, D., Dalton, A., Kriger, K., Hero, M., Hines, H., Phillott, R., Campbell, R., Marantelli, G., Gleason, F., & Colling, A. (2007). Diagnostic assays and sampling protocols for the detection of Batrachochytrium dendrobatidis. Diseases of aquatic organisms, 73(3), 175-192. https://doi.org/10.3354/dao073175
IUCN SSC Amphibian Specialist Group. 2020. Atelopus varius. The IUCN Red List of Threatened Species 2020: e.T54560A3016252. https://dx.doi.org/10.2305/IUCN.UK.2020-3.RLTS.T54560A3016252.en.
Jiménez-Monge, A., Montoya-Greenheck, F., Bolaños, F., & Alvarado, G. (2019). From incidental findings to systematic discovery: locating and monitoring a new population of the endangered Harlequin Toad. Amphibian & Reptile Conservation, 13(2), [General Section], 115–125 (e192). https://bit.ly/3HEiro2
Kriger, K. M., Hines, H. B., Hyatt, A. D., Boyle, D. G., & Hero, J. M. (2006). Techniques for detecting chytridiomycosis in wild frogs: comparing histology with real-time Taqman PCR. Diseases of Aquatic Organisms, 71(2), 141–148. https://doi.org/10.3354/dao071141
La Marca, E., Lips, K. R., Lötters, S., Puschendorf, R., Ibáñez, R., Rueda-Almonacid, J. V., Schulte, R., Marty, C.,Castro, F., Manzanilla-Puppo, J., García-Pérez, J. E., Bolaños, F., Chaves, G., Pounds, J. A., Toral, E., & Young, B. E. (2005). Catastrophic population declines and extinctions in neotropical harlequin frogs (Bufonidae: Atelopus). Biotropica, 37(2), 190-201. https://doi.org/10.1111/j.1744-7429.2005.00026.x
Lampo, M, Celsa, S. J., Rodríguez-Contreras, A., Rojas-Runjaic, F. & García, C. Z. (2012). High turnover rates in remnant populations of the harlequin frog Atelopus cruciger (Bufonidae): Low risk of extinction? Biotropica, 44(3), 420-426. https://doi.org/10.1111/j.1744-7429.2011.00830.x
Lips, K. R., Brem, F., Brenes, R., Reeve, J. D.,Alford, R. A., Voyles, J., Carey, C., Livo, L., Pessier, A. P., & Collins, J. P. (2006). Emerging infectious disease and the loss of biodiversity in a Neotropical amphibian community. Proceedings of the National Academy of Sciences of the United States of America, 103(9), 3165–3170. https://doi.org/10.1073/pnas.0506889103
Lips, K. R., Green, D. E., & Papendick, D. y R. (2003). Chytridiomycosis in wild frogs from Southern Costa Rica. Journal of Herpetology, 37(1), 215-218. https://doi.org/10.1670/0022-1511(2003)037[0215:CIWFFS]2.0.CO;2
Mazerolle, M. J. (2020). AICcmodavg: Model selection and multimodel inference based on (Q)AIC(c). R package version 2.3-1. https://cran.r-project.org/package=AICcmodavg.
R Core Team. (2020). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL https://www.R-project.org/
Seisdedos-de-Vergara, M. D. R. (2017). Evaluación del estado poblacional del sapo arlequín (Atelopus varius) y la prevalencia del hongo quitridio (Batrachochytrium dendrobatidis) en una población de la zona protectora Las Tablas, Costa Rica. [Tesis de maestría, Universidad Nacional de Costa Rica]. http://hdl.handle.net/11056/14138
Solano Cascante, J. C., Solano Cascante, B. J., Boza-Ociedo, E. E., Vargas Quesada, J., & Méndez, D. S. (2014). Hallazgo del sapo payaso Atelopus varius (Anura: Bufonidae) en La Luchita (Potrero Grande: Buenos Aires: Puntarenas: Costa Rica). Proyecto Biodiversidad de Costa Rica.
Vásquez-Ochoa, A., Bahamón Carmona, P., Prada Salcedo, L. D., & Franco-Correa, M. (2012). Detección y cuantificación de Batrachochytrium dendrobatidis en anfibios de las regiones Andina central, oriental, Orinoquía y Amazonía de Colombia. Herpetotropicos, 8(1-2), 13-21. https://bit.ly/329Rlom
Whitfield, S. M., Alvarado, G., Abarca, J., Zumbado, H., Zuñiga, I., Wainwright, M., & Kerby, J. (2017). Differential patterns of Batrachochytrium dendrobatidis infection in relict amphibian populations following severe disease-associated declines. Diseases of aquatic organisms, 126(1), 33-41. https://doi.org/10.3354/dao03154
Whitfield, S. M., Lips, K. R., & Donnelly, M. A. (2016). Amphibian decline and conservation in Central America. Copeia, 104(2), 351-379. https://doi.org/10.1643/CH-15-300
Wickham, H. (2016). ggplot2: Elegant Graphics for Data Analysis. Springer. https://doi.org/10.1007/978-3-319-24277-4
Zumbado-Ulate, H., Nelson, K. N., García-Rodríguez, A., Chaves, G., Arias, E., Bolaños, F., Whitfield, S. M., & Searle, C. L. (2019). Endemic infection of Batrachochytrium dendrobatidis in Costa Rica: Implications for amphibian conservation at regional and species level. Diversity, 11(8), 129. https://doi.org/10.3390/d11080129