
UNED Research Journal (e-ISSN 1659-441X), Vol. 14(supl.1): e3873, June, 2022
Efemerópteros del género Camelobaetidius (Ephemeroptera: Baetidae) como bioindicadores en ecosistemas lóticos de Costa Rica: ACLA-P
1. Universidad Nacional, Escuela de Ciencias Biológicas, Laboratorio de Entomología, Avenida 1, Calle 9 Heredia 86, Heredia, Costa Rica; fabian.sibaja.araya@est.una.ac.cr
Recibido 15-X-2021 Corregido 21-X-2021 Aceptado 25-X-2021
DOI: https: //doi.org/10.22458/urj.v14iS1.3873
|
ABSTRACT. “Camelobaetidius (Ephemeroptera: Baetidae) as an indicator for management of lotic ecosystems in Costa Rica: ACLA-P”. Introduction: The study of aquatic insects in lotic ecosystems has been promoted in recent years for bioindication of changes associated with socioeconomic development. However, there are information gaps for orders sensitive to environmental deterioration such as Ephemeroptera, which limits their use as a bioindicators. Objective: To evaluate the bioindication potential of the ephemeropteran genus Camelobaetidius in Costa Rica. Methods: We analyzed taxonomically samples from 28 streams and rivers and used Influence Zones to assess vulnerability to contamination. Results: In Morphospecies distribution was associated with slope and altitude gradient. We identified Camelobaetidius guaycara and morphologically characterized 12 morphospecies of the genus, classifying them from "very tolerant" to "little tolerant" (influence zones: eight high vulnerability, 16 medium and four low vulnerability). In the La Amistad-Pacífico Conservation Area we found four morphospecies in two streams/rivers with different conservation status. Conclusion: In Costa Rica, slope and altitude affect the distribution of several mosphospecies of Camelobaetidius that can be used as bioindicators for water pollution.
Keywords: Central America, Aquatic insects, Bioindication, Remnant biodiversity.
|
RESUMEN. Introducción: El estudio de insectos acuáticos en ecosistemas lóticos se ha vuelto común en los últimos años para la bioindicación de cambios asociados al desarrollo socioeconómico. Sin embargo, existen vacíos de información para órdenes sensibles al deterioro ambiental como Ephemeroptera, lo que limita su uso como bioindicadores. Objetivo: Evaluar el potencial de bioindicación de los efemerópteros del género Camelobaetidius en Costa Rica. Métodos: Analizamos taxonómicamente muestras de 28 arroyos y ríos y usamos el método de Zonas de Influencia para evaluar la vulnerabilidad a la contaminación. Resultados: En estas morfoespecies la distribución se asoció con la pendiente y el gradiente altitudinal. Identificamos a Camelobaetidius guaycara y caracterizamos morfológicamente 12 morfoespecies del género, clasificándolas de "muy tolerante" a "poco tolerante" (zonas de influencia: ocho de vulnerabilidad alta, 16 vulnerabilidad media y cuatro de vulnerabilidad baja). En el Área de Conservación La Amistad-Pacífico encontramos cuatro morfoespecies en dos quebradas/ríos con diferente estado de conservación. Conclusión: En Costa Rica, la pendiente y la altitud afectan la distribución de varias mosfoespecies de Camelobaetidius que pueden usarse como bioindicadores de la contaminación del agua.
Palabras clave: América Central, Insectos acuáticos, Bioindicación, Biodiversidad remanente.
|
El estudio de los macroinvertebrados bentónicos se ha impulsado en Latinoamérica gracias a su utilización como indicadores biológicos para el monitoreo y la valoración de la calidad de las aguas superficiales en quebradas y ríos (Buss et al., 2015; Roldán-Pérez, 2016), estos indicadores se definen como organismos con una determinada tolerancia a condiciones específicas de calidad de agua (Alba-Tercedor & Sánchez-Ortega, 1988; Peinador, 2004; Buss & Salles, 2007; Barman &Gupta, 2015; Kubendran et al., 2017). Con ventajas de aplicación como bajo costo, detección tanto de tendencias temporales de calidad como incidentes que puedan comprometer la integridad del medio o del ecosistema, en comparación con valoraciones fisicoquímicas del agua con costos superiores y una detección de contaminación limitada al momento de recolecta de la muestra (Hellawell, 1986; Alba-Tercedor, 1996; Springer, 2010; Carter et al., 2017).
En Costa Rica (CR), el uso de esta fauna bentónica para la valoración de la calidad del agua tuvo sus primeras aplicaciones en la provincia de Heredia, específicamente en la subcuenca del río Virilla (Charpentier & Tabash, 1988; Craig, 1992), y posteriormente en diferentes cuencas hidrográficas a lo largo del país (Flowers et al., 1995; Peinador, 2004; Mafla, 2005). Dada su utilidad, los macroinvertebrados acuáticos se consolidaron como herramienta de monitoreo en CR mediante la creación del Reglamento para la Evaluación y Clasificación de la Calidad de Cuerpos de Agua Superficiales (Decreto 33903-MINAE-S, 2007), y la inclusión del índice Biological Monitoring Working Party (BMWP), adaptado a partir Alba-Tercedor y Sánchez-Ortega (1988).
En cuanto a los táxones reconocidos como macroinvertebrados, en su mayoría están representados por insectos junto con otros grupos como Crustacea, Hirudinea, Mollusca, Oligochaeta y Turbellaria, los cuales tienen un amplio ámbito de tolerancia a la contaminación acuática (Decreto 33903-MINAE-S, 2007). Asimismo, la utilización exclusiva de órdenes de Insecta como Ephemeroptera, Plecoptera y Trichoptera (EPT) ha sido considerada suficiente para proporcionar información sobre la salud de los cuerpos de agua. Sin embargo, es importante considerar que este análisis muestra solamente una parte de la comunidad bentónica (Barbour et al., 1999; Bain et al., 2000; Kitchin, 2005; Herman & Nejadhashemi, 2015).
En su mayoría, dichos macroinvertebrados son insectos acuáticos con una amplia tolerancia a las alteraciones ambientales, donde géneros como Camelobaetidius (Ephemeroptera: Baetidae) presentan ninfas que pueden encontrarse en cuerpos de agua cuyas condiciones naturales presentan variadas alteraciones por distintas coberturas de uso de la tierra (Peinador, 2004; Buss&Salles, 2007; Valverde et al., 2009; Bertaso et al., 2015; Dedieu et al., 2015; Municipalidad de Curridabat, 2015; Firmiano et al., 2017). Por tanto, este género presenta un importante potencial de bioindicación, que podría ser utilizado para profundizar el conocimiento sobre las respuestas de los organismos bentónicos a cambios en los ambientes acuáticos del neotrópico (Ramírez & Gutiérrez-Fonseca, 2014; Carrie et al., 2017).
Respecto a la gestión del recurso hídrico, esta enfrenta factores generales de vulnerabilidad como la demanda, disponibilidad, infraestructuras para el aprovechamiento, instituciones reguladoras, y variabilidad climática; los cuales requieren un manejo integrado, que se define como un proceso de desarrollo coordinado y administración del agua, tierra y recursos relacionados, para maximizar el bienestar socioeconómico sin comprometer los ecosistemas vitales (Setegn & Donoso, 2015; Padowski et al., 2015; Stathatou et al., 2016). En Costa Rica, la gestión del saneamiento por parte de las instituciones reguladoras es el principal factor de vulnerabilidad a la contaminación en las quebradas y ríos, lo cual representa un reto a futuro debido a los severos problemas de degradación de estos cuerpos de agua tanto en zonas urbanas como rurales (Varela, 2007; Contraloría General de la República, 2013; Kohlmann et al., 2015; Arana, 2016; Mena-Rivera et al., 2017; Fournier et al., 2018).
A nivel ecológico, dicha vulnerabilidad a la contaminación puede definirse como la posibilidad de afectación por las coberturas de uso de la tierra en las zonas de captación de la cuenca hidrográfica, que pueden influenciar de forma sinérgica la calidad del agua (definida por sus características físicas, químicas y biológicas (Spellman, 2010) de los ecosistemas lóticos mediante la erosión, sedimentación, enriquecimiento de nutrientes, contaminación, alteración hidrológica, pérdida de bosque ribereño y material vegetal (Cooper, 1993; Allan, 2004; Giri & Qiu, 2016). Con un crecimiento urbano que produce incrementos en residuos líquidos y sólidos; intensificación agrícola que genera aumentos en plaguicidas y macronutrientes; y áreas de pastoreo que conllevan al incremento de sedimentos, mientras que en ambientes boscosos sin actividades antropogénicas los únicos cambios están relacionados con las variaciones hidrológicas y geológicas (Hubbard et al., 2004; Baker, 2005; Ganong et al., 2015; McGrane, 2016).
Por tanto, el objetivo general de esta investigación fue evaluar el potencial de bioindicación de los efemerópteros del género Camelobaetidius de acuerdo con su presencia o ausencia en distintos ecosistemas lóticos de Costa Rica para el fortalecimiento de la utilización de los insectos acuáticos en el monitoreo del recurso hídrico. Además, es importante destacar que, aunque el estudio se llevó a cabo en diferentes regiones de Costa Rica, los datos presentados tienen un énfasis en el Área de Conservación La Amistad Pacífico (ACLA-P), y para las demás localidades en el país puede consultarse el documento original de tesis de Sibaja-Araya (2020).
MATERIALES Y MÉTODOS
Área de estudio y muestreo: Se analizaron 484 individuos de 76 muestras en alcohol correspondientes a 28 sitios de muestreo, distribuidas en la totalidad de provincias de Costa Rica, permitiendo tener una amplia representación de la distribución geográfica del género (el detalle de cada fecha de recolecta, nombre del cuerpo de agua, provincia, recolector, individuos analizados, elevación, orden del río, y coordenadas está disponible en Sibaja-Araya, 2020. Estas muestras se seleccionaron en el proyecto "Estudio Preliminar de la Ecología y Diversidad del Orden Ephemeroptera en Costa Rica" (código SIA 0230–13), a partir de las colecciones de insectos acuáticos del Laboratorio de Entomología de la Escuela de Ciencias Biológicas (LEUNA), Museo de Zoología (UNA), y la colección de macroinvertebrados acuáticos del Instituto Regional de Estudios en Sustancias Tóxicas (IRET-UNA). Su selección se realizó con base en los siguientes criterios: a) representación de áreas urbanas, rurales y boscosas; b) periodo de colecta de la muestra entre 2014–2017, favoreciendo el estado de conservación del material taxonómico y características ambientales recientes; c) rango altitudinal variado (14 a 1762msnm); y, d) diversas zonas geográficas del país como las regiones Brunca, Central, Chorotega, Huetar Atlántica, Huetar Norte, y Pacífico Central (Fig. 1).
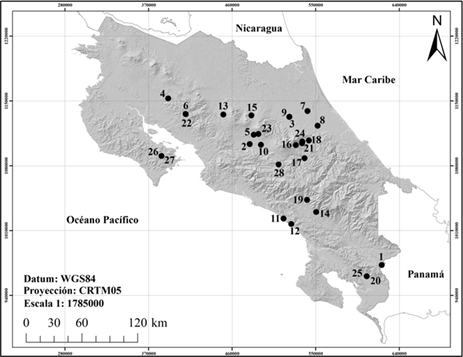
Fig. 1. Puntos de muestreo utilizados (los números del 1, 14 y 19 corresponden respectivamente en el ACLA-P a las quebradas Borbón y Tambor y al Río Chirripó).
Recolección de muestras: Por su parte, en siete de los puntos de muestreo fue utilizada una metodología de recolecta general (puntos 4, 6, 8, 10, 17, 18, 22), como la descrita en el Decreto 33903-MINAE-S (2007), mientras que las restantes 21 muestras se recolectaron de forma especializada en el microhábitat de Camelobaetidius, bajo el proyecto de investigación del LEUNA anteriormente mencionado, para optimizar la captura de ninfas en el campo (muestras recolectadas personalmente en 15 sitios, indicadas como ¨Col. F. Sibaja¨ en Sibaja-Araya, 2020). En cuanto dicha recolecta especializada, esta se enfocó en las superficies aplanadas rocosas o sedimentarias a lo largo y ancho de los cauces de quebradas y ríos, donde sus poblaciones se encuentran comúnmente; para la recolecta se realizaron raspados sobre dichas superficies con redes de mano rectangulares de 13 x 10cm o 25 x 13cm, durante al menos 15 minutos por sitio, y el material se conservó en alcohol al 75%.
Revisión taxonómica: Se realizó un análisis morfológico que incluyó características reconocidas por diferentes autores como diagnósticas, tales como tamaño, coloración, piezas bucales, osmobranquias coxales, uñas tarsales, espinas de los tergos abdominales y paraproctos (Traver & Edmunds, 1968; McCafferty & Waltz, 1990; McCafferty & Randolph, 2000; Nieto, 2003; Salles & Serrão, 2005; Boldrini & Pes, 2014). Dado que las ninfas de este género no superan los dos centímetros de longitud, fue necesaria la utilización de equipo óptico tal como microscopio (Premiere® MRP-161), estereoscopio (Premiere® SMZ-05), y una cámara digital adaptable al equipo (AmScope®), para fotografiar las características diagnósticas del material analizado.
Además, para la identificación taxonómica se utilizaron las descripciones originales y complementarias de las especies de Camelobaetidius reportadas para el país y las descripciones de las demás especies presentes en América Central, Norteamérica y Sudamérica, con el fin de detectar nuevas localidades en su rangos de distribución; también, como material de apoyo se revisaron los paratipos de las especies C. maidu Jacobus & McCafferty, 2005, C. variabilis Wiersema, 1998, C. kondratieffi Lugo-Ortiz &McCafferty, 1995 and C. shepardi Randolph & McCafferty, 2001, facilitados por la Colección de Insectos Acuáticos de la Universidad Purdue (Indiana, Estados Unidos). A partir de este análisis, se construyó una clave taxonómica tentativa con características diagnósticas ilustradas para distinguir la diversidad del género, y su validación se realizó mediante consultas con expertos en Ephemeroptera: Frederico Falcão Salles, Universidad Federal de Viçosa (Brasil); Luke Jacobus, Universidad Purdue (Indiana, EUA); Rafael Boldrini, Universidad Federal de Rondônia (Brasil); y el entomólogo acuático Carlos Esquivel Herrera, Universidad Nacional, (Costa Rica).
Vulnerabilidad a la contaminación y tolerancia: Con el fin de definir a macroescala la vulnerabilidad a la contaminación en los 28 sitios de muestreo, se establecieron las coberturas de uso de la tierra dentro de Zonas de Influencia (ZI), que consideraron una escala de “sistema” para abarcar la red fluvial aguas arriba desde cada punto de muestreo y una escala de “segmento” (Frissell et al., 1986; Klemas, 2014), en las cuales se delimitaron 200 metros cuadrados medidos horizontalmente sobre cada margen del río; tomando en cuenta que las coberturas pueden provocar alteraciones en los ambientes lóticos desde distancias menores a 100 m (Davies & Nelson, 1994; Lammert & Allan, 1999; Roy et al., 2003; Sweeney & Newbold, 2014) y que una ZI de 200 m es suficientemente representativa para explicar un alto porcentaje de la variabilidad de la calidad del agua (>50%; Nava-López et al., 2016). Esto, con ayuda del software ArcGIS 10.3© y la red hídrica del Atlas de Costa Rica (Instituto Tecnológico de Costa Rica, 2014), a través de la técnica de fotointerpretación sobre imágenes satelitales RapidEye del 2012 (con apoyo adicional Carta de 2005 y Google Earth Pro), en categorías basadas en el estándar Corine Land Cover (CLC) versión Costa Rica (Rosales, 2016), los cuales fueron insumos facilitados por el laboratorio PRIAS del CeNAT.
Por último, de acuerdo con valoraciones conocidas de calidad de agua en algunos de los sitios de muestreo seleccionados (Krishnaswamy et al., 2001; Echeverría-Sáenz et al., 2011; Municipalidad de Belén & Universidad Nacional, 2013; Guevara-Mora & Bonilla-Traña, 2017; Mena-Rivera et al., 2017; Mena-Rivera et al., 2018; Pérez-Rubio & Mende, 2018; Rojas, 2018) y en consideración exclusiva de los porcentajes de coberturas agropecuarias y urbanas donde se originan las fuentes de contaminantes, las 28 ZI fueron clasificadas en tres categorías de vulnerabilidad a la contaminación, definidas como “vulnerabilidad alta” las ZI con áreas urbanas y agropecuarias entre 59–90% (áreas boscosas de 7–36%), “vulnerabilidad media” las ZI con áreas urbanas y agropecuarias entre 5–58% (áreas boscosas de 36–88%), y “vulnerabilidad baja” las ZI con áreas urbanas y agropecuarias entre 0–4% y (áreas boscosas de 74–100%); bajo esta categorización, las ninfas de Camelobaetidius fueron respectivamente clasificadas como “muy tolerantes”, “algo tolerantes”, y “poco tolerantes”.
Análisis estadístico: Mediante el programa estadístico R (R Core Team, 2019) y R Studio (Version 3.6.1) se realizó, previa comprobación de la normalidad (Test de Shapiro al 95%), un estudio para validar patrones de distribución de las morfoespecies según la vertiente y el rango altitudinal, mediante un análisis de varianza tipo PERMANOVA (Anderson, 2001) entre la presencia/ausencia de morfoespecies, utilizando como factores de variación la pertenencia a la vertiente (90% de significancia) y la elevación del sitio de muestreo (95% de significancia). El PERMANOVA considera la similitud en la composición de especies entre las distintas observaciones mediante la construcción de una matriz de resemblanza (Oksanen et al., 2019). La utilización de la presencia/ausencia de cada uno de las morfoespecies redujo la heterogeneidad de las metodologías utilizadas en la recolecta del material revisado.
RESULTADOS
Se identificó la especie Camelobaetidius guaycara Sibaja-Araya & Esquivel, 2018 (morfoespecie 1) y 12 morfoespecies, las cuales se separaron taxonómicamente por un conjunto de caracteres que incluyen principalmente talla (mm), coloración, mandíbulas, palpos labiales, y uñas tarsales. De estas morfoespecies, cuatro se encontraron en los puntos Quebrada Borbón, Quebrada Tambor y Río Chirripó que corresponden a los cuerpos de agua superficial en el ACLA-P registrados como 1, 14 y 19, dichas morfoespecies pueden distinguirse principalmente por la cantidad de dentículos en la uñas tarsales, con uñas de 24 o más en las morfoespecies 7 y 9, y uñas con 11 dentículos o menos en las morfoespecies 11 y 13, otras características diagnósticas pueden apreciarse en las figuras 2,3, 4 y 5.
En cuanto a los sitios de muestreo, se digitalizaron un total de 35.988 ha en las ZI de los 28 sitios de estudio, en las cuales dominaron las coberturas urbanas (continuas y discontinuas), agropecuarias (cultivos anuales y permanentes, pastos limpios y arbolados), y boscosas (bosque denso, de galería y secundario). Además, se encontró que las coberturas boscosas remanentes pueden estar muy reducidas como Quebrada Borbón con un 32% de bosque remanente (Fig. 6) o altamente fragmentadas como en el sitio Río Chirripó con un porcentaje de bosque remanente del 55% dividido en 79 fragmentos (Fig.7). Además, se definieron con vulnerabilidad alta a la contaminación ocho ZI (Borbón, Seca, Tortuga, Cañas, Jiménez, Peje, San Rafael, y Tibás); 16 ZI con vulnerabilidad media (Bonilla, Tambor, Ángel, Aquiares, Atirro, Chirripó, Ciruelas, Claro, Colima, Guacimal, Playa Hermosa, Porrosatí, Poza Azul, San Luis, Segunda, y Torito); y cuatro ZI con vulnerabilidad baja (Negra, Blanco, Sombrero, y Manigordo). Según esta clasificación, se determinaron C. guaycara y seis morfoespecies como ¨muy tolerantes¨ presentes en sitios de ZI con vulnerabilidad alta, media y baja, cuatro morfo especies ¨algo tolerantes¨ exclusivamente en sitios con ZI con vulnerabilidad media, y dos morfoespecies ¨poco tolerantes¨ exclusivamente en sitios con ZI con vulnerabilidad baja (Tabla 1).
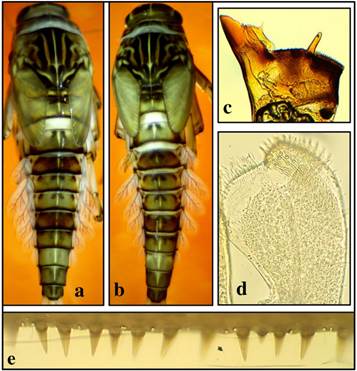
Fig. 2. Camelobaetidius sp. 7. coloración a) hembra y b) macho, c) mandíbula izquierda, d) palpo labial, y e) espinas del cuarto tergo abdominal.
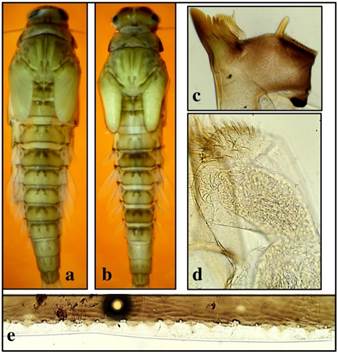
Fig. 3. Camelobaetidius sp. 9. coloración a) hembra y b) macho, c) mandíbula izquierda, d) palpo labial, y e) espinas del cuarto tergo abdominal.
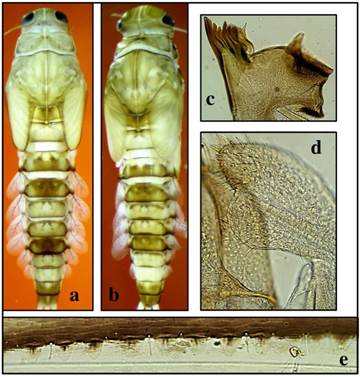
Fig. 4. Camelobaetidius sp. 11. coloración a) hembra y b) macho, c) mandíbula izquierda, d) palpo labial, y e) espinas del cuarto tergo abdominal.
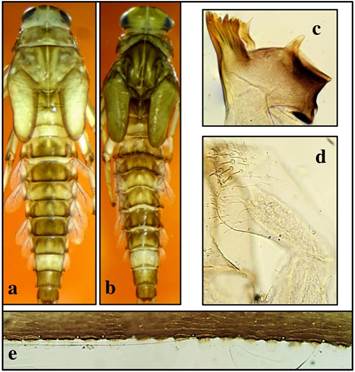
Fig. 5. Camelobaetidius sp. 13. coloración a) hembra y b) macho, c) mandíbula izquierda, d) palpo labial, y e) espinas del cuarto tergo abdominal.
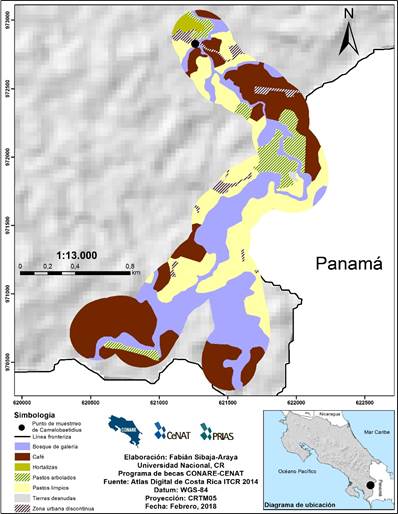
Fig. 6. Zona de influencia para Quebrada Borbón.
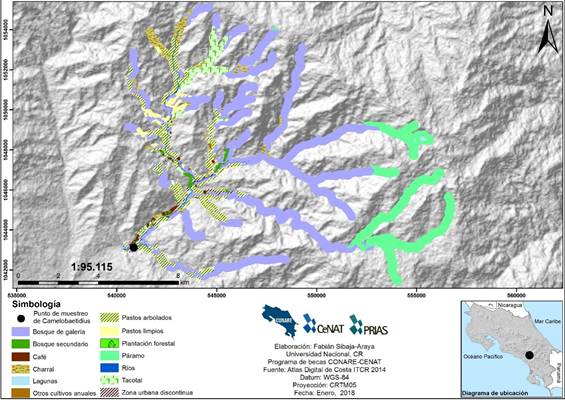
Fig.7.Zona de influencia para Río Chirripó.
TABLA1
Morfoespecies presentes según la vulnerabilidad a la contaminación en las Zonas de Influencia.
|
Zona de Influencia |
Quebradas y Ríos |
Vulnerabilidad a contaminación |
Morfoespecies |
|
Áreas urbanas y agropecuarias entre 59–90% (áreas boscosas de 7–36%) |
Borbón, Seca, Tortuga, Cañas, Jiménez, Peje, San Rafael, Tibás |
Alta |
1 (C. guaycara), 2, 3, 6, 9, 11, 12 |
|
Áreas urbanas y agropecuarias entre 5–58% (áreas boscosas de 36–88%) |
Bonilla, Tambor, Ángel, Aquiares, Atirro, Chirripó, Ciruelas, Claro, Colima, Guacimal, Playa Hermosa, Porrosatí, Poza Azul, San Luis, Segunda, Torito |
Media |
1 (C. guaycara), 3, 5, 7, 8, 9, 11, 12, 13 |
|
Áreas urbanas y agropecuarias entre 0–4% (áreas boscosas de 74–100%) |
Negra, Blanco, Sombrero, Manigordo |
Baja |
1 (C. guaycara), 4, 5, 10 |
En cuanto a los análisis PERMANOVA, se encontraron relaciones significativas entre las morfoespecies y su presencia de acuerdo con la vertiente (F= 1,8906, p<0,10, gl=1) y la elevación (F= 9,3545, p<0,05, gl= 1), con las morfoespecies 3, 6, 8, 10 distribuidas solamente en la vertiente Caribe; las morfoespecies 2, 4, 5, 9 y 13 únicamente en la vertiente Pacífica, y las morfoespecies 1 (C. guaycara), 7, 11, y 12 en ambas vertientes; entre estas, algunas se encontraron exclusivamente en uno o dos ríos de una sola cuenca hidrográfica (morfoespecies 2, 4, 5, 10, 13, Tabla 1). Asimismo, se encontró un patrón de distribución altitudinal en el cual C. guaycara (morfoespecie 1) y cinco morfoespecies están exclusivamente en elevaciones por debajo de los 600 msnm, y siete solamente en elevaciones sobre 700 msnm (Fig. 7), con menor cantidad de morfoespecies en el límite superior del rango de distribución de ambos grupos altitudinales, así como un rango de distribución más amplio para las morfoespecies de elevaciones medias (Fig. 8).

Fig.8.Cantidad de morfoespecies registradas cada 200 metros en el gradiente altitudinal del material revisado, con “n” como cantidad de sitios de muestreo.
DISCUSIÓN
En cuanto a la diversidad de Camelobaetidius en Costa Rica, la identificación de una especie y 12 morfoespecies sugiere que los registros de la literatura pueden estar subestimados en toda América Central, con apenas ocho especies reportadas para la región (Allen & Cohen, 1977; Lugo-Ortiz & McCafferty, 1995; Lugo-Ortiz & McCafferty, 1996; Wiersema & Baumgardner, 2000; McCafferty et al., 2004; Meyer et al., 2008; McCafferty, 2011a, b; De Jong & Canton, 2015, Sibaja-Araya & Esquivel, 2018). Otros esfuerzos taxonómicos con este género han sido llevados a cabo en países sudamericanos como Argentina y Brasil, donde se ha reportado la presencia de entre 7 y 24 especies (Nieto 2003, Salles et al., 2016). Además, es importante resaltar que en el país la familia Baetidae reporta 15 géneros (Flowers & De la Rosa, 2010) y en ningún otro caso se ha realizado una revisión taxonómica, por lo cual su diversidad puede también estar subestimada.
Por otro lado, la definición de coberturas de la tierra como indicador de vulnerabilidad a la contaminación en quebradas y ríos, es una herramienta que permite identificar a macroescala patrones de deterioro del ambiente en los cuerpos de agua superficial, lo cual respalda su implementación en diferentes estrategias de gestión del recurso hídrico a nivel internacional (Li et al., 2006; Widyastuti & Suprayogi, 2016; Behmel et al., 2016; Stathatou et al., 2016). Asimismo, dicho deterioro de las coberturas naturales involucra también las áreas de amortiguamiento establecidas mediante legislación nacional (Ley 7575, 1996; Reglamento 25721, 1997), que son inexistentes en algunos sectores de la mayoría de las ZI, al estar ocupadas comúnmente por cultivos, pasturas, y urbanizaciones, por lo que se da un incumplimiento de la ley tanto en zonas urbanas como rurales.
Además, se encontró que la diversidad de Camelobaetidius puede dividirse en tres diferentes condiciones de vulnerabilidad a la contaminación, lo que puede explicar su tolerancia a variadas condiciones ambientales (Municipalidad de Curridabat, 2015; Ríos et al., 2015; Rúa et al., 2015; Aguirre, 2017; García-Alzate et al., 2017; Firmiano et al., 2017; Villada-Bedoya et al., 2017; Pillasagua, 2018; Ramírez et al., 2018). Por tanto, estos organismos ahora categorizados por su tolerancia pueden aprovecharse como indicadores, lo cual es una característica que puede o no encontrarse en diferentes grupos de insectos (Sommaggio & Burgio, 2014; Bharti et al., 2016; Watts et al., 2017); en este sentido, al menos dos morfoespecies (4 y 10) se consideraron como “poco tolerantes” y podrían utilizarse de manera análoga a las familias de macroinvertebrados con mayor puntaje en el BMWP-CR (Decreto 33903-MINAE-S, 2007).
Entre las demás morfoespecies resalta la presencia de la morfoespecie 9 y 11 en quebradas y ríos donde existen niveles severos de deterioro en la calidad del agua como en Quebrada Seca y Río Tibás (Varela, 2007; Contraloría General de la República, 2013; Municipalidad de Belén & Universidad Nacional, 2013; Mena-Rivera et al., 2017; Mena-Rivera et al., 2018) así como un importante deterioro de la cobertura boscosa como en Quebrada Borbón. Por consiguiente, la supervivencia exclusiva de estas morfoespecies “muy tolerantes” puede ser un indicador de una mala calidad del agua para estas regiones del país. Otras morfoespecies consideradas “algo tolerantes” como 7 y 13 mantienen sus poblaciones en ecosistemas lóticos con ZI que presentan vulnerabilidad media a la contaminación como el río Chirripó y una mejor calidad del agua como en los ríos Guacimal y San Luis (Guevara-Mora & Bonilla-Traña, 2017). Por tanto, la ausencia de estas morfoespecies podría utilizase como indicador de un eventual deterioro de la calidad del agua en estos sitios, como en el caso del río Chirripó que presenta presiones por cambios en las coberturas de uso de la tierra (Krishnaswamy et al., 2001).
Por su parte, la estrecha relación entre la distribución de las morfoespecies y las vertientes sugiere un importante aislamiento por barreras climáticas y geográficas, que se manifiesta en la diferenciación genética dentro de las poblaciones de insectos acuáticos en ambientes tropicales, lo cual se relaciona con la especiación alopátrica y la adaptación ecológica considerados como factores primarios en la diversificación de estos organismos (Dijkstra et al., 2014; Polato et al., 2018). Por tanto, esto puede ayudar a explicar la alta diversidad de la familia Baetidae, que presenta a nivel mundial la segunda mayor cantidad de géneros y especies, con más del 90% consideradas como endémicas en la región Neotropical (Barber-James et al., 2008; Gattolliat & Nieto, 2009; Salles et al., 2018).
Asimismo, se detectó una relación significativa entre la presencia de las diferentes morfoespecies y el gradiente altitudinal de 14–1762 msnm, más bajo en comparación que el observado para Camelobaetidius en ecosistemas lóticos de Colombia, entre 289–2900 msnm (Gutiérrez & Reinoso-Flores, 2010; Gutiérrez & Dias, 2015). Esta separación altitudinal encontrada se ha registrado tanto para otras especies de Ephemeroptera como para el orden Trichoptera en ríos tropicales de Ecuador, Nueva Guinea y Tailandia, lo cual puede asociarse a preferencias en la temperatura del agua (Malicky & Chantaramongkol, 1993; Shah et al., 2017; Cozzarolo et al., 2019), y a la disponibilidad de alimento caracterizada en elevaciones bajas por material alóctono (hojarasca) y material autóctono (algas epilíticas) en elevaciones medias y altas (Atkinson et al., 2018).
En conclusión, resalta la alta diversidad encontrada de Camelobaetidius a pesar de las serias presiones de las actividades socioeconómicas sobre los ecosistemas lóticos del país, lo cual sugiere una importante resiliencia en estos cuerpos de agua superficial que mantienen todavía características favorables para algunos insectos acuáticos de amplia distribución geográfica. Con respecto a la vulnerabilidad a la contaminación en los sitios de muestreo, se encontró que el análisis a macroescala de coberturas de uso de la tierra fue útil para la identificación de patrones de deterioro ambiental en quebradas y ríos de Costa Rica, los cuales se caracterizan por una amplia sustitución de las zonas boscosas naturales por coberturas agropecuarias y urbanas. Finalmente, en cuanto a estrategias de educación ambiental sobre cuerpos de agua superficial de zonas urbanas y agropecuarias en Costa Rica, debe considerarse el hecho de que estos ecosistemas representan importantes reservorios para la biodiversidad, en los cuales sobreviven distintas poblaciones de insectos acuáticos como los encontrados en esta investigación.
AGRADECIMIENTOS
Agradecemos al equipo de biólogos del Laboratorio de Entomología de la Escuela de Ciencias Biológicas de la Universidad Nacional (LEUNA, código SIA 0484–18), Francisco Bravo Chavarría, Carlos Esquivel Herrera, Meyer Guevara Mora, Randall Montoya Solano, David Romero Serrano y Óscar Vásquez Bolaños, a la bióloga Silvia Echeverría Sáenz del Instituto Regional de Estudios en Sustancias Tóxicas (IRET-UNA), al Fondo para el Fortalecimiento de las Capacidades Estudiantiles (FOCAES, UNA), a la geógrafa Geannina Moraga López colaboradora del Laboratorio de Hidrología de la Escuela de Ciencias Biológicas de la UNA, al biólogo Mauricio Herrera Campos del Laboratorio de Zoología de la Escuela de Ciencias Biológicas de la UNA, al Centro Nacional de Alta Tecnología (CeNAT) y al Laboratorio PRIAS PRIAS, a la geógrafa Francini Acuña Piedra especialista en sensores remotos y teledetección, a los entomólogos Luke Jacobus de la Universidad de Purdue (EUA) y Frederico Falcão Salles de la Universidad Federal de Viçosa (Brasil), y al biólogo Rafael Boldrini de la Universidad Federal de Roraima (Brasil).
ÉTICA, CONFLICTO DE INTERESES Y DECLARACIÓN DE FINANCIAMIENTO
Declaro haber cumplido con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en la preparación de este documento; que no hay conflictos de interés de ningún tipo, y que todas las fuentes financieras se detallan plena y claramente en la sección de agradecimientos. Asimismo, estoy de acuerdo con la versión editada final de esta publicación. El respectivo documento legal firmado se encuentra en los archivos de la revista.
REFERENCIAS
Aguirre, J. M. (2017). Relación entre la composición y estructura de Macroinvertebrados acuáticos y la cobertura vegetal ribereña de cuatro tributarios del río Oglan Pastaza-Ecuador. [Tesis pregrado, Universidad Central del Ecuador]. http: //www.dspace.uce.edu.ec/handle/25000/11042
Alba-Tercedor, J. (1996). Macroinvertebrados acuáticos y calidad de las aguas de los ríos. In: IV Simposio del agua en Andalucía (SIAGA). Almería. pp. 203–213.
Alba-Tercedor, J., & Sánchez-Ortega, A. (1988). Un método rápido y simple para evaluar la calidad biológica de las aguas corrientes basado en el de Hellawell (1978). Limnetica, 4, 51–56.
Allan, J. D. (2004). Landscapes and riverscapes: the influence of land use on stream ecosystems. Annual review of ecology, evolution, and systematics, 35, 257–284.https: //doi.org/10.1146/annurev.ecolsys.35.120202.110122
Allen, R.K., & Cohen, S. D. (1977). Mayflies (Ephemeroptera) of Mexico and Central America: new species, descriptions, and records. The Canadian Entomologist,109(3), 399–414.https: //doi.org/10.4039/Ent109399-3
Anderson, M.J. (2001). A new method for non-parametric multivariate analysis of variance. Austral Ecology, 26: 32–46. https: //doi.org/10.1111/j.1442-9993.2001.01070.pp.x
Arana, V. (2016). Water and Territory in Latin America. Trends, Challenges and Opportunities.Springer International Publishing.
Atkinson, C. L., Encalada, A. C., Rugenski, A. T., Thomas, S. A., Landeira-Dabarca, A., Poff, N. L., &Flecker, A. S. (2018). Determinants of food resource assimilation by stream insects along a tropical elevation gradient. Oecologia, 187(3), 731-744. https: //doi: 10.1007/s00442-018-4142-2
Bain, M. B., Harig, A. L., Loucks, D. P., Goforth, R. R., & Mills, K. E. (2000). Aquatic ecosystem protection and restoration: advances in methods for assessment and evaluation. Environmental Science & Policy, 3, 89–98.
Baker, A. (2005). Land Use and Water Quality. EnM.G. Anderson & J.J. Mcdonnell (Eds.).Encyclopedia of Hydrological Sciences.Jonh Wiley & Sons, Ltd.
Barber-James, H. M., Gattolliat, J. L., Sartori, M., & Hubbard, M. D. (2008). Global diversity of mayflies (Ephemeroptera, Insecta) in freshwater. Hydrobiologia, 595(1), 339–350.https: //doi.org/10.1007/s10750-007-9028-y
Barbour, M. T., Gerritsen, J., Snyder, B. D., & Stribling, J. B. (1999). Rapid bioassessment protocols for use in streams and wadeable rivers. USEPA.
Barman, B., & Gupta, S. (2015). Aquatic insects as bio-indicator of water quality-A study on Bakuamari stream, Chakrashila Wildlife Sanctuary, Assam, North East India. Journal of Entomology and Zoology Studies, 3(3), 178–186.
Bharti, H., Bharti, M., & Pfeiffer, M. (2016). Ants as bioindicators of ecosystem health in Shivalik Mountains of Himalayas: assessment of species diversity and invasive species. Asian myrmecology, 8(1), 65–79.
Behmel, S., Damour, M., Ludwig, R., & Rodriguez, M. J. (2016). Water quality monitoring strategies-A review and future perspectives. Science of the Total Environment, 571, 1312–1329.https: //doi.org/10.1016/j.scitotenv.2016.06.235
Bertaso, T., Spies, M. R., Kotzian, C. B., & Flores, M. L. (2015). Effects of forest conversion on the assemblages structure of aquatic insects in subtropical regions. Revista Brasileira de Entomologia, 59(1), 43–49.
Boldrini, R., &Pes, A.M.O. (2014). Five new species of CamelobaetidiusDemoulin, 1966 (Ephemeroptera: Baetidae), and redescription of Camelobaetidiusmexicanus (Traver& Edmunds, 1968). Zootaxa, 3796(3), 545–567.
Buss, D. F., Carlisle, D. M., Chon, T. S., Culp, J., Harding, J. S., Keizer-Vlek, H. E., Robinson, W., Stracham, S., Thirion, C., & Hughes, R. M. (2015). Stream biomonitoring using macroinvertebrates around the globe: a comparison of large-scale programs. Environmental monitoring and assessment, 187(1), 2–21.
Buss, D. F., & Salles, F. F. (2007). Using Baetidae species as biological indicators of environmental degradation in a Brazilian river basin. Environmental Monitoring and Assessment, 130(1–3), 365–372.
Carrie, R., Dobson, M., & Barlow, J. (2017). Challenges using extrapolated family-level macroinvertebrate metrics in moderately disturbed tropical streams: a case-study from Belize. Hydrobiologia, 794(1), 257–271.
Carter, J. L., Resh, V. H., & Hannaford, M. J. (2017). Macroinvertebrates as biotic indicators of environmental quality. En G. A. Lamberti & F. R. Hauer (Eds.).Methods in stream ecology (pp. 293-318). AcademicPress.
Charpentier, C.,&Tabash, F. (1988). Variaciones en la Diversidad de la Comunidad Bentónica del Sedimento. Un Indicador Biológico del Estado de Contaminación de los Ríos de la Subregión de Heredia, Costa Rica. Uniciencia, 5(1–2), 69–76.
Contraloría General de la República (2013). Informe acerca de la Eficacia del Estado para Garantizar la Calidad del Agua en sus Diferentes Usos. InformeNúmero. DFOE-AE-IF-01-2013.
Cooper, C. M. (1993). Biological effects of agriculturally derived surface water pollutants on aquatic systems-a review. Journal of Environmental Quality, 22(3), 402–408.
Cozzarolo, C. S., Balke, M., Buerki, S., Arrigo, N., Pitteloud, C., Gueuning, M., Salamin, N., Sartori,M.,& Alvarez, N. (2019). Biogeography and ecological diversification of a mayfly clade in New Guinea. Frontiers in Ecology and Evolution, 7, 1–15.
Craig, S. (1992). Biological indicators of pollution in the upper section of the Rio Segundo, Costa Rica. ACM Tropical Field Research Final Report. San Jose, Costa Rica. 54 p.
De Jong, G.D. & Canton, S.P. (2015). Mayflies (Insecta: Ephemeroptera) in Chiriquí Province, Republic of Panama, with a new distributional record for Camelobaetidiuskondratieffi Lugo-Ortiz &McCafferty, 1995 (Baetidae). Check List, 11 (4), 1674.
Davies, P. E.,& Nelson, M. (1994). Relationships between riparian buffer widths and the effects of logging on stream habitat, invertebrate community composition and fish abundance. Marine and FreshwaterResearch, 45(7), 1289–1305.
Decreto 33903-MINAE-S (2007). Reglamento para la Evaluación y Clasificación de la Calidad de Cuerpos de Agua Superficiales. La Gaceta nº 178. Poder Ejecutivo, Costa Rica.
Dedieu, N., Rhone, M., Vigouroux, R., &Céréghino, R. (2015). Assessing the impact of gold mining in headwater streams of Eastern Amazonia using Ephemeroptera assemblages and biological traits. Ecological Indicator, 52, 332-340.
Dijkstra, K. D. B., Monaghan, M. T., &Pauls, S. U. (2014). Freshwater biodiversity and aquatic insect diversification. AnnualReview of Entomology, 59, 143–163.
Echeverría-Sáenz, S., Pinnock, M., Arias, M., Mena,F., Solano, K., Rupert, C. (2011). Presencia de residuos de plaguicidas y calidad biológica del agua en el Río Jiménez, como representante de los ríos del Caribe de Costa Rica. https: //bit.ly/3c46g5m
Firmiano, K. R., Ligeiro, R., Macedo, D. R., Juen, L., Hughes, R. M., &Callisto, M. (2017). Mayfly bioindicator thresholds for several anthropogenic disturbances in neotropical savanna streams. EcologicalIndicators, 74, 276–284.
Flowers, R., Astorga-Espeleta, Y., Angulo-Gutiérrez, C., Herich, A., & Fernández, S. (1995). Índice biológico para la evaluación de calidad de agua de Centroamérica. In: Resúmenes, 2do. Congreso Centroamericano y del Caribe y 3ero. Costarricense de Entomología. San José, Costa Rica.
Flowers, R. W., & De la Rosa, C. (2010). Capítulo 4: Ephemeroptera. In M. Springer, A. Ramirez, P. Hanson (Eds.).Macroinvertebrados de agua dulce de Costa Rica. Revista de Biología Tropical, 58(suppl. 4), 63–93.
Fournier, M. L., Echeverría-Sáenz, S., Mena, F., Arias-Andrés, M., de la Cruz, E., &Ruepert, C. (2018). Risk assessment of agriculture impact on the Frío River watershed and Caño Negro Ramsar wetland, Costa Rica. Environmental Science and Pollution Research, 25(14), 13347–13359.
Frissell, C. A., Liss, W. J., Warren, C. E., & Hurley, M. D. (1986). A hierarchical framework for stream habitat classification: viewing streams in a watershed context. Environmental management, 10(2), 199–214.
Ganong, C. N., Small, G. E., Ardón, M., McDowell, W. H., Genereux, D. P., Duff, J. H., & Pringle, C. M. (2015). Interbasin flow of geothermally modified ground water stabilizes stream exports of biologically important solutes against variation in precipitation. FreshwaterScience, 34(1), 276–286.
García-Alzate, C. A., Villegas-Acosta, P. A., & Román-Valencia, C. (2017). Análisis Fisicoquímico y Biológico del río Santo Domingo, afluente río Verde, Cuenca del río La Vieja, Alto Cauca, Colombia. Boletín Científico. Centro de Museos. Museo de Historia Natural, 21(1), 31–51.
Gattolliat, J. L., & Nieto, C. (2009). The family Baetidae (Insecta: Ephemeroptera): synthesis and future challenges. AquaticInsects, 31(1), 41–62.
Giri, S., & Qiu, Z. (2016). Understanding the relationship of land uses and water quality in Twenty First Century: A review. Journal of environmental management, 173, 41–48.
Guevara-Mora, M. & Bonilla-Traña, M., (2017). Diagnóstico de la percepción social y la calidad del agua de los recursos hídricos superficiales asociados a las descargas de aguas servidas, Monteverde, Puntarenas. Informe Final.
Gutiérrez, C., & Reinoso-Flores, G. (2010). Géneros de ninfas del orden Ephemeroptera (Insecta) del departamento del Tolima, Colombia: listado preliminar. Biota Colombiana, 11(1–2), 23–32.
Gutiérrez, Y., & Dias, L. G. (2015). Ephemeroptera (Insecta) de Caldas-Colombia, claves taxonómicas para los géneros y notas sobre su distribución. PapéisAvulsos de Zoologia (São Paulo), 55(2), 13–46.
Hellawell, J. (1986). Biological Indicators of Freshwater pollution and Environmental Management. Elsevier Science Publishers Ltd.
Herman, M. R., &Nejadhashemi, A. P. (2015). A review of macroinvertebrate-and fish-based stream health indices. Ecohydrology & Hydrobiology, 15(2), 53–67.
Hubbard, R. K., Newton, G. L., & Hill, G. M. (2004). Water Quality and the Grazing Animal. Journal of animal science, 82(13), E255–E263.
Instituto Tecnológico de Costa Rica (2014). Atlas de Costa Rica. https: //repositoriotec.tec.ac.cr/handle/2238/6749?show=full
Jacobus, L.M., & McCafferty, W.P. (2005). A new species and new synonym in CamelobaetidiusDemoulin (Ephemeroptera: Baetidae). Journal of the Kansas Entomological Society, 78 (2), 153–157.
Klemas, V. (2014). Remote sensing of riparian and wetland buffers: an overview. Journal of coastal research, 30(5), 869–880.
Kitchin, P. L. (2005). Measuring the amount of statistical information in the EPT index. Environmetrics, 16(1), 51–59.
Kohlmann, B., Arroyo, A., Springer, M., & Vásquez, D. (2015). Agrorural Ecosystem Effects on the Macroinvertebrate Assemblages of a Tropical River. EnY-H. Lo, J. A., Blanco & S. Roy (Eds.).Biodiversity in Ecosystems-Linking Structure and Function pp. 299- 333. Intech Open.
Krishnaswamy, J., Halpin, P. N., & Richter, D. D. (2001). Dynamics of sediment discharge in relation to land-use and hydro-climatology in a humid tropical watershed in Costa Rica. Journal of Hydrology, 253(1–4), 91–109.
Kubendran, T., Selvakumar, C., Sidhu, A. K., Nair, A., & Krishnan, S. M. (2017). Baetidae (Ephemeroptera: Insecta) as Biological Indicators of Environmental Degradation in Tamiraparani and Vaigai River Basins of Southern Western Ghats, India. Int. J. Curr. Microbiol. App. Sci, 6(6), 558–572.
Lammert, M., & Allan, J. D. (1999). Assessing biotic integrity of streams: effects of scale in measuring the influence of land use/cover and habitat structure on fish and macroinvertebrates.Environmental Management, 23(2), 257–270.
Ley N°7575/1996, 13 de febrero, Ley Forestal. (1996). La Gaceta N° 72, del 14 de abril del 1996. http: //www.sinac.go.cr/ES/normativa/Leyes/Ley%20Forestal%20N%C2%BA%207575.pdf
Li, A., Wang, A., Liang, S., & Zhou, W. (2006). Eco-environmental vulnerability evaluation in mountainous region using remote sensing and GIS—a case study in the upper reaches of Minjiang River, China. Ecological Modelling, 192(1–2), 175–187.
Lugo-Ortiz, C. R., & McCafferty, W. P. (1995). Taxonomy of the North and Central American species of Camelobaetidius (Ephemeroptera: Baetidae). Entomological News, 106(4), 178–192.
Lugo-Ortiz, C.R. & McCafferty, W.P. (1996) New Central American and Mexican records of Ephemeroptera species. Entomological News, 107 (5), 303–310.
Mafla, M. (2005). Guía para evaluaciones ecológicas rápidas con indicadores biológicos en ríos de tamaño mediano, Talamanca, Costa Rica. Serie Técnica. Manual técnico / CATIE; número 61.
Malicky, H., &Chantaramongkol, P. (1993). The altitudinal distribution of Trichoptera species in Mae Klang catchment on Doi Inthanon, northern Thailand: stream zonation and cool-and warm-adapted groups. Revue d’HydrobiologieTropicale, 26, 279–291.
McCafferty, W. P. (2011a) Notable new North and Central American records of Ephemeroptera species. Transactions of the American Entomological Society, 137 (1&2), 1–11.
McCafferty, W. P. (2011b). New Mexican and Central American Ephemeroptera records, with first species checklists for Mexican states. Transactions of the American Entomological Society, 137(3 & 4), 317–327.
McCafferty, W. P., & Randolph, R. P. (2000). Further contributions to the spatulate clawed Baetidae (Ephemeroptera). Entomological News, 111(4), 259–264.
McCafferty, W. P., & Waltz, R. D. (1990). Revisionary synopsis of the Baetidae (Ephemeroptera) of North and Middle America. Transactions of the American Entomological Society, 116(4), 769–799.
McCafferty, W. P., Baumgardner, D.E. & Guenther, J.L. (2004) The Ephemeroptera of Central America. Part 1: Guatemala. Transactions of the American Entomological Society, 130, 201–219.
McGrane, S. J. (2016). Impacts of urbanisation on hydrological and water quality dynamics, and urban water management: a review. HydrologicalSciencesJournal, 61(13), 2295–2311.
Mena-Rivera, L., Salgado-Silva, V., Benavides-Benavides, C., Coto-Campos, J., &Swinscoe, T. (2017). Spatial and seasonal surface water quality assessment in a tropical urban catchment: Burío River, Costa Rica. Water, 9(8), 1–12.
Mena-Rivera, L., Vásquez-Bolaños, O., Gómez-Castro, C., Fonseca-Sánchez, A., Rodríguez-Rodríguez, A., & Sánchez-Gutiérrez, R. (2018). Ecosystemic Assessment of Surface Water Quality in the Virilla River: Towards Sanitation Processes in Costa Rica. Water, 10(7), 1–16.
Meyer, M.D., Baumgardner, D.E. & McCafferty, W. P. (2008) The Ephemeroptera of Central America. Part 2: Nicaragua. Transactions of the American EntomologicalSociety, 134 (1), 133–146.
Municipalidad de Belén & Universidad Nacional (2013). Informe de Calidad de las Aguas Superficiales. https: //bit.ly/3n5Hlof
Municipalidad de Curridabat (2015). Evaluación Biológica de la Calidad del Agua en la Micro Cuenca del Ríos María Aguilar, cantón de Curridabat. Dirección de Servicios Ambientales, San José, Costa Rica.
Nava-López, M. Z., Diemont, S. A., Hall, M., & Ávila-Akerberg, V. (2016). Riparian buffer zone and whole watershed influences on river water Quality: implications for ecosystem services near megacities. EnvironmentalProcesses, 3(2), 277–305.
Nieto, C. (2003). El género Camelobaetidius (Ephemeroptera: Baetidae) en la Argentina. Acta zoológica mexicana, (88), 233–255.
Oksanen, J., Blanchet, G., Friendly, M., Kindt, R., Legendre, P., McGlinn, D., Minchin, P., O'Hara, P., Simpson, G., Solymos, P., Henry, M., Stevens, H., EduardSzoecs E., & Wagner H. (2019). vegan: CommunityEcologyPackage. R packageversion 2.5-6. https: //CRAN.R-project.org/package=vegan
Padowski, J. C., Gorelick, S. M., Thompson, B. H., Rozelle, S., &Fendorf, S. (2015). Assessment of human–natural system characteristics influencing global freshwater supply vulnerability. EnvironmentalResearchLetters, 10(10), 104014.https: //doi: 10.1088/1748-9326/10/10/104014
Peinador, M. (2004). Relación entre los macroinvertebrados bénticos y la calidad del agua en ríos de Costa Rica. Revista Evolución, 2(2), 1–22.
Pérez-Rubio, I., &Mende, A. (2018). Análisis espacial de susceptibilidad de erosión en una cuenca hidrográfica del trópico húmedo de Costa Rica. Revista de Ciencias Ambientales, 52(1), 1–26.
Pillasagua, J. (2018). Macroinvertebrados acuáticos como indicadores de calidad hídrica en usos de suelo bosque, urbano y agrícola en el río San Pablo, cantón La Mana, Ecuador. [Tesis pregrado, Universidad Técnica Estatal de Quevedo].
Polato, N. R., Gill, B. A., Shah, A. A., Gray, M. M., Casner, K. L., Barthelet, A., Messer, P., Simmons, M., Guayasamin, J., Encalada, A., Kondratieff, B. C., Flecker, A., Thomas, S., Ghalambor, C., Poff, N., Funk, & W., Zamudio, K. (2018). Narrow thermal tolerance and low dispersal drive higher speciation in tropical mountains. Proceedings of the National Academy of Sciences, 115(49), 12471–12476.
Ramírez, A., & Gutiérrez-Fonseca, P. E. (2014). Estudios sobre macroinvertebrados acuáticos en América Latina: avances recientes y direcciones futuras. Revista de Biología Tropical, 62, 9–20.
Ramírez, Y. P., Giraldo, L. P., Zúñiga, M. D. C., Ramos, B. C., &Chará, J. (2018). Influencia de la Ganadería en los Macroinvertebrados Acuáticos en Microcuencas de los Andes Centrales de Colombia. Revista de Biología Tropical,66(3), 1244–1257.
Randolph, R. P. &McCafferty, W.P. (2001). New species and records of Ephemeroptera (Insecta) from central Mexico. Dugesiana, 8, 15–21.
R Core Team (2019) R: A language and environment for statistical computing. R FoundationforStatistical Computing, Vienna, Austria. https: //www.R-project.org/
Reglamento a la Ley Forestal 25721 (1997). Asamblea Legislativa de la República de Costa Rica. San José, Costa Rica.
Ríos, T., González, G., & Vega, J. A. B. (2015). Diversidad de insectos acuáticos y calidad del agua de los ríos David y Mula, provincia de Chiriquí, Panamá. Gestión y Ambiente, 18(1), 113–128.
Rojas, J. (2018). Contaminación por metales en aguas, sedimentos y macroinvertebrados bentónicos de los ríos San José y Cañas, generados por las lamas de la antigua mina La Esperanza, Líbano de Tilarán, Guanacaste, Costa Rica. [Tesis de Maestría, Universidad Nacional Autónoma de Nicaragua]. https: //repositorio.unan.edu.ni/10883/
Roldán-Pérez, G. (2016). Los macroinvertebrados como bioindicadores de la calidad del agua: cuatro décadas de desarrollo en Colombia y Latinoamérica. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 40(155), 254–274.
Rosales, A. (2016). Leyenda CLC-CR para la generación de uso/cobertura de la tierra de Costa Rica (Leyenda CorineLandCover versión Costa Rica v 1.0) San José, CR: MAG/INTA, pp. 104.
Roy, A., H., Rosemond, A., D., Paul, M., J., Leigh, D., S., Wallace, J., B. (2003).Stream macroinvertebrate response to catchment urbanization (Georgia, USA). FreshwaterBiology, 48, 329–346.
Rúa, G., Tamaris, C., &Zúñiga, M. D. C. (2015). Composición y distribución de los órdenes Ephemeroptera, Plecoptera y Trichoptera (Insecta) en ríos de la Sierra Nevada de Santa Marta, Colombia. Revista de Ciencias, 19(2), 11–29.
Salles, F. F., &Serrão, J. E. (2005). The nymphs of the genus CamelobaetidiusDemoulin (Ephemeroptera: Baetidae) in Brazil: new species, new records, and key for the identification. Ann. Limnol. - Int. J. Lim. 2005, 41 (4), 267–279.
Setegn, S. G., &Donoso, M. C. (2015). Sustainability of Integrated Water Resources Management. Springer InternationalPublishing.
Salles F.F., Boldrini R., Nascimento JMC., Angeli, KB., Massariol, FC., Raimundi E. (2016). Lista das espécies. Ephemeroptera da América do Sul. http: //ephemeroptera.com.br/lista/
Shah, A. A., Funk, W. C., &Ghalambor, C. K. (2017). Thermal acclimation ability varies in temperate and tropical aquatic insects from different elevations. Integrative and comparative biology, 57(5), 977–987.
Sibaja-Araya, F., & Esquivel, C. (2018). Camelobaetidiusguaycara, a new species of Baetidae (Ephemeroptera) from Costa Rica, Central America. Zootaxa, 4434(1), 89–98.
Sibaja-Araya, F. (2020). Evaluación del género CamelobaetidiusDemoulin, 1966 (Ephemeroptera: Baetidae) como indicador para el monitoreo de quebradas y ríos en Costa Rica. [Tesis de Licenciatura, Universidad Nacional de Costa Rica]. https: //repositorio.una.ac.cr/handle/11056/18839
Sommaggio, D., &Burgio, G. (2014). The use of Syrphidae as functional bioindicator to compare vineyards with different managements. Bulletin of Insectology, 67(1), 147–156.
Spellman, 2010. Pollution: What Is It?. In F. Spellman (Ed.). Science of Enviromental Pollutionpp 1-8. CRC Press, Taylor & Francis Group.
Springer, M. (2010). Capítulo 3: Biomonitoreo acuático. Revista de Biología Tropical, 58, 53–59.
Stathatou, P. Μ., Kampragou, E., Grigoropoulou, H., Assimacopoulos, D., Karavitis, C., Porto, M. F. A., Gironás, J., Vanegas, M., & Reyna, S. (2016). Vulnerability of water systems: a comprehensive framework for its assessment and identification of adaptation strategies. Desalination and Water Treatment, 57(5), 2243–2255.
Sweeney, B. W., & Newbold, J. D. (2014). Streamside forest buffer width needed to protect stream water quality, habitat, and organisms: a literature review. JAWRA Journal of the American Water Resources Association, 50(3), 560–584.
Traver, J. R. & Edmunds, G., F. (1968). A Revision of the Baetidae with Spatulated-Clawed Nymphs. PacificInsects, 10(3-4), 629–677.
Valverde, N., Caicedo, O., & Aguirre, N. (2009). Análisis de calidad de agua de la quebrada La Ayurá, con base en variables fisicoquímicas y macroinvertebrados acuáticos. Revista Producción + Limpia, 4(1), 40–60.
Varela, I. (2007). Estudio de la Gestión municipal del agua: enfoque de “gestión de la demanda del agua” en Costa Rica y en países con mayor grado de gestión del recurso hídrico. Centro de Investigación en Protección Ambiental, Instituto Tecnológico de Costa Rica, Costa Rica. https: //repositoriotec.tec.ac.cr/bitstream/handle/2238/721/Anexo_3.pdf?sequence=2&isAllowed=y
Villada-Bedoya, S., Bautista, F. O., Dias, L. G., & Varón, J. V. E. (2017). Diversidad de insectos acuáticos en quebradas impactadas por agricultura y minería, Caldas, Colombia. Revista de Biología Tropical, 65(4), 1635–1659.
Watts, C., Stringer, I., Innes, J., & Monks, J. M. (2017). Evaluating tree wētā (Orthoptera: Anostostomatidae: Hemideina species) as bioindicators for New Zealand national biodiversity monitoring. Journal of insect conservation, 21(4), 583–598.
Widyastuti, W., &Suprayogi, S. (2016). Contamination Vulnerability Analysis of Watershed for Water Quality Monitoring. Forum Geografi, 20(1), 47–54.
Wiersema, N.A. (1998). Camelobaetidiusvariabilis (Ephemeroptera: Baetidae), a new species from Texas, Oklahoma and Mexico. Entomological News, 109, 21–26.
Wiersema, N. A., & Baumgardner, D. E. (2000). Distribución y contribuciones taxonómicas para la fauna de Ephemeroptera México y Centroamérica. Entomological News. 111(1), 60–66.