
Patrones de actividad circadiana y lunar del jaguar y el puma en relación con sus presas y competidoras (Carnivora: Felidae)
Michael S. Mooring1,2![]() & Amy A. Eppert1,2
& Amy A. Eppert1,2![]()
1. Point Loma Nazarene University, Departamento de Biología, 3900 Lomaland Drive, San Diego, CA 92106 Estados Unidos; mmooring@pointloma.edu, amyeppert@gmail.com
2. Centro Quetzal de Educación e Investigación, 200 metros al norte del hotel Savegre, San Gerardo de Dota, Costa Rica.
Recibido 14-X-2021 Corregido 22-X-2021 Aceptado 25-X-2021
DOI: https://doi.org/10.22458/urj.v14iS1.3858
|
ABSTRACT. “Circadian and lunar patterns of Jaguar and Puma in relation to their prey and competitors”. Introduction: Temporal niche changes can shape predator-prey interactions by allowing prey to evade predators, improve feeding efficiency, and reduce competition among predators. In addition to circadian activity patterns, the monthly lunar cycle can influence the nocturnal activity of mammals. Objective: Through camera trap surveys at sites on the Pacific slope and the Talamanca Cordillera, we investigated the patterns of circadian (day and night) and nocturnal activity during the moon phases of the jaguar (Panthera onca) and puma (Puma concolor). Methods: We investigated the overlap and temporal segregation between pairs of each predator and its primary prey, and between its competitors using overlap analysis, circular statistics, and relative abundance, taking into account differences in habitat, seasons, and human impact between sites. Results: Our results supported the existence of a temporal niche separation between the two predator species, although both were classified as cathemeral - the jaguar was mainly diurnal, while the puma was mainly nocturnal. We found that the jaguar and puma practice different patterns of nocturnal activity during the phases of the moon, with the jaguar exhibiting a dramatic increase in activity during the full moon and the puma maintaining a more consistent level of activity throughout the moon phases. However, during the full moon, both species were more active at night and less active during the day, suggesting that they practice a temporary niche change to take advantage of hunting activities during the brightest lunar illumination of each month. We discuss predicted primary prey and competing species. Conclusion: We conclude that jaguar and puma exhibit significant niche separation in circadian and lunar activity patterns. Through these differences in temporal activity, jaguar and puma can exploit a slightly different prey base despite their similar large size.
Keywords: Activity patterns, predator-prey, temporal niche change, circadian, moon phases.
|
RESUMEN. Introducción: Los cambios temporales de nicho pueden amoldar las interacciones predador-presa al permitir a la presa evadir los predadores, mejorar la eficacia de la alimentación y reducir la competición entre predadores. Además de los patrones de actividad circadianos, el ciclo lunar mensual puede influye en los patrones de actividad nocturna de los mamíferos. Objetivo: Mediante muestreos con cámaras trampa en sitios de la pendiente del Pacífico y la Cordillera de Talamanca, investigamos los patrones de actividad circadiana (día y noche) y nocturna durante las fases de la luna del jaguar (Panthera onca) y puma (Puma concolor). Métodos: Investigamos la superposición y segregación temporal entre pares de cada predador y sus presas primarias, y entre sus competidores utilizando análisis de superposición, estadísticas circulares y abundancia relativa, teniendo en cuenta diferencias de hábitat, estaciones, y de impacto humano entre los sitios. Resultados: Nuestros resultados respaldaron la existencia de una separación temporal de nicho entre las dos especies de predadores, aunque ambos fueron clasificados como catemerales, el jaguar era principalmente diurno, mientras que el puma era principalmente nocturno. Descubrimos que el jaguar y el puma practican distintos patrones de actividad nocturna durante las fases de la luna, con el jaguar exhibiendo un aumento dramático en la actividad durante la luna llena y el puma manteniendo un nivel de actividad más consistente a través de las fases lunares. Sin embargo, durante la luna llena, ambas especies fueron más activas durante la noche y menos activas durante el día, lo que sugiere que practican un cambio de nicho temporal para aprovechar las actividades de caza durante la iluminación lunar más brillante de cada mes. Discutimos las presas primarias predichas y las especies competidoras. Conclusión: Concluimos que el jaguar y el puma exhiben una separación de nicho significativa en actividad circadiana y lunar. A través de estos distintos patrones de actividad temporal, el jaguar y el puma pueden explotar una base de presas ligeramente diferente a pesar de su tamaño similar.
Palabras clave: Patrones de actividad, depredador-presa, cambio de nicho temporal, circadiano, fases lunares.
|
Los patrones de actividad de los mamíferos han evolucionado para optimizar el momento de las decisiones de comportamiento. Los cambios de nicho temporal se refieren a cómo las especies cronometran sus patrones de actividad para coexistir con otras especies, por ejemplo, reduciendo la competencia, mejorando el éxito de la alimentación o evitando la depredación. La teoría de la búsqueda de alimento óptima predice que los animales se alimentan para maximizar la ingesta neta de energía menos los costos (MacArthur & Pianka, 1966), pero los gremios de depredadores de carnívoros de tamaño similar son oportunistas y a menudo se alimentan de la misma especie (Foster et al., 2013), que debería conducir a la exclusión competitiva si no fuera por la partición de nicho espacial o temporal (Valeix et al., 2007). Por lo tanto, la competencia interespecífica puede seleccionar la partición de nichos para evitar la competencia de interferencia y mejorar la eficiencia de la caza a través de un forrajeo óptimo (Cozzi et al., 2012).
En este estudio, investigamos la partición del nicho temporal entre los dos depredadores neotropicales más grandes, el jaguar (Panthera onca) y el puma (Puma concolor), con base en encuestas con cámaras trampa realizadas en múltiples sitios en Costa Rica durante un período de 10 años utilizando una comunidad y un enfoque de seguimiento basado. Según la similitud morfológica y del tamaño corporal (jaguar = 80 kg; puma = 50 kg), estos dos depredadores tienen el mayor potencial de interacciones competitivas y pueden considerarse los competidores más fuertes entre sí. Predijimos que el jaguar y el puma exhibirían segregación temporal para minimizar la competencia (Di Bitetti et al., 2010; Herrera et al., 2018).
MATERIALES Y MÉTODOS
Área de estudio: Realizamos encuestas con cámaras trampa en 12 sitios en las montañas de la Cordillera de Talamanca o bosques de tierras bajas en las tierras bajas del Pacífico desde junio de 2010 hasta agosto de 2019 en colaboración con funcionarios del parque nacional y voluntarios de la comunidad local en parques nacionales, reservas privadas y áreas biológicas. Estas áreas van desde bosque primario en áreas protegidas hasta un mosaico de fragmentos de bosque primario y secundario en corredores biológicos. Los sitios de tierras bajas (Corredor Biológico Alexander Skutch, Corredor Biológico Bosque de Agua, Parque Nacional Cabo Blanco, Proyecto Campanario, Refugio Nacional de Vida Silvestre La Marta y Santuario de Aves Los Cusingos) se encuentran en bosque lluvioso ubicado de 28m hasta 1 000m sobre el nivel del mar. Los sitios de las tierras altas (Parque Nacional Chirripó, Parque Internacional La Amistad, Parque Nacional Los Quetzales, Parque Nacional Tapantí Macizo de la Muerte y la Reserva de Hotel Savegre en la parte alta del Valle del Río Savegre) son densos bosques tropicales montanos que van desde 2 000m hasta 3 464m de elevación. El Refugio La Marta y la Reserva El Copal se encuentran dentro del rango de altitud media de 1 000m-2 000m. No se produjeron cambios importantes en el estado de protección o impactos ambientales durante el estudio.
Cámaras de trampa: Las unidades Bushnell Trophy Cam se desplegaron como unidades individuales o emparejadas a intervalos de 1 a 2km, principalmente a lo largo de los sistemas de senderos establecidos y caminos de acceso dentro de las áreas protegidas. A partir de 2012, todas las estaciones de cámaras tenían estaciones de aroma dentro del campo de visión para estimular a los animales que pasaban a reducir la velocidad e investigar el nuevo aroma. Debido a que el flash infrarrojo produce menos luz en comparación con el flash blanco, las estaciones de aroma fueron beneficiosas para maximizar la calidad de la foto al minimizar la borrosidad de las fotos nocturnas.
Análisis de los datos: Los registros fotográficos se cargaron en el software de gestión de datos Camera Base 1.7 (Tobler, 2015) y todos los análisis se realizaron en el lenguaje de programación R (R Core Team, 2019). Los registros fotográficos se consideraron independientes si las fotos de una especie determinada en una estación de cámara en particular estaban separadas por al menos 30 minutos, que es un estándar comúnmente utilizado (Ridout & Linkie 2009; Si et al., 2014; Van Berkel 2014; Anile & Devillard 2016; Sollmann, 2018). Los índices de abundancia relativa (IAR) se calcularon para cada especie de todos los sitios de estudio utilizando la ecuación: IAR = (tamaño de la muestra) / (días que la cámara estuvo activa) * 1 000.
Para caracterizar los patrones de actividad circadianos, ajustamos el tiempo circadiano en radianes para tener en cuenta los cambios sucesivos de la posición del sol a lo largo del año (Nouvellet et al., 2012) utilizando la función 'sunTime' de 'Overlap' versión 0.3.2 (Meredith & Ridout, 2018a; b). Los registros entre el amanecer y el atardecer se clasificaron como diurnos, mientras que los registros entre el atardecer y el amanecer se consideraron nocturnos. La actividad lunar se caracterizó utilizando la función "getMoonIllumination" del paquete suncalc (Agafonkin & Thieurmel, 2019) para obtener la fase lunar de cada observación en función de su fecha. La fase lunar se escaló en radianes de modo que 0 corresponde a Luna Nueva, p/2 como Primer Cuarto, p como Luna Llena y 3p/2 como Segundo Cuarto. Una herramienta interactiva para explorar estos análisis está disponible en línea como una aplicación web R Shiny
(https://ticomammals.shinyapps.io/ActivityBudgets/).
Para determinar la superposición de los patrones de actividad entre el jaguar y el puma, se utilizó el paquete "Overlap" versión 0.3.2 (Meredith & Ridout, 2018a; b) siguiendo el método de dos pasos desarrollado por Ridout y Linkie (2009). Primero, los patrones de actividad de la fase circadiana o lunar se determinaron utilizando una densidad de kernel con un ancho de banda estándar de 1 y un ajuste de ancho de banda de 0.8 para tamaños de muestra grandes (n > 75), o con una distribución de suma trigonométrica no negativa para muestras pequeñas tamaños (20 ≤ n ≤ 75) (Ridout & Linkie, 2009).
A continuación, se calculó el coeficiente de superposición (Δ) utilizando la medida Δ1 para tamaños de muestra pequeños o Δ4 para tamaños de muestra grandes (Ridout y Linkie, 2009). Los valores de Δ caen entre 0 (sin superposición) y 1 (superposición completa) y representan el área compartida bajo dos curvas de densidad. El tamaño mínimo de la muestra se estableció en 20 observaciones independientes para minimizar la sobreestimación de Δ (Lynam et al., 2013; Rowcliffe et al., 2014; Tan et al., 2018). También, comparamos la actividad circadiana entre el jaguar y el puma con sus especies de presa primarias, usando las 16 especies de presa en nuestros registros.
Para este estudio, Δ se utilizó para evaluar la posible divergencia de los patrones de actividad temporal entre el jaguar y el puma se realizó la prueba exacta de Fisher para evaluar la importancia de la divergencia. Las observaciones de cada especie se agruparon por tiempo en 12 contenedores correspondientes a intervalos de dos horas cada uno y se ejecutó la prueba exacta de Fisher con una simulación de Monte Carlo de 1 000 repeticiones (Upton, 1992). Todo el código R utilizado en este análisis está disponible en línea en Github (https://github.com/rbotts/Melanism).
RESULTADOS
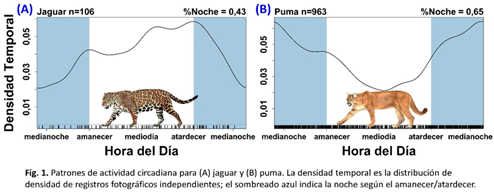
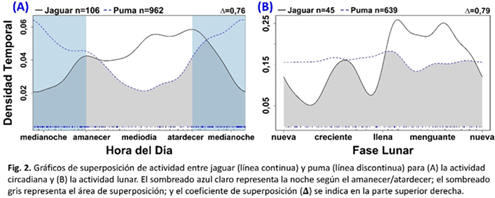
Patrones de actividad circadiana: Nuestros datos mostraron que el jaguar y el puma, aunque ambos eran catemerales, dividiendo sus actividades entre el día y la noche, el jaguar era significativamente más diurno que el puma (actividad diurna 57% versus 35%; Fig. 1). Jaguar y puma tenían un coeficiente de superposición modesto (Δ = 0,76) y patrones de actividad significativamente diferentes (P <0,05) según la prueba exacta de Fisher (Fig. 2A). Las presas con mayor superposición con el jaguar fueron el cabro de monte (Mazama temama), el venado cola blanca (Odocoileus virginianus), y el saíno (Pecari tajacu), mientras que la paca (Cuniculus paca) y el saíno se superpusieron más con el puma.
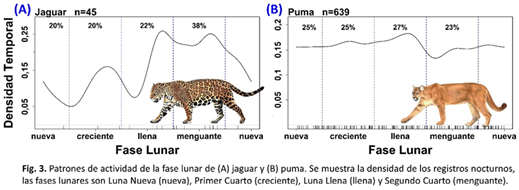
Patrones de actividad lunar: Examinamos los patrones de actividad lunar del jaguar y el puma. Puma exhibió un nivel de actividad bastante uniforme en las cuatro fases lunares, mientras que el jaguar tuvo un patrón de actividad irregular (Fig. 3). La actividad lunar del jaguar tuvo un pico marcado en la actividad durante la segunda mitad de la luna llena en el segundo cuarto, y la actividad más baja durante la segunda mitad de la luna nueva en el primeo cuarto. Jaguar y puma tenían un coeficiente de superposición modesto (Δ = 0,79) y patrones de actividad lunares significativamente diferentes (P <0,02) según la prueba exacta de Fisher (Fig. 2B). Puma, cuyo nivel de actividad se mantuvo bastante constante a lo largo de las fases lunares, no parecía estar rastreando ninguna especie de presa en particular ni evitando a ningún competidor en particular.
DISCUSIÓN
Casi todos los organismos vivos tienen la capacidad de anticipar y adaptarse a los cambios ambientales asociados con los ciclos periódicos como el día circadiano o el mes lunar (Krittika & Yadav, 2019). Predijimos que los competidores intragremiales morfológicamente similares exhibirían una mayor segregación temporal, superponiéndose menos en sus patrones de actividad que los pares de diferente tamaño. En nuestros estudios, el jaguar y el puma mostraron una superposición modesta (Δ = 0,76) con patrones de actividad significativamente diferentes. Los jaguares eran más activos durante el día mientras que los pumas eran más activos durante la noche, pero los jaguares eran más activos durante la noche durante la luna llena que los pumas. Concluimos que el jaguar y el puma exhiben una separación de nicho significativa en los patrones de actividad circadiana y lunar. A través de estos distintos patrones de actividad temporal, el jaguar y el puma pueden explotar una base de presas ligeramente diferente.
En otras partes de Costa Rica, el jaguar y el puma también tienen patrones de actividad catemeral (Herrera et al., 2018), pero se superponen entre un 75% y un 80% aunque cazan muchas de las mismas presas (Herrera et al., 2018; Días et al., 2018). También encontraron que el puma en Brasil exhibía un patrón de actividad catéter como el que observamos. Los pumas y los jaguares son más propensos a competir por la comida porque tienen tamaños corporales similares (Santos et al., 2019) y parecen exhibir una distribución dietética. Se cree que los jaguares se alimentan principalmente de ungulados y presas más grandes > 2kg, mientras que los pumas seleccionan una gama más amplia de presas de tamaño mediano (Scognamillo et al., 2003; Di Bitetti et al., 2010).
Además, de Oliveira (2002) revisó 23 estudios dietéticos de jaguares y pumas, de los cuales ocho estudios involucraron poblaciones simpátricas en cinco países neotropicales. Aunque el uso de presas fue extremadamente variable, las tendencias fueron consistentes con la segregación dietética para minimizar la competencia en las poblaciones simpátricas. El peso medio de la presa se correlacionó positivamente con el tamaño corporal del depredador: los jaguares consumían más mamíferos de tamaño mediano (1-15kg) y mamíferos de tamaño grande (> 15kg), mientras que el puma se alimentaba principalmente de mamíferos de tamaño mediano. El saíno y el venado fueron las especies de presa preferidas del jaguar, y estas presas se encuentran en la dieta del jaguar en cada área de estudio y principalmente como la presa principal (de Oliveira, 2002). A través de estos distintos patrones de actividad temporal, concluimos que el jaguar y el puma pueden explotar una base de presas ligeramente diferente.
Basado en las distintas diferencias en los patrones de actividad del jaguar y el puma durante las 24 horas del día y durante la noche a lo largo de las fases de la luna, además de la evidencia de la literatura de que estos depredadores tienden a seleccionar presas de tamaños y especies diferentes, es razonable suponer que el jaguar y el puma en Costa Rica practican tanto la segregación temporal como la selección de presas para minimizar el nivel de competencia entre estos depredadores superiores.
AGRADECIMIENTOS
Agradecemos a los 26 estudiantes de Point Loma Nazarene University quien participaron en la Encuesta de Mamíferos Grandes del Cordillera Talamanca. El apoyo del Centro Quetzal de Educación e Investigación (QERC), y de don Efraín Chacón Ureña y la familia Chacón ha sido esencial y estamos agradecidos con la entusiasta ayuda. Agradecemos a nuestros colaboradores de investigación que monitorean las encuestas de cámaras trampas: Arsenio Aguerro y Óscar Masis Chávez (Parque Nacional Los Quetzales), Leonel Delgado (PN La Cangreja, PN Tapantí), Roger González y Junior Porras (Parque Internacional La Amistad), Enzo Vargas (PN Chirripó), Mahyar Shirazinia, Fabricio Carbonell, y Adrián Ugalde (PN Tapantí), Adrian Arce (PN Carara), Andrés Jiménez y Yaudy Alvarado (PN Cabo Blanco). Por el apoyo administrativo de SINAC, agradecemos a Marisol Rodríguez (ACLAP) y Lourdes Vargas.
atribución de la publicación fuente
UNED Research Journal únicamente publica artículos originales, sin embargo, en este caso se ha hecho una excepción por encontrarse dentro de un suplemento y por tratarse de una adaptación traducida, de innegable utilidad en la América Latina. Los datos y análisis resumidos en este artículo se publicaron originalmente en inglés, y se reproducen con autorización de las siguientes publicaciones:
Botts, R. T., Eppert, A. A., Wiegman, T. J., Blankenship, S. R., Rodriguez, A., Wagner, A. P., Ullrich, S. E., Allen, G. R., Garley, W. M., Asselin, E. M., & Mooring, M. S. (2020). Does moonlight increase predation risk for elusive mammals in Costa Rica? Tropical Conservation Science, 13, 1–21. DOI: 10.1177/1940082920952405
Artículo publicado por primera vez en línea por SAGE Journals el 9 de septiembre de 2020.
https://journals.sagepub.com/doi/full/10.1177/1940082920952405
Botts, R. T., Eppert, A. A., Wiegman, T.J., Rodriguez, A., Blankenship, S. R., Asselin, E. M., Garley, W. M., Wagner, A. P., Ullrich, S. E., Allen, G. R., & Mooring, M. S. (2020). Circadian activity patterns of mammalian predators and prey in Costa Rica. Journal of Mammalogy, 101, 1313–1331. DOI:10.1093/jmammal/gyaa103
Artículo publicado por primera vez por Oxford University Press el 3 de octubre de 2020.
https://academic.oup.com/jmammal/article/101/5/1313/5917598
ÉTICA, CONFLICTO DE INTERESES Y DECLARACIÓN DE FINANCIAMIENTO
Declaramos haber cumplido con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en la preparación de este documento, y que no hay conflictos de interés de ningún tipo. La declaración de contribución de cada autor: A.A.E.: análisis de datos en el software R, elaboración de fotogramas, preparación del manuscrito; M.S.M.: diseño del estudio e interpretación de análisis, preparación y aprobación final del manuscrito.
REFERENCIAS
Agafonkin, V., & Thieurmel, B. (2019). Suncalc: Compute sun position, sunlight phases, moon position and lunar phase (R package version 0.4).
Anile, S., & Devillard, S. (2016). Study design and body mass influence RAIs from camera trap studies: evidence from the Felidae. Animal Conservation, 19, 35–45. https://doi.org/10. 1111/acv.12214
Cozzi, G., Broekhuis, F., McNutt, J.W., Turnbull, L.A., MacDonald, D.W., & Schmid, B. (2012). Fear of the dark or dinner by moonlight? Reduced temporal partitioning among Africa’s large carnivores. Ecology, 93(12), 2590–2599. https://doi.org/10.1890/12-0017.1
de Oliveira, T. G. (2002). Comparative feeding ecology of jaguar and puma in the Neotropics. In R. A. Medellín, C. Equihua, C. L. Chetkiewicz, P. G. Crawshaw Jr., A. Rabinowitz, K. H. Redford, J. G. Robinson, E. W. Sanderson, & A. Taber, (Eds). El jaguar en el nuevo milenio (pp. 265-288). Fondo de Cultura Económica.
Días, D. M., Campos, C.B., & Rodriguez, F.H.G. (2018). Behavioural ecology in a predator-prey system. Mammalian Biology, 92, 30–36. https://doi.org/10.1016/j.mambio.2018.04.005
Di Bitetti, M. S., De Ángelo, C.D., Di Blanco, Y.E., & Paviolo, A. (2010). Niche partitioning and species coexistence in a Neotropical felid assemblage. Acta Oecologia, 36(4), 403–412. https://doi.org/10.1016/j.actao.2010.04.001
Foster, V. C., Sarmento, P., Sollmann, R., Tôrres, N., Jácomo, A.T.A., Negrões, N., Fonseca, C., & Silveira, L. (2013). Jaguar and puma activity patterns and predator-prey interactions in four Brazilian biomes. Biotropica, 45(3), 373–379. https://doi.org/10.1111/btp.12021
Herrera, H., Chávez, E.J., Alfaro, L.D., Fuller, T., Montalvo, V., Rodrigues, F., Carrillo, E. (2018). Time partitioning among jaguar Panthera onca, puma Puma concolor and ocelot Leopardus pardalis (Carnivora: Felidae) in Costa Rica’s dry and rainforests. Revista de Biología Tropical, 66(4), 1575–1584. https://doi.org/10.15517/rbt.v66i4.32895
Krittika, S., & Yadav, P. (2019). Circadian clocks: An overview on its adaptive significance. Biological Rhythm Research, 51(7), 1–24. https://doi.org/10.1080/09291016.2019.1581480
Lynam, A. J., Jenks, K. E., Tantipisanuh, N., Chutipong, W., Ngoprasert, D., Gale, G. A., Steinmetz, R., Sukmasuang, R., Bhumpakphan, N., Grassman, L. I., Cutter, P., Kitamura, S., Reed, D. H., Baker, M. C., McShea, W., Songsasen, N., Leimgruber, P. (2013). Terrestrial activity patterns of wild cats from camera-trapping. The Raffles Bulletin of Zoology, 61(1), 407-415.
MacArthur, R. H., & Pianka, E.R. (1966). On optimal use of a patchy environment. The American Naturalist, 100, 603–609. https://doi.org/10.1086/282454
Meredith, M., & Ridout, M. (2018a). Overlap: Estimates of coefficient of overlapping for animal activity patterns. R package version 0.3.2. https://cran.r-project.org/web/packages/overlap/overlap.pdf
Meredith, M., & Ridout, M. (2018b). Overview of the overlap package. https://cran.r-project.org/web/packages/overlap/vignettes/overlap.pdf
Nouvellet, P., Rasmussen, G. S. A., Macdonald, D. W., & Courchamp, F. (2012). Noisy clocks and silent sunrises: measurement methods of daily activity pattern. Journal of Zoology, 286(3), 179–184. https://doi.org/10.1111/j.1469-7998.2011.00864.x
R Core Team (2019). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna. https://www.R-project.org
Ridout, M. S., & Linkie, M. (2009). Estimating overlap of daily activity patterns from camera trap data. Journal of Agricultural Biological and Environmental Statistics, 14, 322-337. https://doi.org/10.1198/jabes.2009.08038
Rowcliffe, J. M., Kays, R., Kranstauber, B., Carbone, C., & Jansen, P. A. (2014). Quantifying levels of animal activity using camera trap data. Methods in Ecology and Evolution, 5, 1170-1179. https://doi.org/10.1111/2041-210X.12278.
Santos, F., Carbone, C., Wearn, O.R., Rowcliffe, J.M., Espinosa, S., Lima, M.G.M., Ahuma, J.A., Sousa, A.L., Trevelin, L., Alvarez-Loayza, P., Spironello, W., Jansen, P., Juen, L., Peres, C.A. (2019). Prey availability and temporal partitioning modulate felid coexistence in Neotropical forests. PLoS ONE, 14(3): e0213671. https://doi.org/10.1371/journal.pone.0213671
Scognamillo, D., Maxit, I.E., Sunquist, M., & Polisar, J. (2003). Coexistence of jaguar (Panthera onca) and puma (Puma concolor) in a mosaic landscape in the Venezuelan llanos. Journal of Zoology, 259(3), 269–279. https://doi.org/10.1017/S0952836902003230
Si, X., Kays, R., & Ding, P. (2014). How long is enough to detect terrestrial animals? Estimating the minimum trapping effort on camera traps. PeerJ, 2, e374. https://doi.org/10. 7717/peerj.374
Sollmann, R. (2018). A gentle introduction to camera‐trap data analysis. African Journal of Ecology, 56(4), 740–749. https://doi.org/10.1111/aje.12557
Tan, W.S., Hamzah, N.B.A., Saaban, S., Zawakhir, N.A., Rao, Y., Jamaluddin, N., Cheong, F., Khalid, N.B., Mohd Saat, N.L., Zaidee Ee, E.N.B., Hamdan, A.B., Chow, M.M., Low, C.P., Voon, M., Liang, S.H., Tyson, M., Gumal, M. (2018). Observations of occurrence and daily activity patterns of ungulates in the Endau Rompin Landscape, Peninsular Malaysia. Journal of Threatened Taxa, 10, 11245–11253. https://doi.org/10.11609/jott.3519.10.2.11245-11253
Tobler, M. (2015). Camera Base version 1.7 user guide. Atrium Biodiversity Information System. http://www.atrium-biodiversity.org/tools/camerabase/
Upton, G. J. G. (1992). Fisher's exact test. Journal of the Royal Statistical Society Series A (Statistics in Society), 155, 395-402. https://doi.org/10.2307/2982890
Valeix, M., Chamaillé-Jammes, S., & Fritz, H. (2007). Interference competition and temporal niche shifts: elephants and herbivore communities at waterholes. Oecologia, 153, 739–748. https://doi.org/10.1007/s00442-007-0764-5
Van Berkel, T. (2014). Camera trapping for wildlife conservation: expedition field techniques. Geography Outdoors.