
UNED Research Journal (e-ISSN 1659-441X), Vol. 14(supl.1): e3857, June, 2022
Selección natural del melanismo en jaguar y tigrillo (Carnivora: Felidae)
Amy A. Eppert1,2![]() , Ryan T. Botts3
, Ryan T. Botts3![]() & Michael S. Mooring1,2
& Michael S. Mooring1,2![]()
1. Point Loma Nazarene University, Departamento de Biología, 3900 Lomaland Drive, San Diego, CA 92106 Estados Unidos; mmooring@pointloma.edu
2. Centro Quetzal de Educación e Investigación, 200 metros al norte del hotel Savegre, San Gerardo de Dota, Costa Rica; amyeppert@gmail.com
3. Point Loma Nazarene University, Departamento de las Ciencias de la Matemáticas, Información y Computación, 3900 Lomaland Drive, San Diego, CA 92106 Estados Unidos; fallecido
Recibido 14-X-2021 Corregido 22-X-2021 Aceptado 25-X-2021
DOI: https://doi.org/10.22458/urj.v14iS1.3857
|
ABSTRACT. “Natural selection of melanism in jaguar and oncilla in Costa Rica”. Introduction: The persistence of coat color polymorphisms, such as the coexistence of the melanistic coat color (black) and "wild type" (spotted), is an evolutionary enigma. Objective: The predictions of Gloger's Rule and the Temporal Segregation hypothesis were tested, which propose that melanistic individuals (a) will occur more frequently in dense tropical forest than in open habitat due to the advantages of camouflage and thermoregulation, and (b) will be most active during the brightest times of the circadian and lunar cycle because black pigmentation is cryptic under bright light. Methods: Based on 10 years of jaguar and oncilla camera trap records from dense tropical forest in Costa Rica, the activity patterns and relative abundance of non-melanistic (rosetted or spotted) versus melanistic morphs was compared. Results: Twenty-five percent of jaguar records in dense forests were melanistic compared to the global average of 10% in open and closed habitats; 32% of oncilla records were melanistic compared to 18% overall in Brazil. Overlap analysis indicated that melanistic jaguars were more active during daylight hours compared to non-melanistic jaguars, which were more nocturnal and crepuscular. Likewise, melanistic oncilla were more diurnal than non-melanistic oncilla; melanistic oncilla were also more active during the full moon, while the non-melanistic oncilla were less active. Conclusion: These results imply that melanistic jaguar and oncilla enjoy the adaptive benefits of superior camouflage when inhabiting dense forest and accumulate a fitness advantage when hunting in brighter light conditions. If true, natural selection would ensure that melanistic individuals persist when dense forest is retained but may be threatened by deforestation and accelerating human presence.
Keywords: Melanism, Gloger’s rule, temporal segregation, jaguar, oncilla.
|
RESUMEN. Introducción: La persistencia de los polimorfismos del color del pelaje, como la coexistencia del color del pelaje melánico (negro) y el "tipo salvaje" (manchado), es un enigma evolutivo. Objetivo: Probamos las predicciones de la Regla de Gloger y la hipótesis de la Segregación Temporal que proponen que los individuos melánicos (a) ocurrirán con mayor frecuencia en el bosque tropical cerrado que en el hábitat abierto debido a las ventajas del camuflaje y la termorregulación, y (b) serán más activos durante las épocas más brillantes del ciclo circadiano y lunar porque la pigmentación negra es críptica bajo una iluminación brillante. Métodos: Con base en 10 años de registros de cámaras trampas de jaguar y tigrillo de un denso bosque tropical en Costa Rica, comparamos la actividad y la abundancia relativa de formas no melánicas (rosetones o manchados) versus formas melánicas. Resultados: El 25% de los registros de jaguares en bosques densos fueron melánicos en comparación con el promedio global del 10% en hábitats abiertos y cerrados; el 32% de los registros de tigrillo fueron melánicos en comparación con el 18% en general en Brasil. El análisis de superposición indicó que los jaguares melánicos eran más activos durante las horas del día en comparación con los jaguares no melánicos, que eran más nocturnos y crepusculares. Asimismo, el tigrillo melánico era más diurno que el tigrillo no melánico. El tigrillo melánico también fue más activo durante la luna llena, mientras que el tigrillo no melánico fue menos activo. Conclusión: Estos resultados implican que los jaguares y tigrillos melánicos disfrutan de los beneficios adaptativos de un camuflaje superior cuando habitan en un bosque denso y acumulan una ventaja de aptitud cuando cazan en condiciones de iluminación más brillante. Si es cierto, la selección natural aseguraría que los individuos melánicos persistan cuando se retiene el bosque denso, pero pueden verse amenazados por la deforestación y la presencia humana acelerada.
Palabras clave: Melanismo, Regla de Gloger, segregación temporal, jaguar, tigrillo.
|
De las 41 especies de felinos (Kitchener et al., 2017), 14 especies exhiben 'polimorfismo de color de pelaje' con una morfología de pelaje melánico (negro) que coexiste con un patrón de pelaje "no melánico" de manchas, rosetas, o color uniforme (Schneider et al., 2012; da Silva et al., 2016; da Silva, 2017; Graipel et al., 2019). Los múltiples orígenes evolutivos independientes de la mutación melánica en Felidae y la alta frecuencia de polimorfismo de color en algunas especies de felinos sugieren fuertemente que el melanismo sea favorecido por la selección natural en poblaciones silvestres (Eizirik et al., 2003; Schneider et al., 2012; da Silva, 2017). Aunque se ha propuesto que la coloración melánica es adaptativa en determinadas condiciones ecológicas (Schneider et al., 2015; da Silva, 2017), las ventajas del melanismo siguen siendo un enigma.
La Regla de Gloger propone que la coloración melánica se ve favorecida por la selección natural en hábitats tropicales cerrados debido al camuflaje o las ventajas termorreguladores, mientras que la Hipótesis de la Segregación Temporal predice que los individuos melánicos tendrán una ventaja críptica sobre los individuos no melánicos de tipo salvaje en momentos de iluminación más brillante (Jaroš, 2012; Graipel et al., 2014; da Silva et al., 2016; Delhey, 2017; 2019). Si la coloración melánica permita un mayor camuflaje en un hábitat de bosque cerrado durante las horas más brillantes del día o de la noche, los individuos melánicos podrían expandir su nicho de alimentación al ser más activos que los individuos no melánicos durante los períodos de mayor iluminación. Entonces, los conespecíficos de diferentes morfos de color deben ser capaces de explotar diferentes nichos de hábitat y aprovechar una gama más amplia de recursos (Forsman et al., 2008; Graipel et al., 2014). Un factor adicional es que muchos felinos (incluidos el jaguar y el tigrillo) tienen marcas blancas de la oreja que funcionan en la comunicación intraespecífica, pero están ausentes en los individuos melánicos (Graipel et al., 2019). La combinación de un pelaje oscuro y la ausencia de marcas blancas en las orejas conferiría a los felinos melánicos con un camuflaje superior contra los depredadores y las presas visuales en comparación con los conespecíficos no melánicos más conspicuos (Graipel et al., 2019).
El objetivo de este estudio fue probar las predicciones de la ventaja selectiva del melanismo propuestas por la Regla de Gloger y la Hipótesis de la Segregación Temporal, particularmente en lo que respecta al camuflaje mejorado. Aquí presentamos datos de nuestros estudios de cámara trampa a largo plazo en y alrededor de la Cordillera de Talamanca de Costa Rica con el fin de comparar los correlatos ecológicos y de comportamiento de los colores del pelaje melánico versus no melánico en jaguar y tigrillo. Nuestras hipótesis son que (1) los felinos melánicos tienen una ventaja adaptativa en comparación con los individuos no melánicos; (2) los individuos melánicos tenderán a encontrarse en hábitats en los que los beneficios del melanismo se puedan realizar más plenamente; y (3) los felinos melánicos estarán activos en momentos del día o del mes en que las ventajas de camuflaje del melanismo pueden generar una mayor explotación de recursos en forma de un éxito superior en la caza. Las predicciones que probamos explícitamente fueron (1) el porcentaje de melanismo en el hábitat del bosque tropical será más alto que el promedio global (10%) para el jaguar en hábitats abiertos y cerrados, y comparable al porcentaje brasileño (18%) para el tigrillo; (2) el jaguar melánico y el tigrillo serán más activos durante el día que el jaguar o tigrillo no melánicos; (3) el jaguar y el tigrillo melánico serán más activos durante las fases lunares brillantes que los morfos no melánicos.
MATERIALES Y MÉTODOS
Área de estudio: Realizamos encuestas con cámaras trampa en 12 sitios en las montañas de la Cordillera de Talamanca o bosques de las tierras bajas del Pacífico desde junio de 2010 hasta agosto de 2019 en colaboración con funcionarios del parque nacional y voluntarios de la comunidad local en parques nacionales, reservas privadas y corredores biológicos. Estas áreas abarcan desde bosque primario en áreas protegidas a un mosaico de fragmentos de bosque primario y secundario en corredores biológicos. Los sitios de tierras bajas (Corredor Biológico Alexander Skutch, Corredor Biológico Bosque de Agua, Parque Nacional Cabo Blanco, Proyecto Campanario, Refugio Nacional de Vida Silvestre La Marta y Santuario de Aves Los Cusingos) se encuentran en bosque lluvioso ubicado de 28m hasta 1 000m sobre el nivel del mar. Los sitios de las tierras altas (Parque Nacional Chirripó, Parque Internacional de la Amistad, Parque Nacional Los Quetzales, Parque Nacional Tapantí Macizo de la Muerte y la Reserva de Hotel Savegre en la parte alta del Valle del Río Savegre) son densos bosques tropicales montanos que abarcan desde 2 000m a 3 464m de elevación. El Refugio La Marta y la Reserva El Copal se encuentran dentro del rango de altitud media de 1 000m- 2 000m. No se produjeron cambios importantes en el estado de protección o impactos ambientales durante el estudio.
Cámaras de trampa: Las unidades Bushnell Trophy Cam se desplegaron como unidades individuales o emparejadas a intervalos de uno a 2km, principalmente a lo largo de los sistemas de senderos establecidos y caminos de acceso dentro de las áreas protegidas. A partir del 2012, todas las estaciones de cámaras tenían estaciones de aroma dentro del campo de visión para estimular a los animales que pasaban a reducir la velocidad e investigar el nuevo aroma. Debido a que el flash infrarrojo produce menos luz en comparación con el flash blanco, las estaciones de aroma fueron beneficiosas para maximizar la calidad de la foto al minimizar la borrosidad de las fotos nocturnas.
Análisis de los datos: Los registros fotográficos se cargaron en el software de gestión de datos Camera Base 1.7 (Tobler, 2015) y todos los análisis se realizaron en el lenguaje de programación R (R Core Team, 2019). Los registros fotográficos se consideraron independientes si las fotos de una especie determinada en una estación de cámara en particular estaban separadas por al menos 30 minutos, que es un estándar comúnmente utilizado (Ridout & Linkie 2009; Si et al., 2014; Van Berkel, 2014; Anile & Devillard, 2015; Sollmann, 2018). Los índices de abundancia relativa (IAR) se calcularon para cada especie de todos los sitios de estudio utilizando la ecuación: IAR = (tamaño de la muestra) / (días que la cámara estuvo activa) * 1 000.
Para caracterizar los patrones de actividad, ajustamos el tiempo circadiano en radianes para tener en cuenta los cambios sucesivos de la posición del sol a lo largo del año (Nouvellet et al., 2012) utilizando la función 'sunTime' del paquete 'Overlap' versión 0.3.2 (Meredith & Ridout, 2018a; b). Los registros entre el amanecer y el atardecer se clasificaron como diurnos, mientras que los registros entre el atardecer y el amanecer se consideraron nocturnos. Las especies se clasificaron como diurnas (<10% de los registros por la noche), nocturnas (≥90% de los registros por la noche), principalmente diurnas (10-29% de los registros por la noche), principalmente nocturnas (70-89% de los registros por la noche), o cathemeral (30-69% de registros por la noche) según Azevedo et al. (2018, y referencias allí). La actividad lunar se caracterizó utilizando la función "getMoonIllumination" del paquete "suncalc" versión 0.5.0 (Thieurmel & Elmarhraoui, 2019) para obtener la fase lunar de cada observación en función de su fecha.
Para determinar la superposición de los patrones de actividad entre los felinos melánicos y no melánicos, se utilizó el paquete "Overlap" versión 0.3.2 (Meredith & Ridout, 2018a; b) siguiendo el método de dos medidas desarrollado por Ridout y Linkie (2009). Primero, los patrones de actividad circadiana o de la fase lunar se determinaron utilizando una densidad kernel con un ancho de banda estándar de 1 y un ajuste de ancho de banda de 0,8 para tamaños de muestra grandes (n> 75), o con una distribución de suma trigonométrica no negativa para tamaños de muestras pequeñas (20 ≤ n ≤ 75) (Ridout & Linkie, 2009). A continuación, se calculó el coeficiente de superposición (Δ) utilizando la medida Δ1 para tamaños de muestra pequeños o Δ4 para tamaños de muestra grandes (Ridout & Linkie, 2009). Los valores de Δ caen entre 0 (sin superposición) y 1 (superposición completa) y representan el área compartida bajo dos curvas de densidad. El tamaño mínimo de la muestra se estableció en 20 observaciones independientes para minimizar la sobreestimación de Δ (Lynam et al., 2013; Rowcliffe et al., 2014; Tan et al., 2018).
Para este estudio, se utilizó para evaluar la posible divergencia de los patrones de actividad temporal entre conespecíficos melánicos y no melánicos; y se realizó la prueba exacta de Fisher para evaluar la significancia de la divergencia. Las observaciones de cada especie se agruparon por tiempo en 12 contenedores correspondientes a intervalos de dos horas cada uno y se ejecutó la prueba exacta de Fisher con una simulación de Monte Carlo de 1000 repeticiones (Upton, 1992). Todo el código R utilizado en este análisis está disponible en línea en Github (https://github.com/rbotts/Melanism).
RESULTADOS
Jaguar melánico: De un total de 58 280 días de cámara trampa durante 2010-2019, acumulamos un total de 104 registros independientes de jaguar, de los cuales el 25% eran melánicos (melánicos: n = 26; no melánicos: n = 78). Asimismo, el índice de abundancia relativa del jaguar melánico (IAR = 0,480) fue 25% del jaguar no melánico (IAR = 1 440). Estimamos que el número de individuos representados en nuestras encuestas fue un mínimo de 15 individuos no melánicos y 3-4 individuos melánicos (17% -21%).
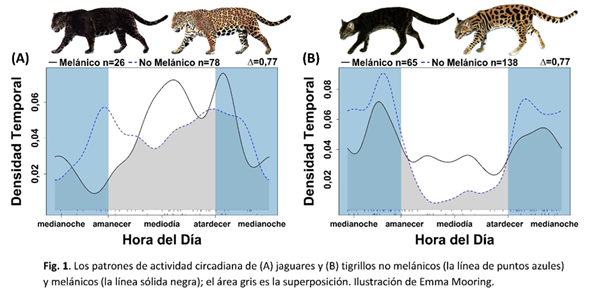
El patrón de actividad del jaguar no melánico tendió a ser más crepuscular y dividido uniformemente entre el día y la noche (51% diurno; 49% nocturno) en comparación con la actividad más diurna del jaguar melánico (58% diurno, 42% nocturno). El jaguar melánico tuvo un pico de actividad durante el día desde las 9:00 a.m. hasta las 3:00 p.m., mientras que el jaguar no melánico estuvo más activo temprano en la mañana (3:00-6:00 a.m.) y temprano en la noche (7:00 p.m.-9:00 p.m.) (Fig. 1).
El coeficiente de superposición Δ entre el jaguar no melánico y melánico para la actividad circadiana fue 0,77 (IC del 95% = 0,63; 0,90), que fue significativamente diferente según la prueba exacta de Fisher (Chi2 p = 0,01). Aunque parecía que el jaguar melánico era más activo durante el primer cuarto de luna en comparación con el jaguar no melánico, esto puede ser el resultado de un tamaño de muestra pequeño de registros nocturnos. De hecho, el tamaño de la muestra de los registros nocturnos era demasiado pequeño para calcular la superposición y ejecutar las pruebas estadísticas asociadas (melánico n = 11, no melánico n = 38).
Tigrillo melánico: De 2010 a 2019, registramos un total de 203 fotos independientes de oncilla, de las cuales el 32% eran melánicos (melánicos: n = 65; no melánicos: n = 138). Asimismo, según el índice de abundancia relativa, el 29% del tigrillo eran melánicos (IAR = 1,200) en comparación con las no melánicos (RAI = 2,918).
El patrón de actividad del tigrillo no melánico fue principalmente nocturno (85% nocturna; 15% diurna) en comparación con la actividad más diurna del tigrillo melánico (66% nocturna, 34% diurna).
El coeficiente de superposición Δ entre el tigrillo melánico y no melánico para la actividad circadiana fue 0,77 (IC del 95% = 0,67, 0,87), que fue significativamente diferente (prueba exacta de Fisher: Chi2 p = 0,05). El análisis de la superposición de actividad del tigrillo durante las fases lunares dio un coeficiente de superposición Δ = 0,87 (IC del 95% = 0,75, 0,97). El análisis de la fase lunar indicó que el tigrillo melánico fue más activo durante la luna llena y el último cuarto en comparación con el tigrillo no melánico que fue más activo durante el primer cuarto, pero esto no fue significativamente diferente (Prueba exacta de Fisher: Chi2 p = 0,70).
DISCUSIÓN
Con base en 10 años de datos de encuestas, probamos la hipótesis de que el melanismo otorga una ventaja selectiva al jaguar y el tigrillo en el denso bosque tropical, y específicamente que la morfología oscura proporciona una ventaja críptica durante los momentos más brillantes del ciclo circadiano y lunar. Como predijo la Regla de Gloger, el 25% de los registros de cámaras trampa independientes de jaguar involucraron individuos melánicos, más del doble del promedio global del 10% basado en hábitats abiertos y cerrados (da Silva, 2017). De manera similar, el 32% de los registros independientes del tigrillo fueron melánicos, más alto que el porcentaje del tigrillo brasileña del 18% (Graipel et al., 2014). Por lo tanto, el alto porcentaje de registros melánicos apoya la hipótesis de que los polimorfismos de color melánico en estas especies son adaptables en hábitats de bosques densos, muy probablemente debido al camuflaje o beneficios termorreguladores.
En apoyo de nuestros resultados, da Silva (2017) analizó 37 factores ambientales en relación con la distribución geográfica del melanismo en los jaguares en toda su área de distribución. Basado en 980 registros de jaguares, encontró que el melanismo estaba presente en la mayoría de los hábitats forestales, pero estaba completamente ausente en el hábitat de pastizales y sabanas. Da Silva (2017) concluyó que (a) la distribución espacial del melanismo no fue aleatoria, (b) la ocurrencia del melanismo estaba relacionada con la humedad y (c) la frecuencia del melanismo puede estar regulada por el clima. Curiosamente, los modelos que da Silva generó para explicar el melanismo mostraron una alta idoneidad para la ocurrencia de melanismo en Belice y Costa Rica (da Silva, 2017).
Se apoyó la predicción de la Segregación Temporal de que el jaguar y la oncilla melánico se camuflarían mejor con una luz más brillante en comparación con los individuos no melánicos, ya que tanto el jaguar melánico como el tigrillo son significativamente más diurnos en comparación con los conespecíficos no melánicos. Como confirmación de nuestros resultados, Graipel et al. (2014) encontraron que el tigrillo melánico era más activo durante las noches brillantes en comparación con el tigrillo no melánico, otros felinos (caucel, manigordo, puma) y las presas de pequeños mamíferos (en su mayoría roedores), concluyendo que el tigrillo melánico se camuflaría mejor en noches brillantes y, por lo tanto, se beneficiaría tanto de un mayor éxito de caza como de una menor competencia (Graipel et al., 2014).
También probamos la predicción de que los colores melánicos serían más activos durante las fases más brillantes de la luna. La predicción no fue apoyada para el jaguar melánico, sin un patrón claro en los patrones de actividad de la fase lunar del jaguar melánico versus no melánico detectado. Por el contrario, la predicción de la actividad lunar fue apoyada para el tigrillo melánico porque hubo un aumento en la actividad el tigrillo melánico durante el primer cuarto y la luna llena y una disminución en la actividad durante este tiempo en los individuos no melánicos. Los tigrillos eran dos veces más nocturnos que el jaguar, lo que sugiere que los mecanismos evolutivos que actúan para facilitar los cambios en el comportamiento nocturno pueden proporcionar más "retorno de la inversión" para el tigrillo que para el jaguar.
Nuestros resultados apoyan la hipótesis de que el melanismo proporciona beneficios adaptativos favorecidos por la selección natural. Los resultados del análisis de superposición de actividad sugieren que el tigrillo y el jaguar melánico pueden persistir frente a la competencia conespecífica de sus congéneres no melánicos debido a su camuflaje superior bajo una luz diurna o lunar más brillante. Esta perspectiva no solo contribuye a una mejor comprensión de la evolución, la biogeografía y el comportamiento de los polimorfismos de color melánico (Payan & de Oliveira, 2016; Quigley et al., 2018), sino que también puede proporcionar a los responsables de la formulación de políticas de conservación, las agencias de recursos y comunidades con herramientas para gestionar mejor las poblaciones de felinos silvestres.
Una implicación de estos hallazgos es que el jaguar melánico (y quizás el tigrillo) requieren bosques tropicales densos para su existencia continua (Delhey, 2017; da Silva, 2017), por lo que los cambios futuros en el uso de la tierra podrían tener un efecto más devastador en los individuos melánicos en comparación con los no melánicos. La ausencia de bosque tropical eliminaría la ventaja selectiva del melanismo indicada por nuestro estudio, y proponemos que la pérdida continua del bosque amenaza la persistencia del polimorfismo del color del pelaje melánico en las poblaciones de jaguares.
Además, se sabe que los felinos evitan a los seres humanos, y una mayor presencia humana puede resultar en la evitación de áreas que son visitadas intensamente por la gente (Tortato & de Oliveira, 2005). Esto presenta la preocupante posibilidad de que el aumento de la perturbación humana podría tener la consecuencia involuntaria de reducir la capacidad de los individuos melánicos para cazar durante las horas del día y, por lo tanto, comprometer el éxito de la captura de sus presas. El melanismo puede ser un "arma de doble filo" que proporciona ventajas adaptativas en ausencia de perturbaciones humanas, pero es una desventaja competitiva frente a fuertes impactos humanos.
AGRADECIMIENTOS
Agradecemos a las 26 personas estudiantes de Point Loma Nazarene University quien participaron en la Encuesta de Mamíferos Grandes del Cordillera Talamanca. El apoyo del Centro Quetzal de Educación e Investigación (QERC), de don Efraín Chacón Ureña y la familia Chacón ha sido esencial y estamos agradecidos con su entusiasta ayuda. Agradecemos a nuestros colaboradores de investigación que monitorean las encuestas de cámaras trampas: Arsenio Aguerro y Oscar Masis Chávez (Parque Nacional Los Quetzales), Leonel Delgado (PN La Cangreja, PN Tapantí), Roger González y Junior Porras (Parque Internacional de la Amistad), Enzo Vargas (PN Chirripó), Mahyar Shirazinia, Fabricio Carbonell, y Adrian Ugalde (PN Tapantí), Adrián Arce (PN Carara), Andres Jiménez y Yaudy Alvarado (PN Cabo Blanco). Por el apoyo administrativo de SINAC, agradecemos a Marisol Rodriguez (ACLA-P) y Lourdes Vargas.
atribución de la publicación fuente
UNED Research Journal únicamente publica artículos originales, sin embargo, en este caso se ha hecho una excepción por encontrarse dentro de un suplemento y por tratarse de una adaptación traducida, de innegable utilidad en la América Latina. Los datos y análisis resumidos en este artículo se publicaron originalmente en inglés, en la serie SAGE Journals, y se reproducen con autorización:
Mooring, M. S., Eppert, A. A., Botts, R. T. (2020). Natural selection of melanism in Costa Rican jaguar and oncilla: a test of Gloger’s Rule and the temporal segregation hypothesis. Tropical Conservation Science, 13, 1-15. https://doi.org/10.1177/1940082920910364
Artículo publicado por primera vez en línea: 11 de marzo de 2020
https://journals.sagepub.com/doi/10.1177/1940082920910364
ÉTICA, CONFLICTO DE INTERESES Y DECLARACIÓN DE FINANCIAMIENTO
Declaramos haber cumplido con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en la preparación de este documento, y que no hay conflictos de interés de ningún tipo. La declaración de contribución de cada autor: A.A.E.: análisis de datos en el software R e elaboración de fotogramas; R.T.B: análisis de datos; M.S.M.: diseño del estudio e interpretación de análisis; Todos Autores: preparación y aprobación final del manuscrito.
Anile, S., & Devillard, S. (2015). Study design and body mass influence RAIs from camera trap studies: evidence from the Felidae. Animal Conservation, 19, 35–45. https://doi.org/10.1111/acv.12214
Azevedo, F. C., Lemos, F. G., Freitas-Junior, M. C., Rocha, D. G., & Azevedo, F. C. C. (2018). Puma activity patterns and temporal overlap with prey in a human-modified landscape at Southeastern Brazil. Journal of Zoology, 305, 246–255. https://doi.org/10.1111/jzo.12558
da Silva, L. G. (2017). Ecology and evolution of melanism in big cats: Case study with black leopards and jaguars. In A. B. Shrivastav & K. P. Singh (Eds.). Big cats (pp. 93–110). IntechOpen. http://dx.doi.org/10.5772/intechopen.69558
da Silva, L. G., de Oliveira, T. G., Kasper, C. B., Cherem, J. J., Moraes, E. A., Paviolo, A., & Eizirik, E. (2016). Biogeography of polymorphic phenotypes: Mapping and ecological modelling of coat colour variants in an elusive Neotropical cat, the jaguarundi (Puma yagouaroundi). Journal of Zoology, 299(4), 295–303. https://doi.org/10.1111/jzo.12358
Delhey, K. (2017). Gloger’s rule. Current Biology Magazine, 27, R689–R691. https://doi.org/10.1016/j.cub.2017.04.031
Delhey, K. (2019). A review of Gloger's rule, an ecogeographical rule of colour: Definitions, interpretations and evidence. Biological Reviews, 94(4), 1294-1316. https://doi.org/10.1111/brv.12503
Eizirik, E., Yuhki, N., Johnson, W. E., Menotti-Raymond, M., Hannah, S. S., & O’Brien, S. J. (2003). Molecular genetics and evolution of melanism in the cat family. Current Biology, 13(5), 448–453. https://doi.org/10.1016/S0960-9822(03)00128-3
Forsman, A., Ahnesjö, J., Caesar, S., & Karlsson, M. (2008). A model of ecological and evolutionary consequences of color polymorphism. Ecology, 89(1), 34–40. https://doi.org/10.1890/07-0572.1
Graipel, M. E., Bogoni, J. A., Giehl, E. L. H., Cerezer, F. O., Cáceres, N. C., & Eizirik, E. (2019). Melanism evolution in the cat family is influenced by intraspecific communication under low visibility. PLoS ONE, 14, e0226136. https://doi. org/10.1371/journal.pone.0226136.
Graipel, M. E., Oliveira-Santos, L. G. R., Goulart, F. V. B., Tortato, M. A., Miller, P. R. M., & Cáceres, N. C. (2014). The role of melanism in oncillas on the temporal segregation of nocturnal activity. Brazilian Journal of Biology, 74, S142-S145. https://doi.org/10.1590/1519-6984.14312
Jaroš, R. (2012). The ecological and ethological significance of felid coat patterns (Felidae). [Unpublished doctoral dissertation, Charles University].
Kitchener, A. C., Breitenmoser-Würsten, C., Eizirik, E., Gentry, A., Werdelin, L., Wilting, A., Yamaguchi, N., Abramov, A. V., Christiansen, P., Driscoll, C., Duckworth, J. W., Johnson, W. E., Luo, S. J., Meijaard, E., O'Donoghue, P., Sanderson, J., Seymour, K., Bruford, M., Groves, C…. Tobe, S. (2017). A revised taxonomy of the Felidae. The final report of the Cat Classification Task Force of the IUCN-SSC Cat Specialist Group. Cat Specialist Group, 11, 1-80.
Lynam, A. J., Jenks, K. E., Tantipisanuh, N., Chutipong, W., Ngoprasert, D., Gale, G. A., Steinmetz, R., Sukmasuang, R., Bhumpakphan, N., Grassman, L. I., Cutter, P., Kitamura, S., Reed, D. H., Baker, M. C., McShea, W., Songsasen, N., Leimgruber, P. (2013). Terrestrial activity patterns of wild cats from camera-trapping. The Raffles Bulletin of Zoology, 61(1), 407-415.
Meredith, M., & Ridout, M. (2018a). Overlap: Estimates of coefficient of overlapping for animal activity patterns. R package version 0.3.2. https://cran.r-project.org/web/packages/overlap/overlap.pdf
Meredith, M., & Ridout, M. (2018b). Overview of the overlap package. https://cran.r-project.org/web/packages/overlap/vignettes/overlap.pdf
Mooring, M. S., Eppert, A. A., Botts, R. T. (2020). Natural selection of melanism in Costa Rican jaguar and oncilla: a test of Gloger’s Rule and the temporal segregation hypothesis. Tropical Conservation Science, 13, 1-15. https://doi.org/10.1177/1940082920910364
Nouvellet, P., Rasmussen, G. S. A., Macdonald, D. W., & Courchamp, F. (2012). Noisy clocks and silent sunrises: measurement methods of daily activity pattern. Journal of Zoology, 286, 179–184.
Payan, E., & de Oliveira, T. (2016). Leopardus tigrinus. The IUCN Red List of Threatened Species 2016: e.T54012637A50653881. http://dx.doi.org/10.2305/IUCN. UK.2016-2.RLTS.T54012637A50653881.en.
Quigley, H., Foster, R., Petracca, L., Payan, E., Salom, R., & Harmsen, B. (2017). Panthera onca (errata version published in 2018). The IUCN Red List of Threatened Species 2017: e.T15953A123791436. http://dx.doi. org/10.2305/IUCN.UK.2017-3.RLTS.T15953A50658693.en
R Core Team (2019). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna. https://www.R-project.org
Ridout, M. S., & Linkie, M. (2009). Estimating overlap of daily activity patterns from camera trap data. Journal of Agricultural Biological and Environmental Statistics, 14, 322-337. https://doi.org/10.1198/jabes.2009.08038
Rowcliffe, J. M., Kays, R., Kranstauber, B., Carbone, C., & Jansen, P. A. (2014). Quantifying levels of animal activity using camera trap data. Methods in Ecology and Evolution, 5(11), 1170-1179. https://doi.org/10.1111/2041-210X.12278
Schneider, A., David, V. A., Johnson, W. E., O’Brien, S. J., Barsh, G. S., Menotti-Raymond, M., & Eizirik, E. (2012). How the leopard hides its spots: ASIP mutations and melanism in wild cats. PLoS One, 7(12), e50386. https://doi.org/10. 1371/journal.pone.0050386.
Schneider, A., Henegar, C., Day, K., Absher, D., Napolitano, C., Silveira, L., David, V.A., O’Brien, S. J., Menotti-Raymond, M., Barsh, G.S., Eizirik, E. (2015). Recurrent evolution of melanism in South American felids. PLoS Genetics, 10(2), e1004892. https://doi.org/10.1371/journal.pgen.1004892
Si, X., Kays, R., & Ding, P. (2014). How long is enough to detect terrestrial animals? Estimating the minimum trapping effort on camera traps. PeerJ, 2: e374. https://doi.org/10.7717/peerj.374.
Sollmann, R. (2018). A gentle introduction to camera‐trap data analysis. African Journal of Ecology, 56(4), 740–749. https://doi.org/10.1111/aje.12557
Tan, W.S., Hamzah, N.B.A., Saaban, S., Zawakhir, N.A., Rao, Y., Jamaluddin, N., Cheong, F., Khalid, N.B., Mohd Saat, N.L., Zaidee Ee, E.N.B., Hamdan, A.B., Chow, M.M., Low, C.P., Voon, M., Liang, S.H., Tyson, M., Gumal, M. (2018). Observations of occurrence and daily activity patterns of ungulates in the Endau Rompin Landscape, Peninsular Malaysia. Journal of Threatened Taxa, 10(2), 11245–11253. https://doi.org/10.11609/jott.3519.10.2.11245-11253
Thieurmel, G., & Elmarhraoui, A. (2019). Package ‘suncalc’: Compute sun position, sunlight phases, moon position and lunar phase. R package version 0.5. https://cran.r-project. org/web/packages/suncalc/suncalc.pdf.
Tobler, M. (2015). Camera Base version 1.7 user guide. Atrium Biodiversity Information System. http://www.atrium-biodiversity.org/tools/camerabase/
Tortato, M. A., & de Oliveira, T. G. (2005). Ecology of the oncilla (Leopardus tigrinus) at Serra do Tabuleiro State Park, Southern Brazil. CAT News, 42, 28-30.
Upton, G. J. G. (1992). Fisher's exact test. Journal of the Royal Statistical Society Series A (Statistics in Society), 155(3), 395-402. https://doi.org/10.2307/2982890
Van Berkel, T. (2014). Camera trapping for wildlife conservation: expedition field techniques. Geography Outdoors, Royal Geographical Society.