Entre los estreses abióticos, la salinidad constituye una de las principales limitantes en la producción vegetal, tanto en biomasa como en área foliar (Bybordi & Ebrahinmian, 2011). Aproximadamente la quinta parte de los 2 800 millones de hectáreas cultivables del planeta están afectadas por la salinidad, situación que tiende a agravarse (Ben Dkhil & Denden, 2010).
Las especies del Género Prosopis resultan muy interesantes para la restauración de áreas degradadas afectadas por procesos de salinización, ya que son altamente tolerantes al estrés salino, y presentan maderas con excelentes propiedades físicas y mecánicas (Velarde, Felker & Degano, 2003).
El algarrobo blanco (Prosopis alba G.) es una especie arbórea de importancia forestal del Chaco Occidental, empleada en mueblería y carpintería, que presenta frutos aptos para el consumo humano y como forraje. Habita las zonas bajas más húmedas en las sabanas con suelos arenosos, formando cinturones alrededor de las depresiones salinas (Giménez & Moglia, 2003). Si bien el algarrobo blanco es considerado tolerante al estrés salino, no se conocen los mecanismos fisiológicos involucrados en su adaptación a dichas condiciones.
En muchas especies, la salinidad causa una disminución en la absorción de K+, Ca+2, NO3-, y Pi, aumentando las relaciones Na+/Ca+2, Na+/K+, Ca+2/Mg+2 y Cl-/NO3- (Zang et al., 2012). Las alteraciones en las concentraciones y relaciones de iones, pueden afectar procesos metabólicos, como la fotosíntesis, la síntesis de ácidos nucleicos, la actividad de enzimas, la respiración, la absorción de iones, e incluso la actividad microbiana en las raíces (Carillo, Annunziata & Pontecorvo, 2011; Siddiqui, Mohammad, Khan, Mohamed & Al-Whaibi 2012).
Generalmente el nitrógeno es el nutriente que más limita el crecimiento de las plantas en la mayoría de los suelos, y tanto su absorción como su metabolismo pueden ser afectados por el estrés salino (Miura, 2013).
La nitrato reductasa (NR- EC 1.6.6.1.) es la primera enzima en la ruta de reducción del nitrato, para su posterior asimilación. Su actividad catalítica está sujeta a una compleja regulación, en respuesta a diferentes estímulos ambientales. El efecto de la salinidad sobre la actividad nitrato reductasa depende de muchos factores, tales como la especie, fuente de nitrógeno, edad de la planta, concentración salina, y tiempo de exposición al estrés. Se ha reportado una disminución significativa en la actividad NR en hojas de Brassica juncea (Siddiqui, Mohammad, Khan, Mohamed & Al-Whaibi 2012), genotipos sensibles de trigo (Carillo et al., 2008; Yousfi, Serret, Márquez, Voltas & Araus, 2012), tomate (Gong et al., 2013), algodón (Kawakami, Osterhuis & Snider, 2013), girasol (Ebrahimian & Bybordi, 2011), Vigna unguiculata (Magalhães de Aragão, Silva, Lima & Silveira, 2011) y hojas y raíces de álamo (Ehlting et al., 2007) sometidas a estrés con NaCl. Por el contrario, el estrés salino incrementó la actividad nitrato reductasa en raíces de pepino (Reda, Migocka & Klobus, 2011) y tomate (Debouba, Maâroufi-Dghimi, Suzuki, Ghorbel & Gouia, 2007).
El impacto del estrés salino sobre la fotosíntesis puede evaluarse a través del análisis de variables de emisión de fluorescencia de la clorofila a. Se trata de un método no destructivo y muy sensible, capaz de detectar alteraciones en la etapa fotoquímica, antes de que la planta muestre síntomas visibles (Naumann, Young & Anderson, 2007).
Este trabajo tuvo como objetivo evaluar el impacto del estrés salino sobre la nutrición mineral y la fotosíntesis, en plántulas de algarrobo blanco.
Materiales y Métodos
El germoplasma para la realización de este trabajo se extrajo de un bosque P. alba desarrollado al margen de lagunas temporales, en la localidad de Maco (27°51’20” S y 64°13’27” W), Provincia de Santiago del Estero, Argentina. Se seleccionaron al azar 50 árboles, cosechándose 50 frutos de cada uno de ellos, que fueron posteriormente almacenados en heladera a 5°C hasta su utilización, para evitar el ataque de insectos. Las semillas se extrajeron manualmente de los frutos, y se trataron con un corte en la posición distal respecto al embrión, para facilitar su imbibición durante la germinación. La siembra se realizó empleando toallas de papel humedecidas con agua destilada, que se incubaron en cámara de crecimiento por un lapso de 15 días a 25ºC y bajo un fotoperíodo de 12 horas.
Las plántulas así obtenidas, se cultivaron hidropónicamente en cámara de crecimiento, en recipientes de cinco litros (20 plántulas por recipiente) conteniendo solución nutritiva de Hoagland al 25% con o sin la suplementación de 500mM de NaCl (Silva et al., 2013).
Las pérdidas por transpiración se compensaron mediante el agregado de agua destilada, manteniendo constante el nivel de solución en los recipientes. El pH se ajustó a 6,5 mediante la adición de KOH o H2SO4 0,1 N.
Diariamente se realizaron mediciones de emisión de fluorescencia modulada de la clorofila a, y se tomaron muestras de hojas, para determinar las concentraciones de Na+, K+, Cl- y NO3- y.la actividad NR in vivo.
Al cabo de 7 días de tratamiento las plantas se retiraron de la solución nutritiva, se lavaron con agua destilada, y se secaron en estufa de ventilación forzada a 600C, para luego determinar la biomasa de raíces y hojas. El experimento se repitió dos veces.
Las concentraciones de Na+, K+, Cl- y NO3- se cuantificaron de acuerdo a la metodología descripta por Malavolta, Vitti y Oliveira (1989). Siguiendo dicho protocolo, los iones Na+y K+ se extrajeron mediante digestión con una mezcla de HNO3/HClO4 y analizaron a través de espectrometría de llama. El ion Cl- se determinó por titulación con nitrato de plata, y el NO3- se extrajo con agua destilada y se cuantificó espectrofotométricamente por nitración del ácido salicílico, a 410nm.
La actividad nitrato reductasa se cuantificó según el método de Klepper, Flesher y Hageman (1971), con algunas modificaciones. Para ello, 100 mg de hojas se infiltraron con bomba de vacío en 2mL de solución de incubación conteniendo: buffer fosfato 0,1M pH 7,5 KNO3 0,05M y 1% v/v isopropanol. La incubación se realizó durante 1 hora, a 30ºC en oscuridad. Para estimar la cantidad de nitrito formado, se adicionó 1 mL de sulfanilamida 1% en HCl 1N, y dicloruro de N (1-naftil) etilendiamina 0,02%; agitando los tubos de ensayo en vortex durante 1 minuto. Se leyó la absorbancia de la solución resultante, a 540nm mediante el uso de un espectrofotómetro. La concentración de proteínas se determinó mediante el método de Bradford (1976) utilizando albúmina sérica bovina como estándar, y la actividad NR se expresó como µmol NO2- mg-1 proteína h-1.
La fluorescencia de la clorofila a se midió utilizando un fluorómetro portátil (Walz GmbH Eichenring, 691090 Effeltrich, Germany) entre las 8:00a.m y 11:00p.m. Los valores de las variables relación fluorescencia variable/fluorescencia máxima (Fv/Fm), quenching fotoquímico (qP), quenching no fotoquímico (NPQ) y tasa de transporte de electrones (ETR) se calcularon de acuerdo a Maxwell y Johnson (2000).
Se utilizó un diseño experimental completamente aleatorizado, con diez repeticiones y los datos se analizaron con ANOVA y Test de Tukey.
Resultados
El estrés salino inhibió el crecimiento de la parte aérea; al cabo de 7 días de tratamiento las plántulas incubadas en 500mM de NaCl presentaron una biomasa aérea 46% menor que el testigo (Cuadro 1). El crecimiento de las raíces no fue afectado por la salinidad, por lo que la relación raíz parte aérea se incrementó.
La inhibición del crecimiento de la parte aérea estuvo asociada con alteraciones en la homeostasis iónica.
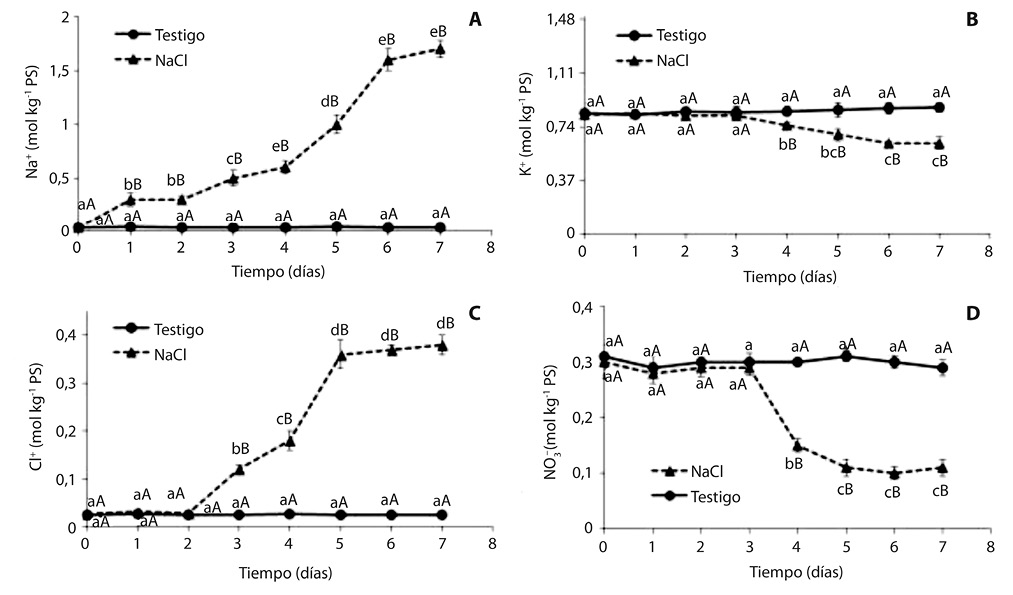
La concentración foliar de Na+ se incrementó a partir primer día de incubación en la solución salina, alcanzando su máximo valor en el sexto día, con tenores próximos a 2mol kg-1 PS. En el testigo la concentración se mantuvo constante en valores próximos a 0,03mol kg-1 PS (Fig. 1A).
La concentración de K+ se mantuvo constante hasta el tercer día, y luego manifestó una disminución gradual; al cabo de 7 días de tratamiento salino fue 28% menor que en el testigo, cuyos valores no se modificaron a lo largo del ensayo (Fig. 1B).
La concentración de Cl- fue considerablemente menor que la de Na+, y se incrementó recién luego de 3 días de incubación en medio salino, alcanzando un valor máximo al quinto día (Fig. 1C):
La concentración de nitrato mostró una pronunciada disminución a partir del cuarto día de tratamiento salino, y al finalizar el ensayo fue tres veces menor que en las plantas del testigo (Fig. 1D).
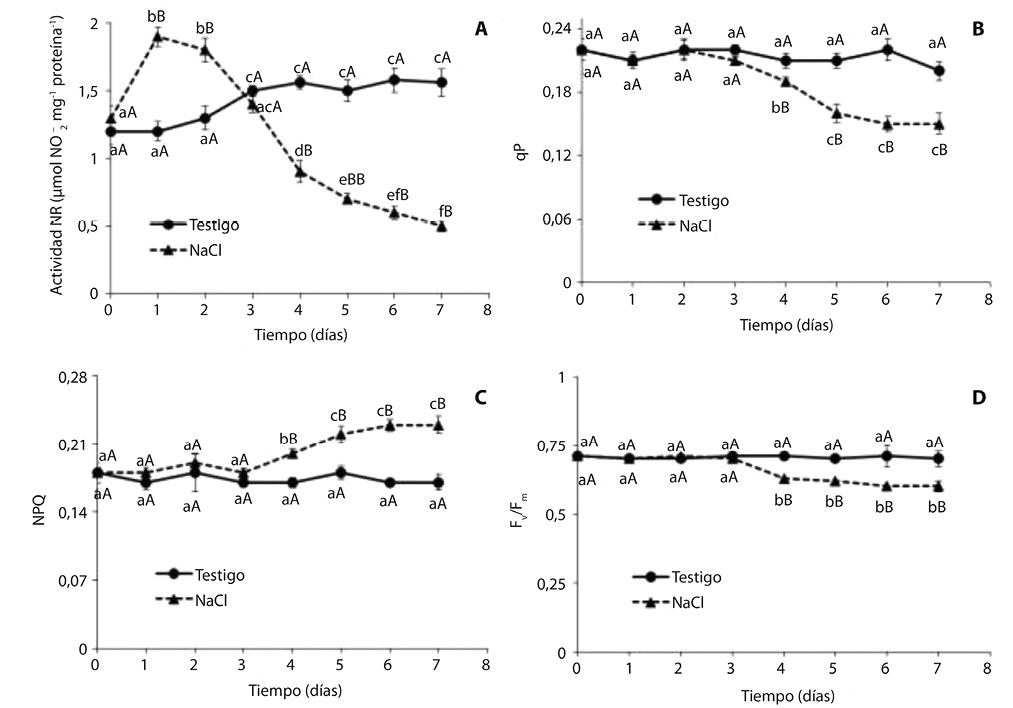
La actividad de la enzima nitrato reductasa en el testigo se incrementó con el transcurso del tiempo (Fig. 2A). Contrastando con dicha tendencia, en las plántulas sometidas a estrés salino la actividad de esta enzima mostró un aumento pronunciado a partir del primer día de incubación en la solución salina, y una disminución brusca en el cuarto día. Al cabo de 7 días la actividad nitrato reductasa en plántulas crecidas en presencia de 500 mM de NaCl fue 300% inferior al testigo.
El estrés salino inhibió la etapa fotoquímica de la fotosíntesis en plántulas de algarrobo blanco, a partir del cuarto día de tratamiento salino (Fig. 2B, C y D). A finalizar el ensayo los valores de qP y Fv/Fm fueron 25% y 15% menores que el testigo, respectivamente (Fig. 2 B, D), mientras que NPQ fue 35% mayor que el testigo (Fig. 2C). La tasa de transporte de electrones fue muy sensible a la salinidad, observándose una disminución del 50% con respecto al testigo a partir del quinto día de tratamiento salino (Fig. 3).
Discusión
El estrés salino inhibió el crecimiento de la parte aérea de algarrobo blanco, y no afectó la biomasa de raíces, aumentando la relación raíz/parte aérea (Cuadro 1). Esta respuesta morfológica es considerada un indicador de tolerancia a los estreses hídrico y salino, ya que permite aumentar la superficie del suelo explorada por las raíces, y así incrementar la disponibilidad de agua (Reginato, Sgroy, Llanes, Cassán & Luna, 2012).
Una respuesta similar fue reportada en Prosopis ruscifolia, una especie leñosa halófita nativa del Chaco Occidental (Meloni, Gulotta & Martínez, 2008). En dicha especie el incremento en la relación raíz/parte aérea se acentuó con la adición de calcio a la solución nutritiva, incrementándose la tolerancia a la salinidad (Meloni, Silva & Bolzón., 2015).
En el Chaco Occidental, las condiciones de semiaridez, con una elevada evapotranspiración, hacen que las sales se concentren en la superficie del suelo (Meloni et al., 2008). Por tanto, el desarrollo de un gran sistema radical pivotante, le permite a las plántulas profundizar en el perfil, donde la concentración salina es menor.
El estrés salino incrementó las concentraciones de Na+ y Cl- en la parte aérea (Fig. 1A, C); sin embargo, los niveles de Cl- fueron bajos, y considerablemente inferiores a los reportados en Schinopsis lorentzii, una especie sensible al estrés salino también nativa de la región del Chaco Occidental (Meloni et al., 2008). Este resultado sugiere que algarrobo blanco restringe la traslocación de iones tóxicos a la parte aérea, almacenándolo principalmente en raíces.
La exclusión de iones tóxicos de la parte aérea ha sido considerada como un mecanismo de tolerancia al estrés salino (Munns & Tester, 2008), y puede justificar el desarrollo de esta especie en suelos salinos sódicos. Un comportamiento similar ha sido reportado en Prosopis ruscifolia; una especie pionera en la sucesión vegetal del Chaco Occidental, capaz de tolerar concentraciones de NaCl equivalentes al agua de mar (Meloni & Martínez, 2009).
Reginato et al. (2012) calificaron a P. strombulifera, como una especie halófita que excluye al Na+ de la parte aérea, y asociaron ese comportamiento, con una precoz suberificación y lignificación de la endodermis.
La exclusión del Na+ de las hojas también puede lograrse mediante su secuestro en las vacuolas de la raíz, limitando su traslocación a la parte aérea, o recuperándolo del xilema de la raíz, antes de alcanzar el tallo, a través de transportadores de alta afinidad por el K+ (HKT) (Munns & Tester, 2008). Recientemente Munns et al. (2012) demostraron que, en trigo, el gen TmHKT1; 5-A ubicado en el locus Nax2, codifica para un transportador con alta selectividad para el Na+, localizado en la membrana plasmática de las células de la raíz circundantes a los vasos del xilema. Esa ubicación le permitiría retirar el Na+ de los vasos del xilema y reducir su transporte hacia las hojas. Los ensayos a campo comprobaron que la presencia de ese gen disminuyó la concentración de Na+ en las hojas e incrementó en 25% la producción de granos.
Pese a que el NaCl disminuyó las concentraciones de K+ en hojas a partir del cuarto día de tratamiento (Fig. 1B), éstas se mantuvieron elevadas a cabo de los 7 días de ensayo. El K+ juega un rol crucial en la activación de más de 50 enzimas, en el que no puede ser sustituido por el Na+ (Chen et al., 2005). El mantenimiento de la homeostasis Na+/K+ es crucial en la tolerancia al estrés salino y ha sido sugerida como un importante criterio de selección para la tolerancia a la salinidad (Siddiqui et al., 2009; 2012).
Meloni (2012) demostró que la acumulación de Na+ en hojas y raíces de plántulas de Prosopis ruscifolia crecidas en presencia de 400mM de NaCl puede revertirse mediante la suplementación de 5mmol l-1 de CaSO4, permitiendo un incremento en las concentraciones de K+ y en la biomasa. De este modo, la manutención de altas concentraciones de K+ en P. alba también corresponde a un mecanismo de tolerancia a la salinidad, y está asociada a homeostasis del Ca+2 en sus tejidos. Ésta podría ser una estrategia común en especies del género Prosopis en la región fitogeográfica del Chaco Occidental.
El estrés salino disminuyó la concentración NO3- al cabo de 7 días de tratamiento (Fig. 1D) Carillo, Mastrolonardo, Nacca y Fuggi, (2005) obtuvieron resultados similares en plántulas de trigo bajo condiciones de estrés salino, sugiriendo que el Cl- inhibe el ingreso del NO3- al xilema de la raíz. Alternativamente, el Cl- y el NO3- podrían competir a nivel de plasmalema o tonoplasto en las células de la hoja.
Una vez que el nitrato es absorbido debe ser reducido, antes de ser asimilado. Este paso clave en la asimilación del nitrógeno, es catalizado por la nitrato reductasa, produciendo nitrito, que posteriormente es reducido a amonio (Yousfi et al., 2012). La respuesta de la actividad NR de plántulas crecidas en presencia de NaCl, se caracterizó por un rápido incremento inicial, seguido por una importante inhibición a partir del cuarto día de tratamiento (Fig. 2A).
La disminución en la actividad NR observada a partir de cuarto día de tratamiento coincidió con una disminución en las concentraciones de nitrato (Fig. 1D). La actividad NR depende fuertemente de la concentración de nitrato, ya que el propio sustrato induce su síntesis de novo (Carillo, et al., 2005). De este modo, las respuestas a largo plazo estarían mediadas por el suministro de nitrato, que a su vez depende de la transpiración y por ende de la apertura estomática, que puede disminuir como consecuencia del estrés salino (Gong et al.,2013; Kawakami et al., 2013).
El cierre estomático, con la concomitante disminución en la fijación de CO2, es una respuesta característica de las plantas sometidas a estrés salino (Munns & Tester, 2008). Como consecuencia de ello, estas plantas suelen estar expuestas a un exceso de energía luminosa, que puede ocasionar daños en la etapa fotoquímica. De este modo, bajo condiciones naturales de crecimiento, el estrés salino es frecuentemente acompañado por estrés luminoso (Zang et al., 2012).
El estrés salino inhibió la etapa fotoquímica de la fotosíntesis en plántulas de algarrobo blanco, disminuyendo los valores de qP y aumentando NPQ (Fig. 2B, C). También se observó una marcada disminución en la tasa de transporte de electrones, a partir del quinto día de tratamiento salino (Fig. 3).
La variable qP representa la energía utilizada en la fotosíntesis, mientras que NPQ es la energía disipada como calor. Los resultados obtenidos indican que una menor proporción de energía luminosa fue utilizada en la etapa fotoquímica de la fotosíntesis, aumentando la disipación de energía como calor. Por otra parte, el aumento de los valores de NPQ indica que especie posee la capacidad de mitigar los efectos negativos del estrés a nivel de cloroplastos, ya que estas organelas tienen la capacidad de disipar el exceso de energía de excitación (Pinnola et al., 2013).
La relación Fv/Fm representa la eficiencia máxima del fotosistema II; un bajo valor de Fv/Fm indica un uso ineficiente de la energía absorbida y fotoinhibición. (Murchie & Lawson, 2013). La relación Fv/Fm disminuyó a partir del cuarto día de incubación en 500mM de NaCl (Figura 2 D), coincidiendo con un incremento en los valores de NPQ (Fig. 2C). Estos resultados indican que pese a que la especie aumentó la disipación de energía como calor, a largo plazo este mecanismo fue insuficiente para compensar los efectos deletéreos del estrés. Como consecuencia de ello se produjeron daños irreversibles en la etapa fotoquímica de la fotosíntesis, y fotoinhibición.
Se concluye que P. alba tolera concentraciones salinas equivalentes al agua de mar; como adaptaciones fisiológicas a ambientes salinos se destaca el incremento de la relación raíz/parte aérea, y las altas concentraciones foliares de K+ en dichas condiciones. La inhibición del crecimiento está dada por una disminución en la actividad nitrato reductasa y fotoinhibición.
REFERENCIAS
Ben Dkhil, B., & Denden, M. (2010). Biochemical and mineral responses of okra seeds (Abelmoschus esculentus L. variety Marsaouia) to salt and thermal stresses. Journal of Agronomy, 9, 29-37. doi:10.3923/ja.2010.29.37
Bradford, M. N. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 7, 248-254. doi:10.1016/0003-2697(76)90527-3
Bybordi, A., & Ebrahimian, E. (2011). Effect of salinity stress on activity of enzymes involved in nitrogen and phosphorous metabolism case study: Canola (Brassica napus L.). Asian Journal of Agricultural Research, 5, 208-214. doi:10.3923/ajar.2011.208.214
Carillo, P., Mastrolonardo, G., Nacca, F., & Fuggi, A. (2005). Nitrate reductase in durum wheat as affected by nitrate reduction and salinity. Functional Plant Biology, 32, 209-219. doi:10.1071/FP04184
Carillo, P., Mastrolonardo, G., Nacca, F. Parisi, D, Verlotta, A., & Fuhhi, A. (2008). Nitrogen metabolism in durum wheat under salinity: accumulation of proline and glycine betaine. Functional Plant Biology, 35, 412-426.
Carillo, P., Annunziata, M. G., & Pontecorvo, G. (2011). Salinity stress and salt tolerance. En Shanker, A & Venkateswarlu, B. (Eds.). Abiotic stress in plants. Mechanisms and adaptations, 21-38. doi:10.5772/22331
Chen, Z., Newman, L., Zhou, M., Mendham, N., Zhang, G., & Shabala, S. (2005). Screening plants for salt tolerance by measuring K+ flux: a case study for barley. Plant Cell Environment, 28, 1230-1246. doi:10.1111/j.1365-3040.2005.01364.x
Debouba, M., Maâroufi-Dghimi, H., Suzuki, A., Ghorbel, M. H., & Gouia, H. (2007). Changes in growth and activity of enzymes involved in nitrate reduction and ammonium assimilation in tomato seedlings in response to NaCl stress. Annals of Botany 99, 1143-1151. doi:10.1093/aob/mcm050
Ebrahimian, E., & Bybordi, A. (2011). Influence of different ratios of nitrate and ammonium and silicon on growth, nitrate reductase activity and fatty acid composition of sunflower under salt stress. Journal of Food, Agriculture and Envirnoment, 9, 438-443.
Ehlting, B., Dluzniewska, H., Dietrich, H., Selle, A., Teuber, M., Hänsch, R., Nehls, U., Polle, A., Schnitzler, J. P., Rennenberg, H., & Gessler, A. (2007). Interaction of nitrogen nutrition and salinity in Grey poplar (Populus tremula x alba). Plant, Cell and Environment, 30, 796-811. doi:10.1111/j.1365-3040.2007.01668.x
Giménez, A. M., &. Moglia, J. G. (2003). Árboles del Chaco Argentino. Guía para el reconocimiento dendrológico. Secretaría de ambiente y desarrollo sustentable – Facultad de Ciencias Forestales UNSE. Argentina.
Gong, B., Wen, D., Vanden Langenberg, K., Wei, M., & Yang, F. (2013). Comparative effects of NaCl and NaHCO3 stress on photosynthetic parameters, nutrient metabolism, and antioxidant system in tomato leaves. Scientia Horticulturae, 157, 1-12. doi:10.1016/j.scienta.2013.03.032
Kawakami, E. M., Osterhuis, D. M. & Snider, J. L. (2013). Nitrogen assimilation and growth of cotton seedlings under NaCl salinity and in response to urea application with NBPT and DCD. Journal of Agronomy and Crop Science, 199, 106-117. doi:10.1111/jac.12002
Klepper, L., Flesher, D., & Hageman, R. H. (1971). Generation of reduced Nicotinamide Adenine Dinucleotide for nitrate reduction in green leaves. Plant Physiology, 20, 580-590. doi:10.1104/pp.48.5.580
Magalhães de Aragão, R., Silva, J. S., Lima, C. S., &. Silveira, J. A. G. (2011). Salinidade modula negativamente a absorção e assimilação de NO3- em plantas de feijão de corda. Revista Ciência Agronômica, 42, 382-389. doi:10.1590/S1806-66902011000200017
Malavolta, E., Vitti, G. C., &. Oliveira, S. A. (1989). Avaliação do estado nutricional das plantas: princípios e aplicações. Associação Brasileira para a Pesquisa da Potassa e do Fosfato, Piracicaba, Brasil.
Maxwell, K., & Johnson, G. N. (2000). Chlorophyll fluorescenceea practical guide. Journal of Experimental Botany, 51, 659-668. doi:10.1093/jexbot/51.345.659
Meloni, D. A., Gulotta, M. R., & Martínez, C. A. (2008). Salinity tolerance in Schinopsis quebracho colorado: seed germination, growth and metabolic responses. Journal of Arid Environments, 72, 1785-1792. doi:10.1016/j.jaridenv.2008.05.003
Meloni, D. A., & Matínez, C. A. (2009). Glycinebetaine improves salt tolerante in vinal (Prosopis ruscifolia Griesbach) seedlings. Brazilian Journal of Plant Physiology, 21, 233-241. doi:10.1590/S1677-04202009000300007
Meloni, D. A. (2012). Respuestas fisiológicas a la suplementación con calcio de plántulas de vinal (Prosopis ruscifolia G.) estresadas con NaCl. Revista de Ciencias Agrarias Universidad Nacional de Cuyo, 44, 79-88.
Meloni, D.A., Silva, D. M., & Bolzón, G. (2015). Efectos de la adición de calcio sobre la fisiología de plántulas de vinal (Prosopis ruscifolia G.) bajo estrés salino. Revista de Ciencias Forestales Quebracho, 23, 8-17.
Miura, K. (2013). Nitrogen and phosphorous nutrition under salinity stress. En: Ahmad, P., Azooz, M. M., & Prasad, M. N. V. (Eds.) Ecophysiology and responses of plants under salt stress, (pp, 425-441). Springer, Germany.
Munns, R., & Tester, M. (2008). Mechanisms of salinity tolerance. Annual Review of Plant Biology, 59, 651-681. doi:10.1146/annurev.arplant.59.032607.092911
Munns, R., James, R. A, Xu, B., Athman, A., Conn, S. J., Jordans, C., Byrt, C. S., Hare, R. A., Tyerman, S. D., Tester, M., Plett, D., &. Gilliham, M. (2012). Wheat grain yield on saline soils is improved by an ancestral Na+ transporter gene. Nature, 30, 360-366. doi:10.1038/nbt.2120
Naumann, J. C., Young, D. R., & Anderson, J. E. (2007). Linking leaf chlorophyll fluorescence properties to physiological responses for detection of salt and drought stress in coastal plant species. Physiologia Plantarum, 131, 422-433. doi:10.1111/j.1399-3054.2007.00973.x
Murchie, E. H., & Lawson, T. (2013). Chlorophyll fluorescence analysis: a guide to good practice and understanding some new applications. Journal of. Experimental Botany, 64, 3983-3998. doi:10.1093/jxb/ert208
Pinnola, A., Dall’Osto, L., Gerotto, C., Morosinotto, T., Bassi, R., & Alboresi, A., (2013). Zeaxanthin binds to light-harvesting complex stress-related protein to enhance nonphotochemical quenching in Physcomitrella patens. Plant Cell. 25, 3519-3534. doi:10.1105/tpc.113.114538
Reda, M., Migocka, M., & Klobus, G. (2011). Effect of short-term salinity on the nitrate reductase activity in cucumber roots. Plant Science, 180, 783-788. doi:10.1016/j.plantsci.2011.02.006
Reginato, M., Sgroy, M., Llanes, A., Cassán, F., & Luna, V. (2012). The american halophyte Prosopis strombulifera, a new potential tool to confer salt tolerance to crops. En: Crop production for agricultural improvement. (pp, 136-167). Springer, Berlin.
Siddiqui, M. H., Mohammad, F., &. Khan, M. N. (2009). Morphological and physio-biolochemical characterization of Brassica juncea L. Ccem. & Coss, genotypes under salt stress. Journal of Plant Interactions, 4, 67-80. doi:10.1080/17429140802227992
Siddiqui, M. H., Mohammad, F., Khan, M. A. A., Mohamed, H., & Al-Whaibi, H. (2012). Cumulative effect of nitrogen and sulphur on Brassica juncea L. genotypes under NaCl stress. Protoplasma, 249, 139-253. doi:10.1007/s00709-011-0273-6
Silva, M. C., Gulotta, M. R., Cisneros, A. B., Bravo, E., Ledesma, R., & Meloni, D. A. (2013). Ajuste osmótico en algarrobo blanco (Prosopis alba G.) bajo condiciones de estrés salino. XXX Jornadas Científicas, Asociación de Biología de Tucumán, Argentina.
Yousfi, S., Serret, M. D., Márquez, A. J., Voltas, J., & Araus, J. L. (2012). Combined use of δ13C, δ18O and δ15N tracks nitrogen metabolism and genotypic adaptation of durum wheat to salinity and water deficit. New Phytologist, 194, 230-244. doi:10.1111/j.1469-8137.2011.04036.x
Velarde, M., Felker, P., & Degano, C. (2003). Evaluation of Argentine and Peruvian Prosopis germoplasm for growth at seawater salinities. Journal of Arid Environments, 55, 515-531. doi:10.1016/S0140-1963(02)00280-X
Zhang, Q. Y., Wang, L. Y., Kong, F. Y., Deng, Y. S., Li, B., &. Meng, W. (2012). Constitutive accumulation of zeaxanthin in tomato alleviates salt stress-induced photoinhibition and photooxidation. Physiologia Plantarum, 146, 363-373. doi:10.1111/j.1399-3054.2012.01645.x