Las mariposas del género Morpho, son exclusivas del Neotrópico, Morpho helenor es una de las mariposas tropicales más atractivas, por su coloración azul metálico y por su tamaño (64-74mm) (DeVries, 1987; Corrales, 1999).
La mariposa Morpho helenor no está incluida en ninguna categoría de conservación (CITES, 2016). Tampoco está incluida en el Convenio de Conservación de Especies Silvestres Migratorias (CMS, 2016) y en la Lista Roja de Especies Amenazadas de la UICN no ha sido evaluada (UICN, 2016).
Morpho helenor es una especie de mariposa polífaga, esta puede alimentarse de: Lonchocarpus guatemalensis, L. oliganthus, Machaerium acuminatum, M. biovulatum, M. regelii, M. floribundum, Andira inermis, Heteropteris laurifolia, Platymiscum parviflorum, Dalbergia retusa, Dioclea wilsoni, Mucuna sp (Young, 1978; DeVries, 1987; Corrales ,1999; Janzen & Hallwachs, 2001).
La dependencia de las orugas hacia plantas hospederas específicas, combinada con la función de los adultos como polinizadores de algunas plantas, liga estrechamente a las mariposas con la diversidad y estado de su hábitat natural (Young & Muyshondt, 1973).
Las mariposas adultas localizan las fuentes de alimento y las plantas hospederas adecuadas para la oviposición, por medio de estímulos olfativos (Visser, 1986). A partir de olores volátiles recogidos de las hojas, las hembras pueden ser estimuladas para poner sus huevos (Sourakov, Duehl & Sourakov, 2012).
Las orugas de mariposas almacenan y distribuyen las sustancias necesarias para el crecimiento en la etapa adulta, gracias a los compuestos extraídos de las plantas hospederas (Telang, Booton, Chapman & Wheeler, 2001; Fischer, O’Brien & Boggs, 2004; Claro & Ruiz, 2010).
Las dietas artificiales han sido estudiadas con lepidópteros de la familia Noctudiae. (Hervet, Laird & Floate, 2016), Phyciodes phaon (Nymphalidae) (Hanife & Nation, 2004) y en Battus polydamas polydamas (Nymphalidae) (Claro & Ruiz, 2010).
Se eligió evaluar las plantas alimenticias de Arachis pintoi, Erythrina berteroana y Lonchocarpus oliganthus para validar la hipótesis que existe entre los productores de mariposas donde algunos suponen que las dos primeras plantas son mejores para producir Morpho helenor, que Lonchocarpus oliganthus. En esta investigación se estudió una nueva alternativa en la producción de pupas Morpho helenor (Nymphalidae), utilizando plantas silvestres e introducidas, adicionando un suplemento vitamínico como dieta artificial, para evaluar en las orugas: el desarrollo en cada estadio larval, tasa de sobrevivencia, calidad y cantidad de las pupas de Morpho helenor (Nymphalidae), bajo condiciones de laboratorio.
METODOLOGÍA
La investigación se realizó durante los meses de agosto del 2011 a enero del 2012, en el laboratorio del mariposario EcoTEC, del Instituto Tecnológico de Costa Rica (TEC), Sede Santa Clara, ubicado en la provincia de Alajuela, Cantón San Carlos, Distrito Florencia, caserío de San Clara, en las coordenadas 10°21’52.9 N y 84°31’28.4” W, a una altitud de 185m.s.n.m., en una zona de vida de Bosque Tropical Húmedo de Premontano (Hartshon, 1991).
En el experimento se usó tres especies de plantas alimenticias de la familia Fabaceae: Lonchocarpus oliganthus, la cual es una especie nativa silvestre y fue la planta control, Erythrina berteroana y Arachis pintoi, Estas plantas fueron sembradas con antelación cerca del laboratorio, en recipientes plásticos de 5L de capacidad y criadas en un vivero cerrado con malla de sarán negro, con una luminosidad del 50%. Las plantas se dividieron en dos grupos para evitar que cuando se aplique el suplemento vitamínico no se mezclen con las que no poseen suplemento.
Antes de colocar las orugas en las plantas alimenticias, a un grupo de tres plantas alimenticias (Lonchocarpus oliganthus, Erythrina berteroana y Arachis pintoi) se le agregó un suplemento vitamínico comercial llamado Farvital – 18, para potenciar los nutrientes en las plantas, este suplemento está compuesto por aminoácidos, vitaminas y electrolitos.
El suplemento se aplicó cada tres días con un atomizador manual, en una concentración de 25 gotas por litro, la escogencia de la concentración se realiza según pruebas anteriores y previniendo que las orugas no se intoxiquen, la planta debe quedar completamente húmeda. Para completar el ensayo se debe disponer de otras tres plantas alimenticias de las especies antes indicadas, pero a estas no se le agrega nada, las cuales formaran el grupo de plantas alimenticias sin suplemento vitamínico.
Para homogenizar el experimento, se usó orugas con no más de 24 horas de haber eclosionado entre una y otra. A cada especie de planta alimenticia se le colocó un total de 25 orugas de Morpho helenor.
Cada especie de planta alimenticia con suplemento vitamínico y sin suplemento, fueron colocadas individualmente en cajas de 50 x 50 x 90cm, con marco de madera y forradas con malla sarán de 32 x 32 huecos por pulgada cuadrada, las cajas poseen una puerta en uno de sus costados para manipular las plantas y a las orugas. Las plantas fueron remplazadas cuando presentaban poco follaje, para no manipular las orugas con la mano, se cortó la hoja donde estaba la oruga y se colocó en la nueva planta. Las orugas tuvieron acceso al alimento at libitum.
Las cajas se distribuyeron al azar dentro del laboratorio, para cada repetición se requiere seis cajas y se realizaron 4 repeticiones. Para esta investigación se requirió un total de 600 orugas.
Se utilizó la cápsula cefálica como unidad de medición, para determinar el tamaño de la oruga (Antunes, Menezes Jr.,Tavares & Moreira, 2002; Irigaray, Moreno, Pérez Moreno & Marco, 2006). Se recolectaron las cápsulas cefálicas cada tres días y se anotó la fecha del evento, se midió el ancho de la cápsula cefálica con un calibrador (± 0,01mm) en cada uno de sus estadios.
Se evaluó la tasa de supervivencia de las orugas en cada uno de los estadios larvales, se realizaron conteos de las orugas vivas cada tres días. Las orugas muertas no fueron reemplazadas.
Para determinar cuántos días tarda cada oruga en lograr llegar al estadio de pupa, en cada uno de los tratamientos, se midieron las variables establecidas desde el día que son colocadas las orugas en la planta hospedera, hasta el día que se transforma completamente la pupa. Veinticuatro horas después de formada la pupa, se pesó individualmente en una balanza electrónica (± 0,02g).
Para evaluar de la calidad de la pupa, se utilizaron dos criterios: pupas que logran formarse correctamente, se adhieren bien a su seda y no presentan ningún daño en su cutícula son de calidad A y pupas que logran su formación, pero posee algún daño en su cutícula son calidad B.
El sexo se determinó por medio de los órganos genitales externos del adulto, esto se realizó después de que emergió el adulto de la pupa.
Se registró la temperatura dentro y fuera de los cajones, cada tres días entre las diez de la mañana y las dos de la tarde, como también, la humedad relativa, para determinar las condiciones climáticas en el momento del experimento.
El análisis de los datos se realizó por medio del programa InfoStat-Statistical. Para la calidad de las pupas se realizará por medio de tabla de contingencia Chi-cuadrada. Para determinar el efecto del alimento en cada estadio larval, la tasa de crecimiento de la oruga, supervivencia de las orugas, peso las pupas, se realizaron un análisis de varianza (ANDEVA). Para determinar los días que tarda la mariposa en estado de pupa según el sexo y la diferencia de peso de la pupa según el sexo, se utilizó la prueba de T-student. Todas con un nivel de significancia del 0,05.
RESULTADOS
La temperatura media durante el experimento dentro de los cajones, donde estaban las orugas y la planta alimenticia fue de 27,4°C, con una mínima promedio de 23,4°C y una máxima de 31,3°C, la humedad relativa promedio fue de 67,6%. Con una humedad mínima promedio de 47,6% y la humedad máxima promedio fue de 84,6%
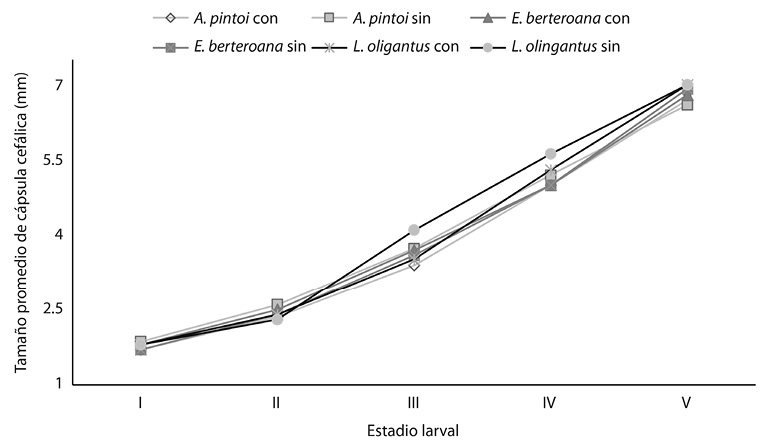
Las orugas alimentadas con Arachis pintoi sin suplemento vitamínico, en el I estadio larval, produjeron capsulas cefálicas de mayor tamaño (ANDEVA: p = 0,0016; gl = 2; = 1,84mm; D.E. = 0,17) (Fig. 1).
Durante el II estadio larval Lonchocarpus oliganthus, provoco que las capsulas cefálicas de las orugas tuvieron un menor crecimiento (ANDEVA: p = 0,0066; gl =2; = 2,40mm; D.E. = 0,28) y el suplemento vitamínico no provocó ningún efecto (ANDEVA: p = 0,4420; gl =1).
Para el III estadio larval las orugas alimentadas con Lonchocarpus oliganthus sin suplemento vitamínico presentaron un mayor crecimiento (ANDEVA: p = 0,0209; gl =2; = 4,00mm; D.E. = 0,53).
En el IV estadio larval, las orugas alimentadas con la planta Lonchocarpus oliganthus (ANDEVA: p < 0,0001, gl = 2;) sin ( = 5,56mm, D.E. 0,34) y con (
= 5,26mm, D.E. 0,36) produjeron capsulas cefálicas de mayor tamaño. En el V estadio larval se mantuvo el mismo patrón para esta planta (ANDEVA: p < 0,0001; gl =2) con (
= 7,04mm, D.E. 0,37) y sin (
=5,03 mm, D.E. 0,40) suplemento vitamínico. (Fig. 1).
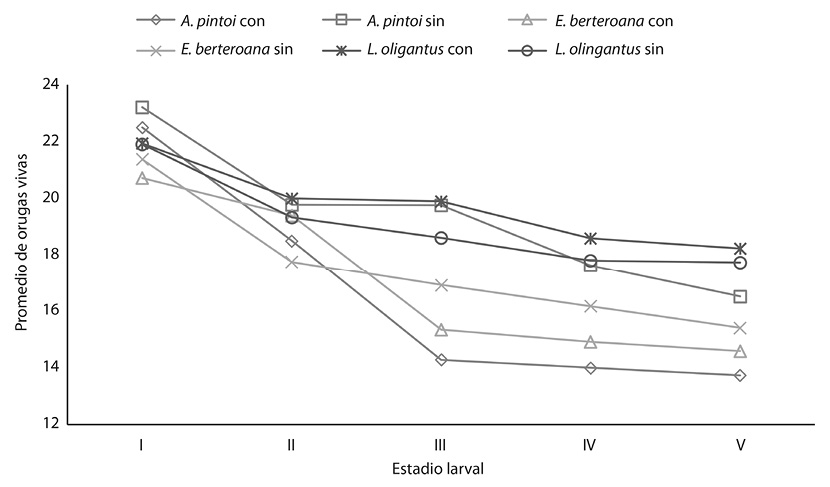
La supervivencia de las orugas de Morpho helenor en el I estadio larval no se evidencio ningún efecto, en ninguno de los tratamientos a que fueron sometidas (ANDEVA: p = 0,0739, gl = 2), lo mismo ocurrió en el II estadio larval (ANDEVA: p = 0,6754; gl = 2).
Durante el III estadio la planta Lonchocarpus oliganthus con suplemento vitamínico fue la que presento una sobrevivencia mayor (ANDEVA: p < 0,0001, gl = 2; = 19,90 larvas; D.E. = 1,45).
Para el IV estadio larval, la tasa de sobrevivencia de las orugas fue mayor en la planta Lonchocarpus oliganthus (ANDEVA; p < 0,0001; gl = 2); con ( = 18,58 larvas; D.E. 1,38) y sin (
= 17,80 larvas; D.E. 1,69) suplemento vitamínico. En el V estadio larval se mantuvo el mismo patrón para esta misma planta (ANDEVA: p < 0,0001; gl =2) con (
= 18,23 larvas, D.E. 2,09) y sin (
= 17,73 larvas, D.E. 1,39) suplemento vitamínico. (Fig. 2).
Las orugas alimentadas con Arachis pinto sin suplemento vitamínico fueron las que demoraron menos días en completar el I estadio larval (ANDEVA: p = <0,0001; gl = 2; = 6,53 días; D.E. = 1,44), el mismo comportamiento se dio en el II estadio larval (ANDEVA: p = <0,0001; gl = 2;
= 13,81 días; D.E. = 2,54).
Para el III estadio larval las orugas alimentadas con Lonchocarpus oliganthus con suplemento vitamínico, fueron las que tardaron menos días en completar este estadio (ANDEVA: p = <0,0001; gl = 2; = 19,17 días; D.E. = 2,66).
Durante el IV estadio larval las orugas alimentadas con Lonchocarpus oliganthus (ANDEVA: p = <0,0001, gl = 2) sin (29,56 días; D.E. = 2,14) y con ( = 29,83 días; D.E. = 3,20) suplemento vitamínico, tardaron menos días en alcanzar este estadio. En el V estadio larval se mantuvo este comportamiento para la misma planta (ANDEVA: p = <0,0001, gl = 2) con (
= 35,44 días; D.E. = 1,07) y sin (
= 37,23 días; D.E. = 1,32) suplemento vitamínico (Cuadro 1).
Los machos en promedio tardaron menos días en eclosionar de la pupa ( = 14,18 días; D.E = 1,42), que las hembras (
= 14,72 días; D.E = 1,64) (T-student: p = 0,0008; gl = 1).
Los machos alimentados con Lonchocarpus oliganthus, tardaron menos días en eclosionar de la pupa (ANDEVA: p = 0,0073; gl = 2; = 13,81 días; D.E. = 1,28), que los demás machos, el suplemento vitamínico no provocó ningún efecto (ANDEVA: p = 0,5039; gl = 2) (Cuadro 2). En las hembras no se dio ninguna diferencia significativa en los días que dura en eclosionar de la pupa, debido a la alimentación recibida (ANDEVA: p = 0,2191; gl = 2), tampoco se encontró ningún efecto del suplemento vitamínico (ANDEVA: p = 0,0596; gl = 2).
CUADRO 2
Días promedio que tardo en eclosionar la pupa de Morpho helenor según la alimentación recibida y el sexo.
|
Planta |
Suplemento |
Días en pupa |
|
|
Macho |
Hembra |
||
|
Arachis pintoi |
Presente |
14,82 |
15,20 |
|
Ausente |
14,14 |
15,05 |
|
|
Erythrina berteroana |
Presente |
13,97 |
14,00 |
|
Ausente |
14,70 |
15,26 |
|
|
Lonchocarpus oliganthus |
Presente |
13,66 |
14,32 |
|
Ausente |
13,97 |
14,76 |
|
De 600 orugas iniciales usadas en esta investigación, se produjeron un total de 371 pupas, para un rendimiento del 61,83%. De estas el 88%, fueron pupas de primera calidad (calidad A), y el 12% fueron pupas con algún daño estructural (calidad B) (Cuadro 3), estas proporciones son significativamente diferentes (Chi cuadrado: p < 0.0001, gl = 1, n = 358). Del total de pupas formadas el 3,63% no lograron eclosionar por diferentes motivos tales como: justo en el momento de eclosionar la mariposa se cae o por su mala formación no logran eclosionar
Entre los días 14 y 15 de haberse formado la pupa, es cuando se da la mayor eclosión de mariposas, independientemente de la calidad de pupa. Existiendo diferencias significativas en los intervalos de eclosión (Chi cuadrado: p = 0.0413, gl = 1).
La clase de alimento recibido por las orugas, no afecto la producción de pupas de calidad A (Chi cuadrado: p = 0.6966, gl = 2) ni a la calidad B (Chi cuadrado: p = 0.6903, gl = 2).
Las pupas de Morpho helenor que produjeron machos en promedio son menos pesadas ( =2,50g; D.E = 0,29), que las hembras (
= 3,37g; D.E = 0,42), existiendo una diferencia significativa en la relación del peso de los machos con respecto a las hembras (T-student: p < 0.0001; gl = 1).
Las orugas alimentadas con planta de Arachis pintoi, produjeron pupas de machos de menor peso, sin suplemento vitamínico ( = 2,36 g; D.E. = 0,22) y con (
= 2,40 g; D.E. = 0,30), siendo significativamente diferentes a los otros tratamientos (ANDEVA: p < 0,0001; gl = 2). Este tratamiento, provoco el mismo efecto en las pupas de hembras alimentadas con A. pintoi con (
= 3,13 g; D.E. =0,10) y sin (
= 3,20 g; D.E. = 0,06) suplemento vitamínico (ANDEVA: p < 0,0001; gl = 2).
DISCUSIÓN
El tamaño de la capsula cefálica para las orugas de Morpho helenor utilizadas en esta investigación fueron influenciadas por la alimentación, al igual que lo mencionado por otros autores (Savopoulou-Soultani & Tzanakakis, 1990; Goldson, McNeill, Proffitt & Baird, 2001; Pappers, Dommelen, Velde & Ouborg, 2001). Otros factores que pueden influenciar en el crecimiento de los insectos son la temporada, la generación, el parasitismo, sexo y temperatura (Nealis, 1987; Margaix & Garrido, 2000; Frouz, Ali & Lobinske, 2002).
Las cápsulas cefálicas de muchas especies de mariposas no presentan solapamiento en el tamaño, según el estadio, poseen un crecimiento geométrico entre los estadios (Antunes et al., 2002), (Kaminski, Tavares, Ferro & Moreira, 2002; Tavares, Kaminski, & Moreira, 2002) similar a lo encontrado en esta investigación para Morpho helenor, donde el crecimiento de la cápsula cefálica aumentó conforme la oruga cambia de estadio.
En un estudio realizado por Young (1978) con Morpho peleides (Morpho helenor) en Estados Unidos con huevos de mariposas producidos en Costa Rica, los tamaños de las cápsulas cefálicas fueron menores a las encontradas en esta investigación, independientemente del tratamiento al que fueron sometidas.
El ciclo larval de Morpho helenor fue estudiado por Ortiz-Martinez, Morales-Velasco, Tobar-Mesa (2015) y determinaron que en los cinco estadios larvales tardó 86 días, a una temperatura promedio de 23,5°C. En esta investigación el desarrollo del ciclo larval fue considerablemente más rápido, ya que tardó en promedio de 35 a 39 días a una temperatura promedio de 27,4°C.
El tiempo que tardan las orugas en estadio larval ha sido estudiado en varias especies del genero Mopho tales como: Morpho rhodopteron nevadensis que tarda un total de 157 días (Montero & Ortiz, 2010); Morpho menelaus godartii, dura entre 145 a 160 días (Guerra Serrudo & Ledezma Arias, 2008); Morpho amathonte tiene un ciclo larval de 87 días (Constantino, 1997); Morpho macrophthalmus tardó 49 días y M. peleides telamon 42 días (Constantino & Corredor, 2004).
Las composiciones químicas de las plantas alimenticias pueden influenciar en el desarrollo de los insectos, de acuerdo a su efecto en el comportamiento de los insectos (Claro, Correa, Duque & Ruiz, 2007). En esta investigación el tamaño de las orugas fue influenciado por el alimento recibido, concordando con lo que propone Hochuli (2001) y Ojeda Avila, Wood & Raguso (2003).
Las pupas de Morpho helenor tardan entre 13 y 15 días en ese estadio (Young, 1978; Constantino & Corredor, 2004), siendo igual a lo determinado en esta investigación. En otras especies de la subfamilia Morphinae puede variar, por ejemplo: Moprho macrophthalmus y M. peleides el estadio de pupa tarda 14 días, para ambas especies, en Morpho menelaus gordartii, tarda en pupa de 23 a 35 días (Guerra Serrudo & Ledezma Arias, 2008). La mariposa Morpho amathonte dura en pupa 19 días (Constantino, 1997) y Caligo illioneus tiene un intervalo entre los 13 y 15 días en estadio de pupa, (Penez, Aiello & Srygley, 1999), semejante al encontrado en esta investigación para Morpho helenor.
El alimento en la etapa inmadura de los insectos influirá en la variación de peso, el tiempo para el desarrollo, supervivencia y tamaño del adulto (Felipe & Zucoloto, 1993). En esta investigación esto se reflejó en la producción de pupas ya que la mayoría fueron de calidad A.
Las mariposas en la naturaleza logran llegar al estado adulto alrededor de 5%, pero cuando se crían en condiciones controladas o cautiverio se puede lograr que entre 85 y 95% logren ser adultos (Constantino, 1996), en nuestra investigación, se logró un promedio general del 61,83%, independiente de la planta alimenticia o del tratamiento. Sin embargo, la producción de pupas de Morpho helenor en plantas Lonchocarpus oliganthus, presentaron un promedio de 69% inferior a los rangos mencionados por Constantino (1996).
El porcentaje de producción de pupas calidad A de Morpho helenor obtenidas en esta investigación (88%), fue semejante al encontrado por Calvo (1999), para la mariposa Caligo atreus (90,2%).
Se determinó dimorfismo sexual en las pupas de Morpho helenor, donde las hembras son más pesadas que los machos, similar a lo que se encontró para: Tecia solanivora (Lepidoptera: Gelechiidae), (Rincón Rueda & López-Ávila, 2004); Oiketicus platensis (Lepidoptera: Psychidae) (Urretabizkaya, Vasicek & Saini, 2010); y Cydia pomonella (Lepidoptera: Tortricidae), (Fernández, 2012).
La planta control Lonchocarpus oliganthus con y sin suplemento vitamínico dio mejores resultados en la producción de mariposas Morpho helenor, comparadas con Arachis pintoi y Erythrina berteroana. Por lo tanto, se recomienda a los productores de mariposas, alimentar las orugas de Morpho helenor con Lonchocarpus oliganthus, para obtener mejores resultados en sus producciones. El uso del suplemento vitamínico no provocó ningún efecto en la producción de pupas de Morpho helenor, por lo que no se recomienda usarlo en la concentración analizada.
AGRADECIMIENTOS
Al Instituto Tecnológico de Costa Rica, Sede de Santa Clara de San Carlos y al director de la Escuela de Agronomía en ese momento Arnoldo Gadea Rivas, por permitir hacer esta investigación en el proyecto EcoTEC.
REFERENCIAS
Antunes, Fabiano. F., Menezes Jr., A.,Tavares, M., & Moreira, Gilson. R. P. (2002). Morfologia externa dos estágios imaturos de heliconíneos neotropicais: I. Eueides isabella dianasa (Hübner, 1806). Revista Brasileira de Entomologia, 46, 601-610. doi:10.1590/S0085-56262002000400016
Calvo, R. (1999). Éxito reproductivo de Caligo atreus (Lepidoptera: Nimphalidae) en condiciones de cultivo. Biología Tropical, 47, 539-544.
CITES. (2016). Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres. Recuperado de https://cites.org/esp/app/appendices.php
Claro, R. A., & Ruiz, N. (2010). Aceptación de una dieta artificial por orugas de la mariposa Battus polydamas (Lepidoptera: Papilionidae). Acta Biológica Colombiana, 15, 47-62.
Claro, R. A., Correa, C., Duque, C., & Ruiz, N. (2007). Aproximación al estudio de la interacción entre Aristolochia maxima y larvas de las mariposas Battus polydamas y Parides panares erythrus mediada por ácidos aristoloquicos. Acta Biológica Colombiana, 12, 59-68.
CMS. (2016). Convention on the Conservation of Migratory Species of Wild Animals. Recuperado de http://www.cms.int/
Constantino, L. M., & Corredor, G. (2004). The biology and morphology of the early stages of Morpho macrophthalmus and Morpho peleides telamon (Nymphalidae: Morphinae) from western Colombia. Boletín Científico del Centro de Museos de la Universidad de Caldas, 8, 201-208.
Constantino, L. M. (1996). Ciclo de vida y plantas hospederas de lepidópteros diurnos con potencial económico en condiciones de colinas bajas del Chocó biogeográfico. Seminario sobre Investigación y Manejo de Fauna para la Construcción de Sistemas Sostenibles (CIPAV). Cali, Colombia, 75-86.
Constantino, L. M. (1997). Natural history, immature stages and hostplant of Morpho amathonte from western Colombia (Lepidoptera: Nymphalidae: Morphinae). Tropical Lepidoptera, 8, 75-80.
Corrales, J. M. (1999). Mariposas comunes del Área de Conservación Tempisque. Heredia, Costa Rica: INBio,
DeVries, P. J. (1987). The Butterflies of Costa Rica, and Their Natural History. Nueva Jersey, Estados Unidos: Princeton.
Felipe, M. C., & Zucoloto, F. S. (1993). Alguns aspectos de estudos da alimentação em Ascia monuste Godart (Lepidoptera, Pieridae). Revista Brasileira de Zoología, 10, 333-341. doi:10.1590/S0101-81751993000200011
Fernández, E. (2012) Cydia pomonella (L.) (Lepidoptera: Tortricidae). Aspectos de su taxonomía, comportamiento y monitoreo aplicados a programas de control en grandes áreas: (Memoria para optar por el grado de Doctor, ingeniero agrónomo) Universidad de Lleida, Escuela Técnica Superior de Ingeniería Agraria. España.
Fischer, K., O’Brien, D. M., & Boggs, C. L. (2004). Allocation of larval and adult resources to reproduction in a fruit-feeding butterfly. Funtional Ecology, 18, 656-663. doi:10.1111/j.0269-8463.2004.00892.x
Frouz, J., Ali, A., & Lobinske, R. J. (2002). Influence of temperature on developmental rate, wing length, and larval head capsule size of pestiferous midge Chironomus crassicaudatus (Diptera: Chironomidae). Journal of Economic Entomology, 95, 699-705. doi:10.1603/0022-0493-95.4.699
Goldson, S. L., McNeill, M. R., Proffitt, J. R., & Baird, D. B. (2001). Seasonal variation in larval-instar head-capsule sizes of Argentine stem weevil, Listronotus bonariensis (Kuschel) (Coleoptera: Curculionidae). Australian Journal of Entomology, 40, 371-375. doi:10.1046/j.1440-6055.2001.00241.x
Guerra Serrudo, J. F., & Ledezma Arias, J. (2008). Biología y morfología de Morpho menelaus godartii (Lepidoptera: Nymphalidae: Morphinae) en el Parque Nacional Cotapata (Bolivia). Ecología en Bolivia, 43, 16-28.
Hanife, G., & Nation, J. L. (2004). An artificial diet for the butterfly Phyciodes phaon (Lepidoptera: Nymphalidae). Florida Entomologist, 87, 194-198. doi:10.1653/0015-4040(2004)087[0194:AADFTB]2.0.CO;2
Hartshorn G.S. (1991). Plantas. P. 119-160 In Janzen D.H. (ed). Historia Natural de Costa Rica. San José, Costa Rica: EUCR.
Hervet, V. A., Laird, R. A., & Floate, K. D. (2016). A Review of the McMorran Diet for Rearing Lepidoptera Species with Addition of a Further 39 Species. Journal of Insect Science, 16, 1-7. doi:10.1093/jisesa/iev151
Hochuli, D. F. (2001). Insect herbivory and ontogeny: How do growth and development influence feeding behavior, morphology and host use?. Austral Ecology, 26, 563-57. doi:10.1046/j.1442-9993.2001.01135.x
Irigaray, J. F., Moreno, F., Pérez Moreno, F., & Marco, V. (2006). Larval Growth and the Effect of Temperature on Head Capsule Size in Lobesia botrana (Lepidoptera: Tortricidae). Environmental Entomology, 35, 189-193. doi:10.1603/0046-225X-35.2.189
Janzen, D. H., & Hallwachs, W. (2011, 16 de agosto). Base dinámica de datos de un inventario de la fauna macrocaterpillar y sus plantas alimenticias y parasitoides, del Área de Conservación Guanacaste (ACG), al Noroeste de Costa Rica. Orugas, crisálidas, mariposas y polillas. Recuperado de http://janzen.sas.upenn.edu/
Kaminski, L. A., Tavares, M., Ferro, V. G., & Moreira, G. R. P. (2002). Morfologia externa dos estágios imaturos de heliconíneos neotropicais: III. Heliconius erato phyllis (Fabricius) (Lepidoptera, Nymphalidae, Heliconiinae). Revista Brasileira de Zoologia, 19, 977-993. doi:10.1590/S0101-81752002000400003
Margaix, A., & Garrido, A. (2000). Efecto de temperaturas constantes en el desarrollo de Phyllocnistis citrella Stainton (Lepidoptera: Gracillariidae). Boletín de sanidad vegetal. Plagas, 26, 277-283
Montero A. F., & Ortiz Pérez, M. (2010). Descripción de los estados inmaduros de Morpho rhodopteron nevadensis (lepidoptera: Nymphalidae: Morphinae). Tropical Lepidoptera Research, 20, 73-78.
Nealis, V. (1987). The number of instars in jack pine budworm, Choristoneura pinus pinus Free (Lepidoptera: Tortricidae), and the effect of parasitism on head capsule width and development time. The Canadian Entomologist, 119, 773-777. doi:10.4039/Ent119773-9
Ojeda Avila, T.; Wood, H. A., & Raguso, R. A. (2003). Effects of dietary variation on growth, composition, and maturation of Manduca sexta (Sphingidae: Lepidoptera). Journal of Insect Physiology, 49, 293-30. doi:10.1016/S0022-1910(03)00003-9
Ortiz-Martinez, M. A., Morales-Velasco, S., & Tobar-Mesa, J. M., 2015. Fenología de dos plantas nutricias, Centrosema triquetrum y Rorippa indica, para producción comercial de mariposas en la reserva Paway, en el Municipio de Mocoa (Putumayo). Revista Luna Azul, 41, 116-130. doi:10.17151/luaz.2015.41.7
Pappers, S. M., Dommelen, H., Velde, G., & Ouborg, J. N. (2001). Differences in morphology and reproductive traits of Galerucella nymphaeae from four host plant species. Entomologia experimentalis et applicata, 99, 183-191. doi:10.1046/j.1570-7458.2001.00816.x
Penez, C. M., Aiello, A., & Srygley, R. B. (1999). Early stages of Caligo illioneus and C. idomeneus (Nymphalidae, Brassolinae) from Panamá, with remark on larval food plant for the subfamily. Journal of the Lepidopterists Society, 53, 142-152.
Rincón Rueda, D. F. & López-Ávila A. (2004). Dimorfismo sexual en pupas de Tecia solanivora (Povolný) (Lepidoptera: Gelechiidae). Revista Corpoica, 5, 41-42
Savopoulou-Soultani, M., & Tzanakakis, M. E. (1990). Head-Capsule Width of Lobesia botrana (Lepidoptera: Tortricidae) Orugae Reared on Three Different Diets. Entomological Society of America, 83, 555-558. doi:10.1093/aesa/83.3.555
Sourakov, A., Duehl, A., & Sourakov, A. (2012). Foraging behavior of the blue morpho and other tropical butterflies: the chemical and electrophysiological basis of olfactory preferences and the role of color. Psyche: A Journal of Entomology, 2012, 1-10. doi:10.1155/2012/378050
Tavares, M., Kaminski, L. A., & Moreira, G. R. (2002). Morfologia externa dos estágios imaturos de heliconíneos neotropicais: II. Dione juno juno (Cramer) (Lepidoptera, Nymphalidae, Heliconiinae). Revista Brasileira de Zoologia, 19, 961-976. doi:10.1590/S0101-81752002000400002
Telang, A., Booton, V., Chapman, R. F., & Wheeler, D. E. (2001). How female caterpillars accumulate their nutrient reserves. Journal of Insect Physiology, 47, 1055-1064. doi:10.1016/S0022-1910(01)00085-3
UICN. (2016). Unión Internacional para la Conservación de la Naturaleza (UICN). Recuperado de http://www.iucnredlist.org/search
Urretabizkaya, N., Vasicek, A., & Saini, E. (2010) Insectos Perjudiciales de Importancia Agronómica I. Lepidópteros. Buenos Aires, Argentina: Instituto Nacional de Tecnología Agropecuaria,
Visser, J. H. (1986). Host odor perception in phytophagous insects, Annual Review of Entomology, 31, 121–144. doi:10.1146/annurev.en.31.010186.001005
Young, A. M. (1978). Studies on the ineractions of Moprho peleides (Morphidae) with Leguminosae. Journal the Lepidopterits Society, 32, 65-74.
Young, A. M., & Muyshondt, A. (1973). Notes on the biology of Morpho peleides in Central America. Caribbean Journal of Science, 13, 1-49.