En los últimos años se están presentando fenómenos naturales que generan fuertes y intempestivos cambios de caudal en los ríos, por ejemplo la aparición cada vez más frecuente de El Niño y La Niña, y demás efectos del colapso climático (Chacón, 1993; Hall, Kirn & Yanguas-Fernández, 2015), pero uno de los principales factores antrópicos que provocan estos cambios de caudal son los proyectos hidroeléctricos (Anderson, Pringle & Rojas, 2006; Hanson et al., 2010), los cuales han proliferado en los últimos años como parte de la búsqueda de energías alternativas al petróleo (Farah-Pérez, 2016).
Los efectos de estos proyectos se encuentra la indisponibilidad de agua, emisores de carbono, fragmentación ecosistémica, y sedimentación anómala, que se suman a las severas destrucciones que están sufriendo los cuerpos de agua debido a la contaminación, la deforestación y la extracción de agua en exceso (Brandt & Swenning, 1999).
Entre los organismos afectados se encuentra la especie Marathrum foeniculaceum Bonpl., (Crow 9755; CR ex INB, Arias et al. 305; CR) ‘’pasacarne’’. Son plantas a menudo robustas, con láminas foliares pinnadamente disecadas, con las divisiones primarias alternas, y flores con 5-8 estambres. Las semillas se vuelven mucilaginosas al contacto con sustrato húmedo, adhiriéndose rápidamente a las piedras. Habita generalmente corrientes rápidas y cascadas (Philbrick, Bove & Stevens, 2010), en ríos del bosque seco, húmedo, muy húmedo y pluvial de ambas vertientes del país, de 0 a 1 200 msnm. Las flores se han recolectado de enero a mayo, julio, noviembre y diciembre (Burger, 1983; Reyes-Ortega, Sánchez-Coronado & Orozco-Segovia, 2009; Crow & Philbrick, 2014). Sin embargo, se conoce poco sobre la biología reproductiva de las podostemáceas (Philbrick & Retana, 1998; Osborn, O´neill & El-Ghazaly, 2000), que además son el hábitat para especies de macroinvertebrados acuáticos (Hanson, Springer & Ramirez, 2010).
La presencia de podostemáceas, una familia predominantemente presente en regiones tropicales, con unas 135 especies en América (Tippery, Philbrick, Bove & Les, 2011), podría ser una indicación de aguas poco o nada contaminadas. Algunas poblaciones ya no existen debido a las destrucciones antrópicas. Prueba de ello es que M. foeniculaceum ha desaparecido de algunos ríos en el valle de El General y el valle Central donde previamente era abundante (Crow & Philbrick, 2014).
Para estudiar estas situaciones, es importante también tomar en cuenta la fenología, que es la ciencia que estudia los procesos de desarrollo vegetativo y reproductivo –para nuestro caso– de las plantas, en relación con los parámetros ambientales (Vargas-Rojas, 2011). Para efectos de este trabajo, el estudio de la fenología se centra en la reproducción, específicamente en la floración-fructificación, y la forma en que estos procesos se ven afectados por los factores ambientales, que si bien, pueden ser climáticos en tanto el caudal de los ríos varía con las precipitaciones, interesa especialmente los factores antrópicos que pueden generar cambios anómalos de caudal.
Este trabajo tiene como objetivo estudiar la influencia de los cambios de caudal en la fenología de M. foeniculaceum provocada –especialmente– por los proyectos hidroeléctricos, como premisa para considerar los impactos ambientales de este tipo de iniciativas energéticas en la conservación de los ecosistemas acuáticos.
MATERIALES Y MÉTODOS
Área de estudio: El valle de El General posee un ámbito altitudinal entre 300 y 1 000msnm, constituido principalmente por el clima húmedo tropical, con tres o cuatro meses de estacionalidad climática. Este valle se extiende a lo largo del río General, que con la confluencia con el río Coto Brus forma el río Grande de Térraba. Esta zona ha sido devastada por la deforestación y la expansión cañera y piñera que demanda grandes cantidades de agrotóxicos (Hammel, Grayum, Herrera & Zamora, 2004).
Los ríos Unión y Convento nacen en la cordillera de Talamanca, y han sido utilizados para riego de cultivos de piña, caña, café y pastoreo en sus márgenes, a partir de los 600msnm hacia abajo. El sitio escogido en el río Unión es un claro con influencia directa del sol durante la mayoría del día, con corrientes rápidas, poca profundidad y muchas rocas, donde habita una comunidad de M. foeniculaceum de unos 50m², coordenadas 9°16’22”N - 83°32’27”W. El área de estudio en el río Convento posee condiciones similares, con poblaciones mucho más pequeñas, coordenadas 9°15’20”N - 83°30’30”W. Colinda con potreros, cafetales, y con el Refugio Nacional de Vida Silvestre Longo Mai (J. Spendlingwimmer, comm. pers). Otra podostemácea que habita estos ríos es Tristicha trifaria.
Se simularon los cambios repentinos en el nivel del caudal mediante el cambio de posición de rocas de entre unos 10 y 20Kg de peso, habitadas por M. foeniculaceum en un área cercana a 600cm2 por roca. Este estudio se llevó a cabo en diciembre de 2013, diciembre de 2014 y diciembre de 2015. Se escogió esta época debido a que es el mayor período reproductivo de esta especie, al bajar el caudal de los ríos (obs. pers.).
En cada año se escogieron 12 rocas al azar (seis en cada río; tres en cada tratamiento), que fueran relativamente fáciles de manipular, que estuvieran cercanas entre sí en áreas poco profundas cercanas a la orilla, y en las que habitaran entre 40 y 60 individuos de M. foeniculaceum. En cada roca se escogieron al azar 35 individuos, que fueron marcados con una cinta amarrada en las hojas o en la base de la planta, para un total de 1 260 plantas estudiadas. Al inicio de cada repetición, estas poblaciones se encontraban a unos 15cm de profundidad, y no contenían flores, ya que el río no estaba todavía en su nivel más bajo.
Se realizaron dos tratamientos en cada río; el primero consistió en colocar tres rocas dos días fuera del agua, y dos días sumergidas, en el mismo sitio de donde fueron extraídas (Tratamiento 1). El segundo tratamiento consistió en colocar las otras tres rocas un día fuera del agua, y un día sumergidas (Tratamiento 2). Se contó con un tercer tratamiento (Testigo), del cual no se tomaron datos fenológicos para este estudio, pero fue de importancia para conocer el comportamiento en condiciones naturales de la población de donde fue extraída la muestra. Para cada tratamiento se realizaron observaciones diarias sobre las fases fenológicas y la duración fenológica (Fig. 1).
Con estos datos se evaluó el éxito reproductivo mediante la comparación de frutos con respecto a las flores producidas, y el promedio de flores por individuo.
Se evaluó el avance de la marchitez de los individuos, donde: 1. Plantas totalmente vivas; 2. Plantas amarillentas poco marchitas, con hojas; 3. Plantas amarillentas marchitas, con hojas; 4. Plantas amarillentas con pocas hojas; 5. Plantas totalmente secas, con o sin hojas.
Con estos datos se analizó la correlación entre el nivel de marchitez, la floración/fructificación, la humedad y el avance de las fenofases, además de la susceptibilidad a los bajos niveles de humedad. Para efectos de este estudio, se entiende por humedad cuando las plantas están sumergidas (sum), y sin humedad cuando no lo están (eme). Para las correlaciones entre las fenofases y los parámetros ambientales, se utilizó el coeficiente de correlación de Pearson, que mide la relación entre dos variables cuantitativas entre -1 y 1. El análisis de los datos se realizó con el software Infostat.
La biodiversidad acuática y los proyectos hidroeléctricos: Los ecosistemas dulceacuícolas representan menos del 1% de la superficie del planeta, pero es donde habita alrededor del 35% de los vertebrados existentes, de los cuales, entre 10 mil y 20 mil especies están en proceso de extinción o extintas (Vörösmarty et al., 2010). Además, de que las poblaciones animales se han reducido a la mitad en los últimos 43 años (Korenblik, Leggett & Shadbold, 2016; WWF, 2016).
A pesar de la importancia y vulnerabilidad de los ecosistemas acuáticos, se conoce poco sobre estos, y aún menos sobre los vegetales. Tampoco se sabe mucho acerca de los impactos biológicos de los proyectos hidroeléctricos, ya que los Estudios de Impacto Ambiental (EsIA) lo que estiman al respecto es básicamente un listado de especies (datos muchas veces subestimados) que podrían ser impactadas. Entre los principales trabajos en el país se encuentran las investigaciones realizadas en la vertiente Atlántica por Anderson et al. (2006, 2008).
Otro importante trabajo para conocer los impactos de los proyectos hidroeléctricos ha sido el de Farah Pérez (2016), quien amplió el estudio de la afectación en la interrupción de las migraciones de peces, producto de la construcción de diques para la producción hidroeléctrica. Este autor concluye que ‘’la producción hidroeléctrica y la conservación de la fauna dulceacuícola se encuentran en posiciones antagónicas’’ (p. 59), ya que producen la afectación de unas 90 especies de peces que traslapan su distribución con los proyectos hidroeléctricos, debido a la interrupción del hábitat, y el poco caudal ecológico (10%).
Los proyectos hidroeléctricos tienen permitido utilizar el 90% del caudal. Los megaproyectos como el PH Arenal o el PH Reventazón consisten en la construcción de una gran estructura que interrumpa el curso del río para llenar el embalse. Pero en ríos más pequeños, se utilizan los proyectos denominados ‘’a filo de agua’’, que consisten en el desvío del 90% del caudal sin necesidad de construir una gran represa (pero sí un dique). El embalse generalmente es un lago artificial fuera de cuenca, que cuando se llena, es desembalsado varios kilómetros abajo, lo que provoca frecuentes y significativos cambios de caudal (véase Miranda-Farah, 2013).
En el río Unión la empresa H. Solís propuso el PH San Rafael (7 250KW), mientras que en el río Convento se propuso el PH Monteverde I (2 800KW), de Hidro Monteverde Energy (que pretendía unir también el río Sonador), y el PH Monteverde II (4 966KW), a cargo de Hidro Convento Energy (Álvarez-Mora, 2013). Los EsIA de estos proyectos no incluyen a M. foeniculaceum, ni a T. trifaria en el listado de especies, lo que en primera instancia dificulta a los EsIA la medición de los impactos sobre las plantas acuáticas.
RESULTADOS
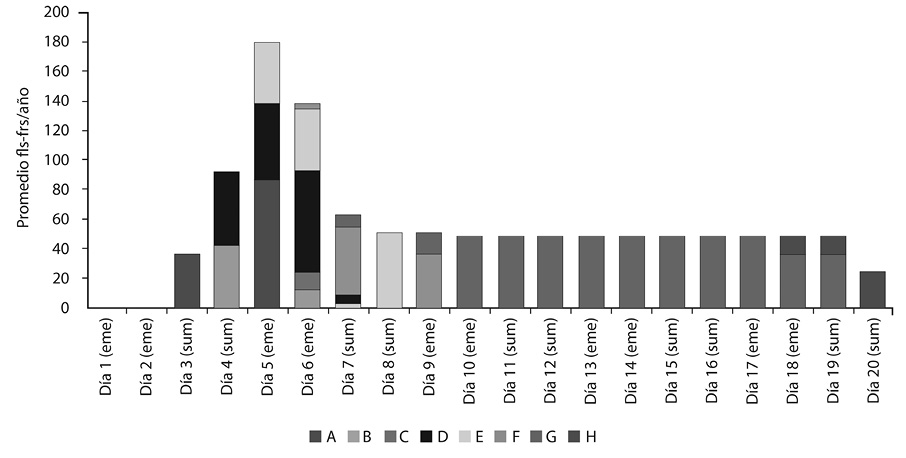
En el Tratamiento 1 el promedio máximo diario de órganos (de diferentes fenofases) se alcanzó al quinto día, con 180 órganos. La antesis (fenofase D) ocurrió a partir del cuarto día, y los frutos abiertos (fenofase H) a partir del día 18. Este tratamiento produjo un promedio anual de 24 frutos por río (Figura 2).
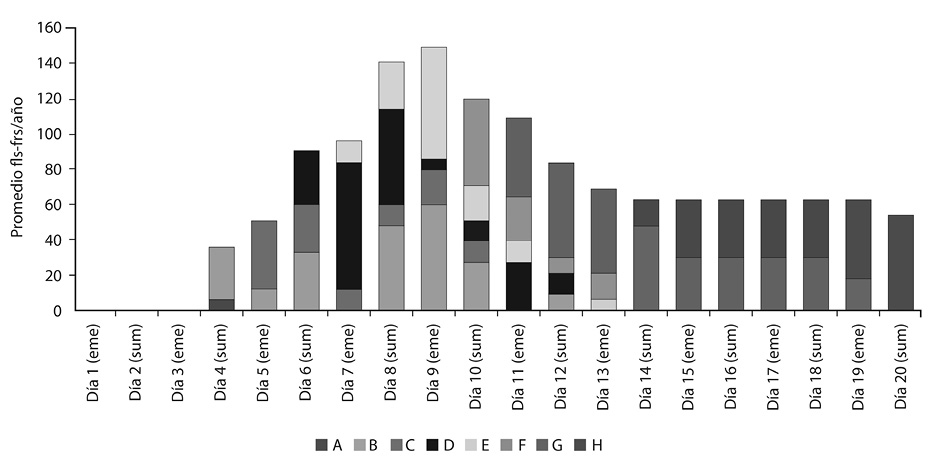
El Tratamiento 2 tuvo un promedio máximo diario de órganos (de diferentes fenofases) al noveno día, con 149. La antesis ocurrió a partir del sexto día, y la fenofase H a partir del día 15. El Tratamiento 2 tuvo un promedio anual de 54 frutos por río (Figura 3).
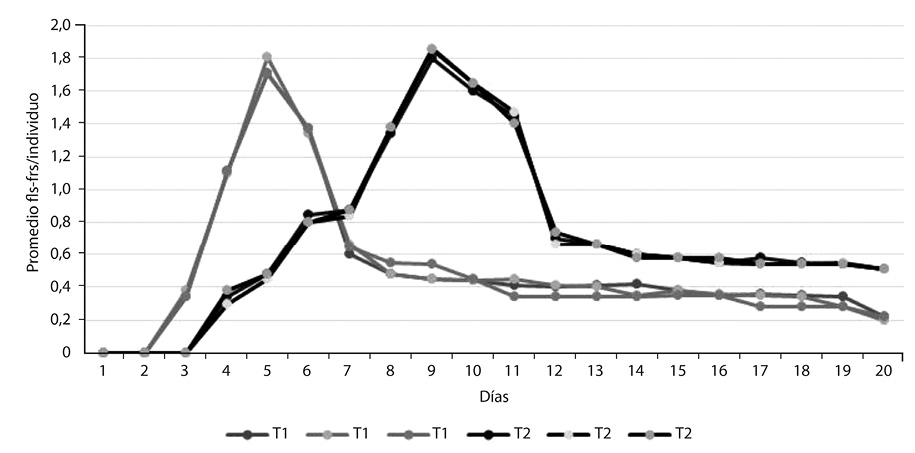
En la Figura 4 se representa el promedio de flores y/o frutos por individuo en cada tratamiento, el cual fue mayor durante la floración, y descendió después de la antesis (Fenofase D). Para el Tratamiento 1 el éxito reproductivo fue de 29%, y para el Tratamiento 2 de 26%. En la Tabla 1 se analiza la correlación entre los parámetros ambientales y la floración/fructificación, donde la mayor correlación la tuvo marchitez vs. fenofases (Pearson >0,8), seguido por marchitez vs. floración (Pearson >0,5). Las correlaciones más bajas fueron humedad vs. floración, humedad vs. floración-fructificación, marchitez vs. floración-fructificación, y humedad vs. marchitez (Pearson <0,5). Los datos de ambos ríos se unificaron para efectos de presentación de resultados.
Esta especie es totalmente dependiente de los cambios naturales de caudal para su supervivencia y colonización, al igual que otros grupos de plantas acuáticas, como las algas (Martínez, 2003). Algunos trabajos descriptivos sobre podostemáceas han abordado a grandes rasgos esta característica. Durante anotaciones previas y posteriores a este estudio, sobre el comportamiento de M. foeniculaceum, se ha observado que el nivel del caudal es fundamental para la dispersión de semillas (Philbrick y Retana, 1998; Reyes-Ortega et al., 2009).
Para efectos de este estudio, la floración fue inducida en todos los casos, ya que al momento de iniciar cada tratamiento las rocas se encontraban sumergidas. Esto mostró el cambio de caudal como principal factor que induce la reproducción. Las plantas que habitaban bajo las mismas condiciones que las estudiadas, florecieron hasta dos meses después, cuando el nivel del agua bajó lo suficiente para que se diera la floración (Testigo). Con un día fuera del agua, las plantas llegaron al nivel 2 de marchitez, mientras que con dos días alcanzaron el nivel 3, por lo que un día o más sin las condiciones aptas de humedad es suficiente para que las plantas mueran.
El avance en el nivel de marchitez se dio solo cuando las plantas estaban emergidas, ya que cuando estuvieron sumergidas la marchitez no avanzó significativamente. El nivel 5 se alcanzó al sexto día de estudio en el Tratamiento 1, mientras que para el Tratamiento 2 se alcanzó al día 13. En ninguno de los dos tratamientos se logró un nivel de marchitez inferior al que se había alcanzado. En todos los casos la floración ocurrió cuando las plantas estaban vivas o marchitas, y la fructificación cuando estaban secas. En diciembre de 2015 hubo constantes precipitaciones al inicio del estudio, las cuales mantuvieron las plantas húmedas durante unas horas cuando estuvieron emergidas, sin embargo, esto no causó diferencias notables con respecto a las otras repeticiones.
En el Tratamiento 1 las flores aparecieron el tercer día, donde todas estaban en la fenofase A. Al cuarto día se encontraban en la fenofase A, B, C y D. Al quinto día avanzaron una fenofase, y otras aparecieron, por lo que las fenofases presentes en ese día fueron A, B, C, D y E. Al día seis y siete se presentaron las fenofases B, C, D, E, F y G. Al octavo día hubo presencia de las fenofases D, E, F y G. Al noveno y décimo las fenofases estuvieron en F y G. Del día 11 al 17 la fenofase G se mantuvo. La fenofase H apareció del día 18 al 20. La floración tardó en promedio cuatro días (alrededor de un día por fenofase), y la fructificación alrededor de 16.
En el Tratamiento 2 las fenofases A y B aparecieron al cuarto día de estudio. Al quinto día se presentaron las fenofases A, B y C. Al sexto día estuvieron las fenofases B, C y D. Al día siete, ocho y nueve se presentaron las fenofases B, C, D y E. Los días 10, 11, 12 y 13 estuvieron presentes las fenofases B, C, D, E, F, y G. Los días 14 y 15 hubo presencia de las fenofases E, F, G y H. Del día 16 al 19 las fenofases fueron F, G y H, mientras que al día 20 los últimos frutos llegaron a la fenofase H. La floración tardó en promedio cinco días (aproximadamente un día por fenofase), mientras que la fructificación se extendió por unos 15 días. El nivel de marchitez se mantuvo más o menos constante, y debido a la constante humedad recibida, las plantas tardaron 13 días en secarse por completo, cinco más que el Tratamiento 1.
El aumento en la velocidad de las fenofases provocó cambios en la morfología floral, al producir pedúnculos más cortos probablemente por el aumento en la velocidad fenológica. Además, hubo estambres deciduos, causado posiblemente al momento de estar bajo en agua.
En el Tratamiento 1 el éxito reproductivo fue de 29%, mientras que en el Tratamiento 2 fue de 26%. En estos resultados influyeron los botones florales que se marchitaron, las flores que no fueron polinizadas, los frutos deciduos antes de abrirse y el poco promedio de flores por individuo (Figura 4).
CUADRO 1
Coeficientes de correlación entre la floración-fructificación de M. foeniculaceum y los parámetros ambientales en dos ríos de Costa Rica
|
Correlaciones
|
2013
|
2014
|
2015
|
|
T1
|
T2
|
T1
|
T2
|
T1
|
|
Marchitez vs flores-frutos
|
0,05
|
0,20
|
0,34
|
0,14
|
0,04
|
|
Humedad vs flores-frutos
|
-0,10
|
0,007
|
-0,09
|
0,003
|
-0,09
|
|
Marchitez vs floración
|
0,57
|
0,77
|
0,74
|
0,77
|
0,63
|
|
Humedad vs floración
|
-0,11
|
0,31
|
-0,10
|
0,31
|
-0,09
|
|
Marchitez vs fenofases
|
0,91
|
0,81
|
0,88
|
0,81
|
0,94
|
|
Humedad vs marchitez
|
0,17
|
0,10
|
0,17
|
0,03
|
0,12
|
Los parámetros analizados que presentan mayor correlación son la marchitez vs. fenofases (Pearson >0,8), y la marchitez vs. floración (Pearson >0,5). Mientras que la humedad vs. floración, la humedad vs. floración-fructificación, la marchitez vs. floración-fructificación, y la humedad vs. marchitez, presentaron correlaciones más bajas (Pearson <0,5) (Cuadro 1).
La marchitez depende de la humedad proporcionada en ambos tratamientos, mientras que el aumento en la velocidad de marchitez indujo la floración. Por otra parte, la floración es la única que avanza de acuerdo a estos dos parámetros, mientras que la fructificación y la maduración de los frutos avanza de acuerdo a la biología reproductiva de la especie.
DISCUSIÓN
El nivel del caudal adecuado para M. foeniculaceum debe variar en respuesta a los parámetros ambientales. Cuando llega la época lluviosa y el aumento de caudal, las plantas quedan sumergidas lo suficiente para que cuando vuelva a llegar la época seca, el nivel del caudal las deje emergidas y lleven a cabo la floración, polinización, fructificación y dispersión. De lo contrario la afectación podría llevar a consecuencias poblacionales negativas. Por lo tanto, los proyectos hidroeléctricos además de las afectaciones ya conocidas sobre la ictiofauna por fragmentación (Farah-Pérez, 2016), y desvíos de los cauces (Anderson et al., 2008), también provocan impactos por los anómalos cambios de caudal para el caso de M. foeniculaceum.
Además, la floración debe ser totalmente emergida, ya que en condiciones naturales el polen generalmente no tiene contacto con el agua (Philbrick & Retana, 1998; Osborn et al., 2000). Esto provocó en el estudio el aumento de la velocidad fenológica, y pudo haber influido en el bajo éxito reproductivo, debido a que el polen pudo haberse diluido en el agua, y la antesis, al ser más breve y a veces sumergida, tuvo menor posibilidad de polinización. Datos tomados del Testigo en condiciones naturales mostró un éxito reproductivo de alrededor del 90% (26% y 29% en los tratamientos 1 y 2). No se han localizado estudios sobre éxito reproductivo para corroborar dicho dato, lo más cercano han sido afirmaciones de autores como Philbrick y Retana (1998), quienes mencionan que esta especie produce profusas flores y frutos.
La correlación que existe entre la floración, la marchitez y la humedad, aunque no fue alta en este estudio, puede explicar que la floración haya disminuido significativamente –sobre todo en el Tratamiento 1–. La menor producción flores por individuo (<2 por planta), es debido a que la disminución de la humedad se dio de manera repentina, que induce la marchitez y un aumento en la velocidad fenológica que procurase producir frutos (dejar descendencia) antes que las plantas murieran. El Tratamiento 2, con cambios diarios de caudal, tuvo una floración levemente más prolongada, y un menor éxito reproductivo, debido a que tuvo menos contacto contínuo –pero más frecuente– con el agua.
En condiciones naturales, el promedio de flores por individuo es siempre mayor a cinco (obs. pers. en el Testigo), donde la duración fenológica se prolonga por más tiempo debido a que la humedad disminuye paulatinamente y los eventuales cambios de caudal no son tan constantes. Incluso, se ha observado que la duración de la floración está relacionada con la duración de la disminución del caudal, y la antesis puede retrasarse o acelerarse si las condiciones no son o no las adecuadas (obs. pers. en el Testigo). Philbrick (1998), asegura que la antesis de M. rubrum se mantiene entre tres y cuatro días, una situación similar en M. foeniculaceum, y todavía menor en este estudio.
La variación –a veces– diaria del caudal en un 90% para abastecer el embalse y desembalse de los proyectos hidroeléctricos, provoca que el caudal del río se reduzca y aumente en períodos cortos, lo cual afecta considerablemente el proceso reproductivo de M. foeniculaceum, que podría conllevar a la aceleración (o causa) de extinción de esta especie sobre la que ya recaen otras amenazas.
Entre más frecuentes sean los cambios de caudal, mayor susceptibilidad y menor éxito reproductivo, contrario a las condiciones naturales, donde esta marchitez es gradual y consecuente a la biología reproductiva de la especie. Esto se observó del Tratamiento 2 (cambios cada día), lo cual incide para que la velocidad fenológica y el éxito reproductivo sean menores al Tratamiento 1 (cambios cada dos días).
La aceleración de las fenofases ocurrió sobre todo en los períodos de floración, específicamente las fenofases A, B, C y D, sobre todo del Tratamiento 1, lo que demuestra la dependencia de la floración a los parámetros ambientales sanos, específicamente en los cambios graduales de caudal.
Se vuelven cada vez más urgentes los estudios sobre los impactos de los proyectos hidroeléctricos, debido sobre todo a la proliferación de estos. Ante los diversos y severos impactos sobre los ecosistemas acuáticos, los usos de los ríos deben ser cada vez más cuidadosos para garantizar los equilibrios ecosistémicos y el acceso digno al agua también para las poblaciones humanas.
AGRADECIMIENTOS
A Johan Barboza Tames, Oscar Arias Segura y Carmen Campos Valverde por su apoyo en el trabajo de campo. A Gustavo Vargas Rojas, Juan Pablo Villegas Espinoza, Escuela de la Tierra, y en especial a Jiri Spendlingwimmer por el apoyo en la fases finales de la investigación. También a los pares revisores que realizaron valiosas recomendaciones.
REFERENCIAS
Álvarez-Mora, M. (2013). Proyectos hidroeléctricos privados chocan con comunidades del Pacífico Sur por uso del agua. Ambientico, 237-238, 40-46. Recuperado de https://goo.gl/akHXah
Anderson, E., Pringle, C., & Rojas, M. (2006). Transforming tropical rivers: an environmental perspective on hydropower development in Costa Rica. Aquatic Conserv: Mar. Freshw. Ecosyst., 16, 679-693. doi: 10.1002/aqc.806
Anderson, E., Pringle, C., & Freeman, C. (2008). Quantifying the extent of river fragmentation by hydropower dams in the Sarapiquí River Basin, Costa Rica. Aquatic Conserv: Mar. Freshw. Ecosyst., 18, 408-417. doi: 10.1002/aqc.882
Brandt, A., & Swenning, J. (1999). Sedimentological and Geomorphological effects of reservoir flushing: The Cachí Reservoir, Costa Rica, 1996. Geografiska Annaler, 81(3), 391-407. doi: 10.1111/j.0435-3676.1999.00069.x
Burger, W. (1983). Podostemaceae. Flora Costaricensis. Fieldiana Botany. n.s., 13, 1-8.
Chacón, R. (1993). Aspectos de la influencia del fenómeno de El Niño en el clima costarricense. Revista Geográfica de América Central, 27, 63-66. Recuperado de https://goo.gl/snY9t5
Crow, G., & Philbrick, C. (2014). Podostemaceae. En: B. Hammel, M. Grayum, C. Herrera y N. Zamora. (Eds.), Manual de Plantas de Costa Rica. (Haloragaceae-Phytolaccaceae) (pp. 322-336). Saint Louis, Estados Unidos: Miss. Bot. Gard. Press.
Farah-Pérez, A. (2016). Fragmentación del hábitat por represas hidroeléctricas para la ictiofauna dulceacuícola en Costa Rica (Tesis de licenciatura). Universidad de Costa Rica, San José.
Hall, J., Kirn, V., & Yanguas-Fernández, E. (Eds.). (2015). Managing Watersheds for Ecosystem Services in the Steepland Neotropics. Washington, United States: Interamerican Development Bank. doi: 10.18235/0000163
Hammel, B., Grayum, M., Herrera, C., & Zamora, N. (Eds.). (2004). Manual de plantas de Costa Rica I. Introducción. Saint Louis, Estados Unidos: Miss. Bot. Gard. Press.
Hanson, P., Springer, M., & Ramírez, A. (2010). Introducción a los grupos de macro invertebrados acuáticos. Rev. Biol. Trop., 58, 3-37. doi: 10.15517/rbt.v58i4.20080
Korenblik, A., Leggett, T., & Shadbold, T. (2016). World Wildlife Crime Report 2016: Trafficking in Protected Species. Viena, Austria: United Nations Office on Drugs and Crime. Recuperado de https://goo.gl/R6wLwm
Martínez, L. (2003). Efectos del caudal sobre la colonización de algas en un río de alta montaña tropical (Boyacá, Colombia). Caldasia, 25(2), 337-354. Recuperado de https://goo.gl/5vRUYD
Miranda-Farah, E. (2013). Proyecto Hidroeléctrico San Rafael. Estudio de impacto ambiental. San José, Costa Rica: Gestión Ambiental de Proyectos (GAPRO).
Osborn, J., O’neill, S., & El-Ghazaly, G. (2000). Pollen morphology and ultrastucture of Marathrum schiedeanum (Podostemaceae). Grana, 39, 221-225. doi: 10.1080/00173130052017253
Philbrick, C., & Retana, A. (1998). Flowering phenology, pollen flow, and seed production in Marathrum rubrum (Podostemaceae). Aquatic Botany, 62(3), 199-206. doi: 10.1016/S0304-3770(98)00090-4
Philbrick, T., Bove, C., & Stevens, H. (2010). Endemism in Neotropical Podostemaceae. Annals of the Missouri Botanical Garden, 97(3), 425-456. doi: 10.3417/2008087
Reyes-Ortega, I., Sánchez-Coronado, E., & Orozco-Segovia, A. (2009). Seed germination in Marathrum schiedeanum and M. rubrum (Podostemaceae). Acuatic Botany, 90(1), 13-17. doi: 10.1016/j.aquabot.2008.04.011
Tippery, N., Philbrick, T., Bove, C., & Les, D. (2011). Systematics and Phylogeny of Neotropical Riverweeds (Podostemaceae: Podostemoideae). Systematic Botany, 36(1), 105-118. doi: 10.1600/036364411X553180
Vargas-Rojas, G. (2011). Botánica general: desde los musgos hasta los árboles. San José, Costa Rica: EUNED.
Vörösmarty, C., McIntyre, P., Gessner, M., Dudgeon, D., Prusevich, A., Green, P., Glidden, S., Bunn, S., Sullivan, C., Liermann, C., & Davies, P. (2010). Global threats to human water security and river biodiversity. Nature, 467(7315), 555-561. doi: 10.1038/nature09440
WWF (World Wide Foundation). (2016). Living Planet Report 2016. Risk and Resilience in a New Era. Gland: WWF International. Recuperado de https://goo.gl/hbzkfZ