Historia natural y estado actual del conocimiento de los patos en México: amenazas y conservación
Natural history and current state of knowledge of the ducks in Mexico: threats and conservation
Jorge E. Ramírez-Albores 1
DOI: 10.22458/rb.v35i1.5350
Recibido - Received: 04/ 03 /2024 / Corregido- Revised: 25/ 04/ 2024 / Aceptado -Accepted: 02 / 05 / 2024
RESUMEN
Los patos cuentan con una distribución natural amplia, son un grupo diverso en morfología y comportamiento. Sin embargo, estas aves están sometidas a fuertes presiones tanto ambientales como humanas que amenazan su permanencia, sin considerar que cumplen importantes funciones ecológicas como la regulación de poblaciones de invertebrados y malezas acuáticas, la dispersión de semillas, la mejora de la calidad del agua, entre otras. Por tal motivo, en este documento se realizó una revisión de literatura en bases de datos especializadas para describir el estado actual del conocimiento de los patos en México, se recopiló información referente a su biología y ecología publicada hasta el año 2023. Se clasificó cada publicación en 16 tópicos para determinar el estado del conocimiento y detectar vacíos de información. A pesar de ser un grupo de aves común, diverso, ampliamente distribuido a lo largo del país y de gran importancia ecológica y socioeconómica, los estudios sobre su ecología son muy escasos (n=100), siendo los patrones de distribución entre los tópicos más estudiados. La conservación de los ambientes acuáticos y la regulación de las actividades humanas son elementos clave para mantener la biodiversidad y la salud de los ecosistemas acuáticos. Esto nos permitirá establecer prioridades con fines de investigación y conservación para el grupo de aves en estudio.
Palabras clave: Anatidae; aves; biodiversidad; conservación; humedales.
ABSTRACT
Ducks have a wide natural distribution and are a diverse group in morphology and behavior. However, these birds are subject to strong environmental and human pressures, which threaten their permanence, without considering that they fulfill important ecological functions such as regulating populations of invertebrates and aquatic weeds, seed dispersal, improving water quality, among others. For this reason, in this document a literature review was carried out in specialized databases to describe the current state of knowledge of ducks in Mexico, information was collected regarding biology and ecology published until the year 2023. Each publication was classified into 16 topics to determine the state of knowledge and detect information gaps. Despite being a common, diverse group of birds, widely distributed throughout the country and of great ecological and socioeconomic importance, studies on its ecology are very scarce (n=100), with distribution patterns among the most studied. The conservation of aquatic environments and the regulation of human activities are key elements to maintain biodiversity and healthy aquatic ecosystems. This will allow us to establish priorities for research and conservation purposes for this group of birds.
Keywords: Anatidae; birds; biodiversity; conservation; wetlands.
Introducción
Los anátidos son una familia de aves acuáticas que habitan diferentes ambientes en el mundo. A esta familia pertenecen los cisnes, los gansos y los patos (pijijes, mergos, cercetas, porrones, buceadores, entre otros), los cuales agrupan 174 especies, pertenecientes a 53 géneros en todo el mundo (Winkler et al., 2020). En México, se encuentran representadas 41 especies (Howell & Webb, 1995; Ducks Unlimited, 2011), de las cuales 33 pertenecen al grupo de los patos, y abarcan 15 géneros: Cairina, Dendrocygna, Anas, Aix, Aythya, Spatula, Histrionicus, Mareca, Melanitta, Ciangula, Bucephala, Lophodytes, Mergus, Nomonyx y Oxyura. Los patos cuentan con una distribución natural amplia, y son un grupo diverso en morfología y comportamiento. Sin embargo, estas aves están sometidas a fuertes presiones, tanto ambientales como humanas, tal como la pérdida de más de 60% de los humedales en México (Saavedra, 2019), que amenazan su permanencia, sin considerar que cumplen importantes funciones dentro de los ecosistemas acuáticos. En el contexto, el objetivo del documento es identificar el estado actual del conocimiento de los patos en México, a través de un análisis de su historia natural y de una revisión documental, lo cual nos permitirá establecer prioridades con fines de investigación y conservación para este grupo de aves.
Figura 1
Algunas especies de la familia Anatidae en México

Notas. (A) pato golondrino (Anas acuta), (B) cerceta canela (Spatula clypeata), (C) pato cucharón norteño (Spatula clypeata), (D) cerceta alas azules (Spatula discors), (E) cerceta alas verdes (Anas crecca), (D) pato mexicano (Anas diazi), pato pico anillado (Aythya collaris), pato arcoíris (Aix sponsa) y pato silbón (Mareca penelope). Fotografías (A-D) tomadas en el lago Nabor Carrillo, Estado de México en diciembre del 2021 por Rogelio Bautista; fotografías (E-F) tomadas en el lago Nabor Carrillo, Estado de México en diciembre del 2021 por Jorge E. Ramírez-Albores; fotografías (G-H) tomadas en Saltillo, Coahuila en octubre del 2023; y fotografía (I) tomada en el Lago de Guadalupe en diciembre del 2021 por Jorge E. Ramírez-Albores.
Metodología
Se realizó una búsqueda exhaustiva
de publicaciones científicas, referentes a la biología y la ecología de los patos que se distribuyen en México, en diferentes bases de datos especializadas como EBSCOhost, Web of Knowledge (Thomson Reuters), Scopus (Elsevier), Current Contents Connect (Thomson Reuters), Biological Abstracts (Thomson Reuters), the Journal Storage Project-JSTOR (ITHAKA), Google Scholar (Google), the Scientific Electronic Library Online (SciELO, BIREME-OPS-OMS) y la Red de Revistas Científicas de América Latina y el Caribe, España y Portugal (Redalyc-Universidad Autónoma
del Estado de México).
Posteriormente, se generó una lista de referencias que contuviera los términos de búsqueda o una combinación de ellos en parte del título, resumen (abstract) o en las palabras clave. Se identificaron los estudios para todos los años disponibles hasta el 2023 mediante el uso de las palabras clave en español e inglés, siendo los criterios de inclusión: Anatidae*, Anseriformes*, patos*, pijije alas blancas (Dendrocygna autumnalis)*, pijije canelo (Dendrocygna bicolor)*, pato real (Cairina moschata)*, pato arcoiris (Aix sponsa)*, cerceta cejas blancas (Spatula querquedula)*, cerceta alas azules (Spatula discors)*, cerceta canela (Spatula cyanoptera)*, pato cucharón norteño (Spatula clypeata)*, pato friso (Mareca strepera)*, pato silbón (Mareca penelope)*, pato chalcuán (Mareca americana)*, pato de collar (Anas platyrhynchos)*, pato tejano (Anas fulvigula)*, pato golondrino (Anas acuta)*, cerceta alas verdes (Anas crecca)*, pato coacoxtle (Aythya valisineria)*, pato cabeza roja (Aythya americana)*, pato pico anillado (Aythya collaris)*, pato boludo mayor (Aythya marila)*, pato boludo menor (Aythya affinis)*, pato arlequín (Histrionicus histrionicus)*, negreta nuca blanca (Melanitta perspicillata)*, negreta alas blancas americana (Melanitta deglandi)*, negreta pico amarillo (Melanitta americana)*, pato cola larga (Ciangula hyemalis)*, pato monja (Bucephala albeola)*, pato chillón (Bucephala clangula)*, pato islándico (Bucephala islandica)*, mergo cresta blanca (Lophodytes cucullatus)*, mergo mayor (Mergus merganser)*, mergo copetón (Mergus serrator)*, pato enmascarado (Nomonyx dominicus)*, pato tepalcate (Oxyura jamaicensis)*, México*.
Se aplicaron diferentes filtros: (i) se incluyeron solo publicaciones en las áreas de investigación de agronomía, biología, conservación de la biodiversidad, ecología y ciencias ambientales; (ii) se consideraron solamente artículos y revisiones científicas revisadas por pares, excluyendo los manuscritos “en revisión”, “preprints” o “en prensa”; y (iii) se incluyeron solamente publicaciones donde alguna especie perteneciente a la familia Anatidae fuera la especie de estudio o formara parte del grupo de aves de estudio (i.e., a nivel familia). Posterior a esto, se clasificaron sistemáticamente los estudios de acuerdo con el tópico desarrollado en cada publicación. El resultado fueron 16 tópicos principales de investigación: (i) patrones de distribución, (ii) genética, (iii) comportamiento, (iv) dieta, (v) parasitismo, (vi) ecología, (vii) reproducción, anidación e hibridación, (viii) uso de hábitat, (ix) dinámica poblacional, (x) aprovechamiento, (xi) conservación, (xii) aberraciones cromáticas, (xiii) virus y bacterias, (xiv) toxicidad, (xv) salud y enfermedades y (xvi) dinámica de comunidades.
Resultados
Historia natural
Los patos presentan una variedad de características adaptativas que les permiten sobrevivir y prosperar en una pluralidad de hábitats acuáticos, desde lagos y ríos hasta humedales y estuarios (Howell & Webb, 1995; Ducks Unlimited, 2011; Winkler et al., 2020).
Pueden exhibir una amplia diversidad de colores y patrones en su plumaje (figura 1), que incluyen tonos marrón, blanco, negro, gris y verde, entre otros y esto va a depender de la edad, sexo y época del año. Estos patrones a menudo les ayudan a camuflarse en su entorno acuático. Siendo los machos los que presentan colores más llamativos y plumajes más vistosos que las hembras, que a menudo muestran un plumaje más discreto que les permite mimetizarse con el entorno mientras incuban los huevos (Rodríguez-Casanova & Zuria, 2018).
Tienen picos adaptados para su dieta omnívora, que varía desde materia vegetal, como hierbas acuáticas, semillas, frutas, así como invertebrados acuáticos como insectos, crustáceos y pequeños peces (Howell & Webb, 1995; Arzel et al., 2006; Winkler et al., 2020). Los picos pueden ser anchos y aplanados para filtrar alimentos del agua como plancton y otros organismos acuáticos pequeños, o puntiagudos y afilados para atrapar presas pequeñas como insectos o peces (Howell & Webb, 1995; Ducks Unlimited, 2011; Winkler et al., 2020).
Una característica distintiva de los patos son sus patas palmeadas, que están adaptadas para nadar eficientemente en el agua y caminar en terrenos acuáticos. Las membranas entre los dedos de las patas les permiten propulsarse con facilidad y maniobrar en el agua. El color de las patas y pies puede variar, pero generalmente son de tonos oscuros.
En términos reproductivos, algunas especies realizan movimientos alternados donde los machos levantan la cabeza y la cola exhibiendo a la hembra todas las partes del cuerpo y el colorido plumaje; por su parte, la hembra realiza la acción de nadar frente a los machos con la cabeza alargada muy cerca del agua como acción de aceptación (Ducks Unlimited, 2011; Winkler et al., 2020), a este comportamiento se le conoce como head-up-tail-up display (Lorenz, 1993). Una parte del comportamiento se lleva a cabo entre los machos, que realizan movimientos de cabeza de abajo a arriba y hunden rápidamente el pico en el agua y después lo levantan, durante estos movimientos emiten un silbido (Lorenz, 1993), y cuando el pato mueve el pico eleva una columna de agua la cual puede tener un atractivo visual para la hembra.
Su reproducción ocurre generalmente durante la primavera y el verano. Las parejas se forman durante estas épocas y construyen nidos en tierra cerca del agua, en áreas seminundadas (Weller, 2001; Gammonley & Laubhan, 2002; Keddy, 2010) e inclusive en cavidades de árboles como ocurre con el pijije alas blancas (Dendrocygna autumnalis) y el mergo cresta blanca (Lophodytes cucullatus). Las hembras ponen huevos en el nido y luego los incuban durante unas semanas hasta que eclosionan los polluelos. Aunque en algunas especies como el pato tepalcate (Oxyura jamaicensis) se presenta el cuidado parental cooperativo, donde existen guarderías conformadas por grupos de más de cinco adultos en su mayoría hembras que protegen entre 10 y 15 polluelos de diferentes edades (Rodríguez-Casanova & Zuria, 2018).
Investigaciones recientes mencionan que, a escala regional, su éxito reproductivo depende en gran medida de la distribución espacial de los cuerpos de agua y de la variación ambiental interanual, como la precipitación y la productividad primaria, que influyen en el reclutamiento de individuos y en sus fluctuaciones poblacionales (Drever et al., 2012; Walker et al., 2013; Ross et al., 2015). Mientras que, a escalas mucho más pequeñas, la vegetación del sitio de anidación (Skone et al., 2016), la presencia de depredadores (Chalfoun et al., 2002; Phillips et al., 2004) y la distribución espacial de los nidos (Ringelman, 2014) influyen en la supervivencia de los nidos, pero los efectos probablemente varían entre regiones y las comunidades de anátidos.
Distribución y hábitat
Los anátidos se encuentran distribuidos a lo largo de todo el país, desde la península de Baja California hasta la península de Yucatán (Howell & Webb, 1995; Sibley, 2014), tanto en hábitats acuáticos dulces como salados. Su distribución varía según la temporada y disponibilidad de recursos, especialmente durante la temporada de invernada y migración ya que encuentran alimento, refugio y áreas de anidación en estos ambientes (Arzel et al., 2006). Las principales regiones donde se hallan se enumeran a continuación.
- Regiones costeras y humedales a lo largo de las costas del golfo de México y el Pacífico;
- lagos y lagunas interiores, estos sitios son utilizados durante la migración y como sitios de invernada (Ayala-Pérez et al., 2013; Ramírez-Albores & Pérez-Suárez, 2019; Cayetano-Rosas et al., 2023);
- zonas montañosas y lagos de altura, en regiones montañosas como la Sierra Madre occidental y oriental, así como en los Altos de Chiapas, donde se encuentran lagos o cuerpos de agua artificiales de agua dulce más fría;
- ríos y arroyos que atraviesan México son utilizados como corredores por algunas especies;
- zonas agrícolas con riego o irrigación, como campos de arroz, maíz, trigo u otros cultivos (Lieske et al., 2012), donde pueden encontrar alimento en forma de granos y semillas, así como áreas de anidación o refugio en los márgenes de los campos y áreas de vegetación cercanas, como ocurre en gran parte del centro de México (Ayala-Pérez et al., 2013; Ramírez-Albores & Pérez-Suárez, 2019; Cayetano-Rosas et al., 2023).
Comportamiento
Aunque los patos son aves acuáticas, poseen una excelente capacidad de vuelo. Vuelan largas distancias durante la migración estacional o para encontrar nuevos hábitats adecuados desde Canadá y Estados Unidos, es decir, migran a sitios más cálidos en México, Centroamérica y Sudamérica (Arzel et al., 2006), donde abunden recursos alimenticios y donde los días sean más largos.
Veinticinco de las especies que se distribuyen en México son migratorias, lo que significa que viajan grandes distancias entre sus áreas de reproducción y sus áreas de invernada. La migración puede durar desde unas semanas hasta meses. Entre las principales especies migratorias se encuentran el pato cucharón norteño (Spatula clypeata), el pato friso (Mareca strepera), el pato golondrino (Anas acuta) y la cerceta alas azules (Spatula discors). Por ejemplo, se han registrado, individuos de S. discors que provienen de Alaska hasta México (más de 5 000 km) o hasta Sudamérica (más de 10 000 km). Esta capacidad de migración les permite aprovechar recursos estacionales y evitar condiciones climáticas adversas. Sin embargo, el comportamiento migratorio puede cambiar por amenazas como el cambio climático o por alguna actividad antrópica (Guilleman et al., 2013; Dalby et al., 2014).
Muestran comportamientos sociales tanto durante la temporada reproductiva como durante la migración. Algunas especies forman parejas monógamas durante la temporada de cría, mientras que otras se congregan en grandes grupos en áreas de alimentación y descanso (Arzel et al., 2006; Winkler et al., 2020). Sin embargo, estas aves son conocidas por ser muy propensas a la hibridación (Johnsgard, 1960; McCarthy, 2006), es decir, un cruce entre diferentes especies, resultando en descendientes con características de ambas especies parentales. Estas características pueden incluir coloración, tamaño, forma del pico, patrones de vuelo y comportamiento. Algunos individuos son fértiles y capaces de reproducirse, mientras otros pueden ser estériles o tener una menor capacidad de supervivencia en comparación con las especies parentales (Grant & Grant, 1992; Tubaro & Lijtmaer, 2002).
Las grandes congregaciones, principalmente en la temporada reproductiva, permiten la coexistencia de varias especies y oportunidades de apareamiento cercanas. La hibridación puede ocurrir entre especies cercanamente relacionadas, así como entre diferentes subespecies de patos, o incluso entre especies más distantes si las barreras reproductivas naturales se superan (Tubaro & Lijtmaer, 2002; Lavretsky et al., 2019), en este caso, pueden cruzarse y producir descendencia híbrida (Jonhsgard, 1960).
Figura 2
Registros de hibridación en la familia Anatidae en México
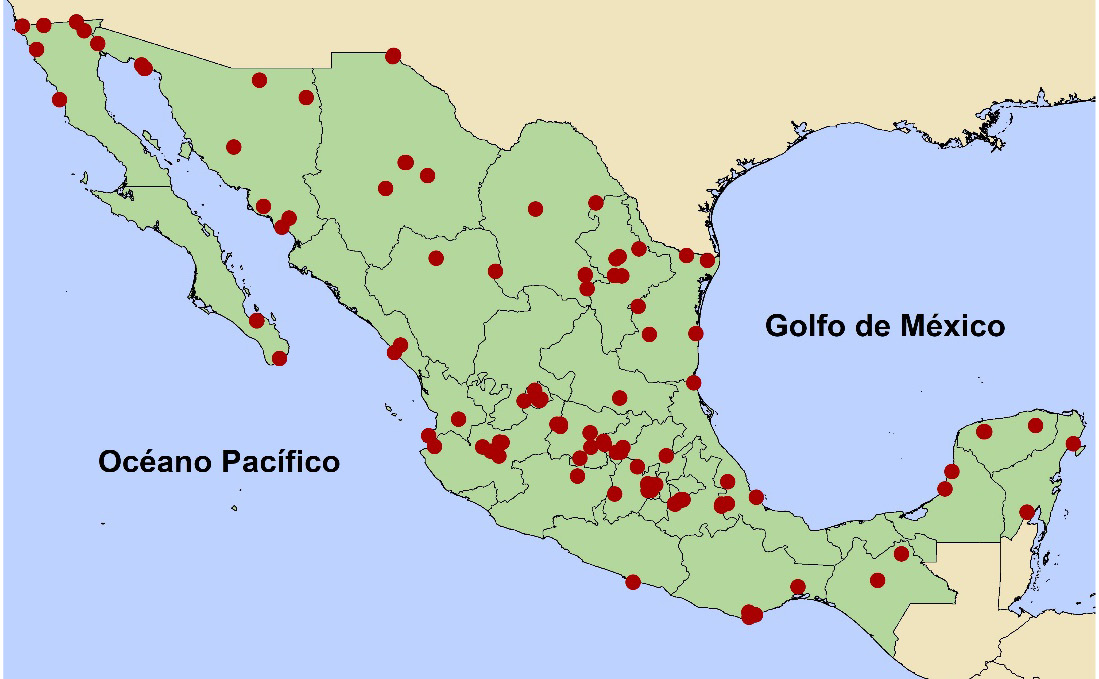
Notas. Registros de hibridación en la familia Anatidae en México con base en la información obtenida en la revisión de las publicaciones y complementada con eBird (2024), que incluyen: Pato de collar (Anas platyrhynchos) x Pato real (Cairina moschata), Pato de collar (Anas platyrhynchos) x Pato mexicano (Anas diazi), Cerceta canela (Spatula cyanoptera) x Cerceta alas azules (Spatula discors), Cerceta alas azules (Spatula discors) x Cerceta alas verdes (Anas crecca), Pato chalcuán (Mareca americana) x Pato golondrino (Anas acuta), Pato chalcuán (Mareca americana) x Pato silbón (Mareca penelope), Pato friso (Mareca strepera) x Pato cucharón norteño (Spatula clypeata), Cerceta canela (Spatula cyanoptera) x Pato cucharón norteño (Spatula clypeata), Cerceta alas azules (Spatula discors) x Pato cucharón norteño (Spatula clypeata). Mapa elaborado por Jorge E. Ramírez-Albores con base en la información obtenida.
Las razones de la hibridación son diversas e incluyen la competencia por recursos, la falta de individuos de la misma especie para el apareamiento, o simplemente la proximidad física entre especies. Los cambios en el clima y el ambiente pueden alterar la distribución de los patos y llevar a que especies que anteriormente no se encontraban juntas superpongan sus rangos de distribución y así aumenten las oportunidades de hibridación (Grant & Grant, 1992; Lavretsky et al., 2014, 2019).
A veces, el ser humano también puede llegar a influir en la hibridación al alterar los hábitats naturales, como la degradación de los humedales, la urbanización y la construcción de represas, lo que lleva a la fragmentación del hábitat y a la mezcla de especies que anteriormente estaban aisladas, aumentando así las oportunidades de hibridación. También por la introducción de especies exóticas o de especies nativas en cuerpos de agua artificiales en ambientes urbanos con fines estéticos, lo que conlleva a encuentros más frecuentes entre diferentes especies.
En general, la hibridación presenta implicaciones tanto positivas como negativas para las poblaciones de patos y sus ecosistemas. Puede llegar a generar diversidad genética y adaptabilidad, pero también conducir a la pérdida de la integridad genética de las especies puras y a la disminución de la diversidad genética a largo plazo (Kirby et al., 2004; Grant & Grant, 1992; Lavretsky et al., 2014, 2019). Los híbridos compiten con las especies parentales y otras especies nativas por recursos como alimento, hábitat y parejas para el apareamiento, lo cual puede resultar en una presión adicional sobre las especies nativas y en el desequilibrio de los ecosistemas (Lavretsky et al., 2014, 2019).
Las poblaciones de patos en general se adaptan a las condiciones específicas de su entorno local, sin embargo, la hibridación puede diluir estas adaptaciones locales y reducir la aptitud de las poblaciones para sobrevivir y reproducirse en su hábitat original. Adicionalmente, se puede alterar la estructura de la comunidad de aves acuáticas y otros organismos en los ecosistemas acuáticos. Los cambios en la composición de las especies provocan efectos cascada en la cadena alimentaria y en la salud del ecosistema. Finalmente, la presencia de híbridos dificulta los esfuerzos de conservación dirigidos a especies puras, lo cual resultar en la pérdida de la biodiversidad.
Importancia ecológica y económica
Este grupo de aves posee una importancia ecológica y socioeconómica significativa en los ecosistemas acuáticos y terrestres (Green & Elmberg, 2014). Entre sus funciones ecológicas se mencionan las siguientes.
1) Regulación de poblaciones de invertebrados y malezas acuáticas: al hacerlo, ayudan a controlar las poblaciones de estos organismos, crucial para mantener el equilibrio del ecosistema;
2) dispersión de semillas: ingieren semillas acuáticas y terrestres y luego las dispersan a través de sus deposiciones en diferentes hábitats, contribuyen así a la regeneración y diversidad de las comunidades vegetales;
3) calidad del agua: mientras se alimentan en el fondo del cuerpo de agua revuelven y remueven sedimentos, lo que ayuda a mejorar la calidad del agua al aumentar su oxigenación y su circulación.
4) ciclado de nutrientes: sus excrementos son ricos en nutrientes, como nitrógeno y fósforo, que fertilizan los suelos y promueven el crecimiento de plantas acuáticas y terrestres;
5) alimentación para depredadores: son una importante fuente de alimento para una variedad de depredadores, como aves rapaces y mamíferos;
6) indicadores de la salud ambiental: la presencia y el estado poblacional de estas aves ayuda a diagnosticar la salud ambiental de los ecosistemas acuáticos y terrestres.
La importancia económica de estas aves puede ser considerable en varias áreas, especialmente en regiones donde la caza, el turismo de observación de aves y la conservación de humedales desempeñan un papel significativo en la economía local. Muchas especies son cazadas por deporte y con fines comerciales en todo el mundo, y México no es la excepción (Clemente et al., 2014; Green & Elmberg, 2014). Esta actividad genera ingresos significativos para las comunidades locales a través de la venta de licencias de caza, equipos de caza, el servicios de guía, el alojamiento, el turismo y la venta de carne.
El turismo de observación de aves (birdwatching) es una atracción importante que genera ingresos a través de los tours guiados, el alojamiento, los alimentos y la venta de productos relacionados. Además de fomentar el contacto con la naturaleza, el aprendizaje sobre la vida silvestre y la apreciación de la biodiversidad, como una herramienta educativa valiosa para enseñar a las personas, especialmente a los niños, sobre la importancia de la biodiversidad y sus ecosistemas.
La presencia de patos, así como de otras especies de fauna silvestre en entornos naturales, proporciona una conexión directa con la naturaleza para las personas que viven en entornos urbanos o suburbanos. Esta conexión puede mejorar el bienestar emocional y psicológico, reducir el estrés y fomentar un sentido de responsabilidad hacia el ambiente.
Amenazas
Tal como otros grupos de fauna silvestre, los patos enfrentan una variedad de amenazas que afectan su supervivencia y el estado de sus poblaciones. Algunas de las principales amenazas son la pérdida del hábitat debido a la urbanización, la contaminación y la extracción de agua para uso humano y agrícola (Dorn et al., 2011; Nachuha & Quinn, 2012; Wilson et al., 2014).
La conversión de zonas naturales en áreas urbanas, agrícolas e industriales ha resultado en la pérdida y degradación de los hábitats acuáticos (Dalby et al., 2014; Green & Elmberg, 2014). La contaminación del agua por sustancias químicas, desechos industriales, agroquímicos, fertilizantes y residuos domésticos tiene efectos negativos tanto en estas aves como en otras especies de fauna y su entorno. Los contaminantes como plaguicidas y metales pesados (como cadmio, cobre, plomo y zinc) son sustancias químicas que se acumulan con el tiempo en los tejidos musculares, sangre u órganos, y causan alteraciones en el comportamiento, baja producción de huevos, adelgazamiento en la cáscara de los huevos, debilidad muscular, convulsiones, retraso en el crecimiento, intoxicaciones, anemia, entre otros (Colón-Quezada, 2019; Delgado-Díaz et al., 2019); además de afectar la calidad del agua y reducir la disponibilidad de recursos alimenticios.
Su estado de salud también se ve afectado por la presencia de virus como la herpesvirosis, una enfermedad letal proveniente de la carpa (Cyprinus carpio), que puede causar diversas alteraciones en diferentes tejidos y órganos (MacLachlan & Dubovi, 2011), así como por el influenzavirus y el paramixovirus (o virus de Newcastle), que provocan una alta mortalidad de aves y pérdidas económicas para el ser humano. Sus poblaciones también se ven afectadas por la presencia de endoparásitos (por ejemplo, helmintos y platelmintos) y ectoparásitos, como piojos masticadores y ácaros plumícolas, detectados en varias especies (Reeves et al., 2015; Aguilar-Morales et al., 2022; Padilla-Aguilar et al., 2022).
Aunado a los peligros mencionados, la caza y captura ilegal por su carne, plumas, huevos o para servir como mascotas es una amenaza significativa para muchas especies en diferentes regiones (Clemente et al., 2014). Los riegos descritos pueden reducir las poblaciones e impactar negativamente su capacidad reproductiva y el mantenimiento de sus poblaciones saludables (Dalby et al., 2014; Green & Elmberg, 2014). A pesar de las regulaciones, la caza furtiva sigue siendo un problema en algunas zonas rurales remotas o mal vigiladas (Clemente et al., 2014).
No obstante, se suman otras dos amenazas que preocupan: las interacciones con actividades humanas y el cambio climático (Guilleman et al., 2013; Dalby et al., 2014; Green & Elmberg, 2014). En cuanto a las primeras, los patos enfrentan amenazas adicionales como las colisiones con vehículos (autos, aviones) y edificaciones (ventiladores eólicos), el envenenamiento accidental por ingestión de plomo de balas de caza, la captura accidental en artes de pesca y los disturbios en áreas de reproducción y alimentación debido al turismo, la recreación, la pirotecnia y la presencia de fauna feral (como perros, gatos y ratas) que atacan y consumen huevos, polluelos e individuos adultos.
Por otro lado, el cambio climático puede tener efectos indirectos en los patos y sus hábitats; por ejemplo, cambios en los patrones de precipitación, la temperatura del agua y la disponibilidad de alimento. Estos cambios ocasionan alteraciones en las condiciones fisicoquímicas del hábitat, por ende, en la degradación de las zonas de alimentación, reproducción y refugio (Pearce et al., 2007; Dorn et al., 2011; Dalby et al., 2014), afectan la migración, el comportamiento, el éxito reproductivo y la supervivencia (Brua, 2002; Nachuha & Quinn, 2012; Wilson et al., 2014).
Necesidades de conservación e investigación
Las poblaciones de todas las especies de patos han disminuido considerablemente a lo largo de toda su área de distribución (figura 3), e incluso algunas especies han sido eliminadas localmente (Ayala-Pérez et al., 2013; Rodríguez-Casanova & Zuria, 2018; Cayetano-Rosas et al., 2023). De acuerdo con el informe sobre el estado poblacional de aves acuáticas del 2023, publicado por el Servicio Federal de Pesca y Vida Silvestre de Estados Unidos de América (US FWS, por sus siglas en inglés), la población total de patos estimada en 2023 fue de 32 320 millones de individuos, lo que representa una disminución del 7% con respecto al año anterior, debido a la reducción de 9% en la extensión y calidad de las áreas de reproducción.
Por otra parte, su estado de conservación varía según la especie y la región geográfica. Las poblaciones de especies como el pato de collar (Anas platyrhynchos) y la cerceta alas azules (Spatula discors) han disminuido en 17% y 19%, respectivamente (figura 3), mientras que las poblaciones de pato golondrino (Anas acuta) han aumentado en 24%. Algunas especies de patos presentan poblaciones estables y saludables, como la cerceta cucharón (Spatula clypeata) y el pato friso (Mareca strepera), que suelen adaptarse y prosperar en una variedad de hábitats acuáticos y terrestres.
Igualmente, algunas especies enfrentan amenazas significativas debido a la pérdida de hábitat, la contaminación del agua, la caza inmoderada y otros factores humanos, y se encuentran bajo algún estatus de vulnerabilidad. Entre ellas, el pato tejano (Anas fulvigula), el pato mexicano (Anas diazi), el pato real (Cairina moschata) y el pato enmascarado (Nomonyx dominicus) dentro de la normatividad mexicana, así como la negreta pico amarillo (Melanitta americana) y el pato cola larga (Clangula hyemalis) a nivel internacional.
Figura 3
Estado poblacional de algunas especies de patos en Norteamérica
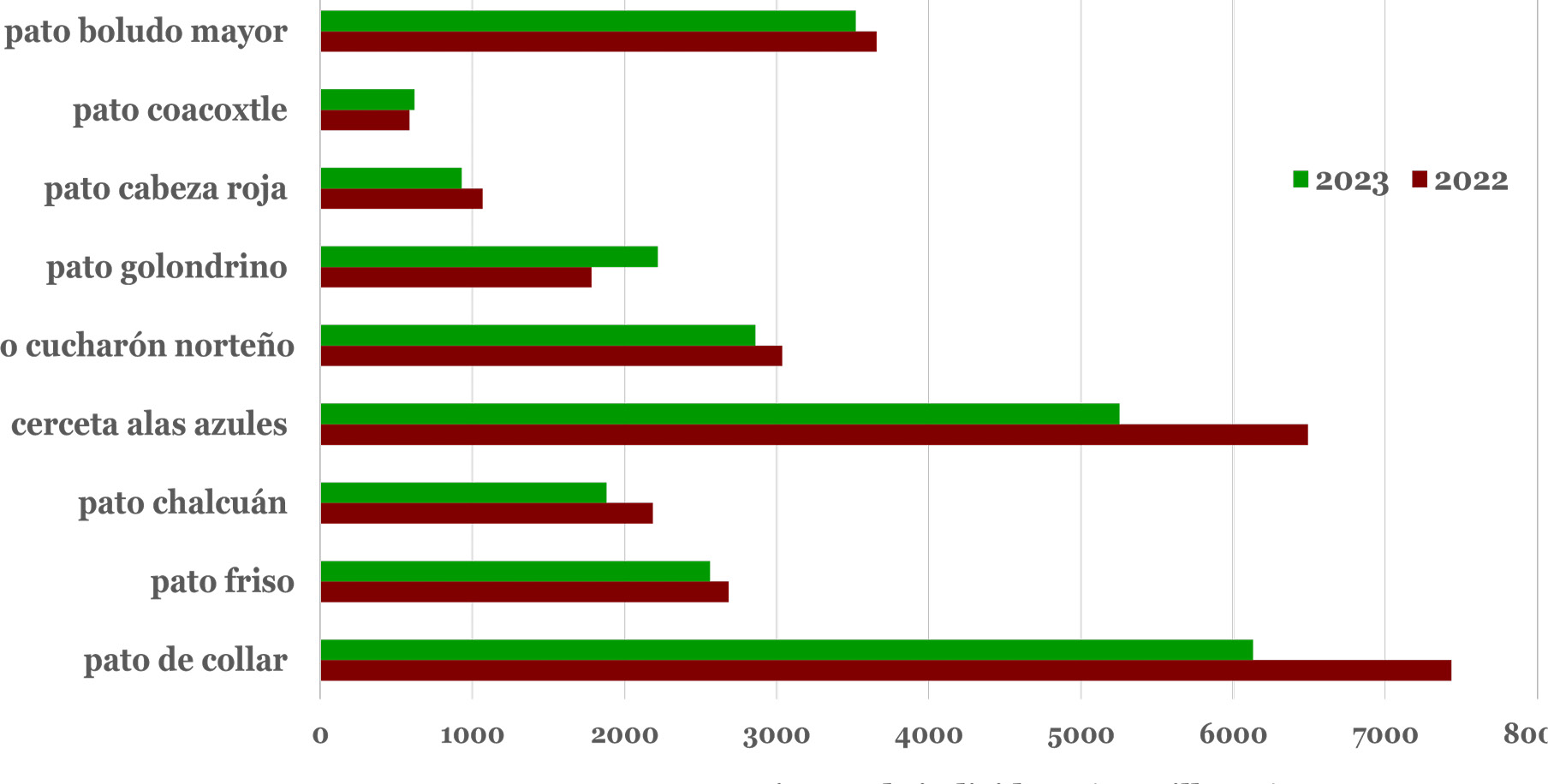
Notas. Cerceta alas azules (Spatula discors), pato cucharón norteño (Spatula clypeata), pato friso (Mareca strepera), pato chalcuán (Mareca americana), pato de collar (Anas platyrhynchos), pato golondrino (Anas acuta), pato coacoxtle (Aythya valisineria), pato cabeza roja (Aythya americana) y pato boludo mayor (Aythya marila). Gráfico elaborado por Jorge E. Ramírez-Albores con base en la información obtenida del Servicio Federal de Pesca y Vida Silvestre de Estados Unidos de América (2023, USFWS por sus siglas en inglés).
A pesar de ser un grupo de aves común, diverso, ampliamente distribuido a lo largo del país y de gran importancia ecológica y socioeconómica, los estudios sobre su ecología son muy escasos (n=100, figura 4). Entre los tópicos más estudiados se encuentran los patrones de distribución, ya que juegan un papel crucial en la dinámica poblacional (n=20), seguidos por la dinámica de comunidades (n=16), el parasitismo (n=12) y la reproducción (n=11)- figura 4-.
La mayor parte de la información y estudios se centra en su composición y en la variación espaciotemporal como grupo (i.e., a nivel de familia; n=39), y solo algunos de estos estudios son específicos. Entre las especies más estudiadas se encuentran Dendrocygna autumnalis (n=15), Anas diazi (n=15), Spatula discors (n=12) y Spatula clypeata (n=8).
En los estudios, se ha evaluado la interacción entre hábitat, el éxito reproductivo y el parasitismo, siendo las zonas agrícolas irrigadas por inundaciones o con riego, así como los humedales, los sitios más importantes para la reproducción y el forrajeo (Rodríguez-Casanova & Zuria, 2018; Ramírez-Albores & Pérez-Suárez, 2019; Bautista-Trejo et al., 2023).
Otros estudios mencionan los cambios poblacionales en diferentes regiones (Palacio-Núñez et al., 2008; Chacón et al., 2017; Sigala-Meza et al., 2022; Cayetano-Rosas et al., 2023) y también sobre la ampliación de su rango de distribución, las nuevas áreas de anidación o los nuevos registros de presencia (Richard et al., 2009; Berumen-Solorzano et al., 2016; Güitrón-López & Huerta-Martínez, 2018).
Las tendencias en la investigación hasta la fecha abarcan una variedad de disciplinas científicas y áreas de estudio que abordan aspectos clave de la conservación, la ecología, el comportamiento, la genética y la salud de estas aves acuáticas, reflejadas en una combinación de preocupaciones locales y regionales. Por ejemplo, la comprensión de la dinámica poblacional, incluyendo su distribución, abundancia, migración y reproducción, es fundamental para plantear estrategias de conservación.
Figura 4
Tendencias en investigación de la familia Anatidae en México
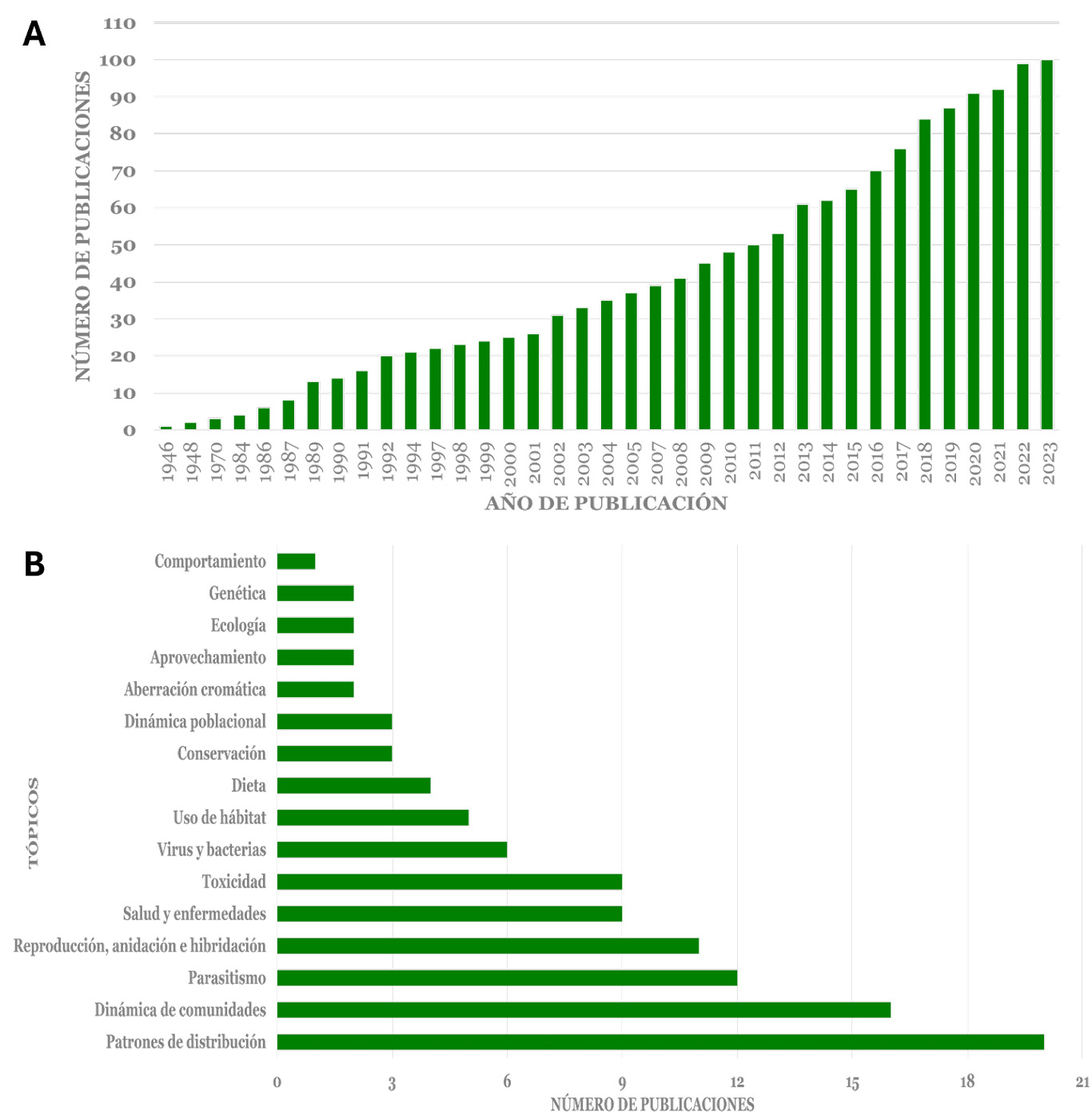
Notas. (A) número de publicaciones por año y (B) tópicos de investigación. Gráficos elaborados por Jorge E. Ramírez-Albores con base en la información obtenida.
Por otra parte, los estudios sobre su comportamiento en relación con la reproducción, la migración, la alimentación y la interacción con otros individuos y especies pueden proporcionar información valiosa sobre sus necesidades ecológicas y la adaptación a entornos cambiantes. Mientras el estudio de la genética de poblaciones puede brindar información sobre su diversidad genética, estructura poblacional, endogamia, hibridación y adaptación evolutiva.
El cambio climático afecta significativamente a los patos y sus hábitats, que incluyen cambios en su distribución, fenología, reproducción y supervivencia. Los estudios en esta materia deben centrarse en comprender cómo responden al cambio climático e identificar estrategias de adaptación y mitigación para garantizar su supervivencia a largo plazo.
Particularmente, se ha detectado una falta de estudios sobre este grupo de aves en tópicos como diversidad funcional, hibridación, demografía, ecología reproductiva y efectos en la salud de las aves, los cuales son áreas de oportunidad, dado que son aves tolerantes a las modificaciones en la agricultura y a otras actividades antrópicas. No obstante, las modificaciones pueden afectar ciertas características individuales como el sexo, la inmunología, el peso corporal, entre otros aspectos.
Asimismo, estas aves pueden verse afectadas por una variedad de enfermedades, incluyendo enfermedades infecciosas, parasitarias y zoonóticas. La investigación en este campo puede incluir estudios epidemiológicos, monitoreo de enfermedades, evaluación de riesgos para la salud pública y desarrollo de medidas de control y prevención. Estos estudios son fundamentales para informar sobre la gestión y conservación de estas aves y sus hábitats en un mundo en constante cambio.
Conclusiones
Los esfuerzos de conservación que incluyen la protección de humedales, la restauración de hábitats degradados y la gestión sostenible de las áreas de reproducción y alimentación son cruciales para mantener saludables las poblaciones de patos. Por tanto, la conservación de los hábitats acuáticos es fundamental para su supervivencia.
En suma, la conservación de los ambientes acuáticos y la regulación de las actividades humanas son elementos clave en los esfuerzos para proteger a los patos y mantener la biodiversidad en los ecosistemas acuáticos y terrestres. Además de seguir realizando monitoreos regulares y estudios científicos sobre su estatus poblacional para evaluar su estado de conservación e identificar posibles amenazas, ya que los datos son fundamentales para la toma de decisiones en materia de conservación y manejo de la fauna silvestre.
Aunado a lo anterior, los anátidos cobran una importancia social que va más allá de su valor ecológico y económico. Las actividades sociales, económicas y recreativas que genera su presencia fortalecen los lazos sociales, fomentan la recreación al aire libre, proporcionan oportunidades de educación y concientización ambiental y promueven una conexión más profunda con la naturaleza.
Referencias
Aguilar-Morales, A., Sánchez-Nava, P., Aguilar, C.J. y Rodríguez-Romero, F. (2022). Variaciones morfométricas del género Notocotylus (Digenea: Notocotylidae), parásitos de aves acuáticas (Rallidae y Anatidae) en las ciénegas de Lerma, Estado de México. Acta Zoológica Mexicana (n.s.), 38, 1-16. https://doi.org/10.21829/azm.2022.3812402
Arzel, C., Elmberg, J. & Guillemain, M. (2006). Ecology of spring-migration Anatidae: a review. Journal of Ornithology, 147, 167-184. https://doi.org/10.1007/s10336-006-0054-8
Ayala-Pérez, V., Arce, N. y Carmona, R. (2013). Distribución espaciotemporal de aves acuáticas invernantes en la Ciénega de Tláhuac, planicie lacustre de Chalco, México. Revista Mexicana de Biodiversidad, 84, 327-337. https://doi.org/10.7550/rmb.28632
Bautista-Trejo, R., Ramírez-Hernández, M., Gómez-Garduño, J.O., Valverde-Nieto, J.G., Cayetano-Rosas, H., Piñón-Santoyo, N., Cabañas-Pérez, J.P. y Ramírez-Albores, J.E. (2023). Aves del Parque Estatal Ecológico, Turístico y Recreativo Sierra Hermosa, Estado de México. Ecosistemas y Recursos Agropecuarios, 10, e3747. https://doi.org/10.19136/era.a10n3.3747
Berumen-Solorzano, A., Maimone, M.R., Villordo, J.A., Olivera, C.I., Martínez, E.G. y González-Oreja, J.A. (2016). Nuevos registros de aves acuáticas en la Presa de Valsequillo, Puebla. Huitzil, 17; 139-144.
Brua, R.B. (2002). Ruddy Duck (Oxyura jamaicensis). In Rodewald, P.G. (ed.), The birds of North America. Ithaca: Cornell Lab of Ornithology. Disponible en: https://www.birdsna.org/ Species-Account/bna/species/rudduc (consultado el 25 de febrero de 2024).
Cayetano-Rosas, H., Ramírez-Hernández, M., Gómez-Garduño, J.O., Piñón, N., Bautista-Trejo, R., Valverde, J.G. y Ramírez-Albores, J.E. (2023). Composición espacial y temporal de aves acuáticas y rapaces en humedales del centro de México. Cuadernos de Investigación UNED, 15, e4382. https://doi.org/10.22458/urj.v15i1.4382
Chacón, J.E., Pompa-García, M., Treviño-Garza, E., Martínez-Guerrero, J., Aguirre-Salado, C., Pereda-Solís, M. (2017). La abundancia de aves acuáticas (Anseriformes) en relación con la complejidad del paisaje en un sitio RAMSAR del norte de México. Acta Zoológica Mexicana (n.s.), 33, 199-210.
Chalfoun, A.D., Thompson, F.R. & Ratnaswany, M.J. (2002). Nest predators and fragmentation: A review and metanalysis. Conservation Biology, 16, 306–318. https://doi.org/10.1046/j.1523-1739.2002.00308.x
Clemente, F., Carmona, R., Palacio, J., Martínez, I. y Danemann, G.D. (2014). Patos y gansos de México. Pp. 159-190. En: Valdez, R. y Ortega, J.A. (eds.). Ecología y manejo de fauna silvestre en México. Guadalajara, México: El Colegio de Postgraduados.
Colón-Quezada, D. (2009). Composición de la dieta de otoño del pato mexicano (Anas diazi) en el vaso sur de las Ciénegas del Lerma, Estado de México. Revista Mexicana de Biodiversidad, 80, 193-202. https://doi.org/10.22201/ib.20078706e.2009.001.596
Dalby, L., McGill, B.J., Fox, A.D. & Svenning, J.-C. (2014). Seasonality drives global scale diversity patterns in waterfowl (Anseriformes) via temporary niche exploitation. Global Ecology and Biogeography, 23, 550–562. https://doi.org/10.1111/geb.12154
Delgado-Díaz, D.M., Zarza, H., Flores-Hernández, N., Cruz-Monterrosa, R.G., Rayas-Amor, A.A., Díaz, M., Jiménez-Guzmán, J., García-Garibay, M., Miranda, G. y Hernández-Flores, L.I. (2019). Presencia de metales pesados en pato mexicano (Anas diazi, Ridgway). Agroproductividad, 12, 89-92. https://doi.org/10.32854/agrop.vi0.1504
Dorn, N.J., Cook, M.I., Herring, G., Boyle, R.A., Nelson, J. & Gawlik, D.E. (2011). Aquatic prey switching and urban foraging by the White Ibis (Eudocimus albus) are determined by wetland hydrological conditions. Ibis, 153, 323-335. https://doi.org/10.1111/j.1474-919X.2011.01101.x
Drever, M.C., Clark, R.G., Derksen, C., Slattery, S.M., Toose, P. & Nudds, T.D. (2012). Population vulnerability to climate change linked to timing of breeding in boreal ducks. Global Change Biology, 18, 480–492. https://doi.org/10.1111/j.1365-2486.2011.02541.x
Ducks Unlimited (2011). Conozca los patos y gansos. Una guía para la identificación de anátidos en México. [3a ed.], Ducks Unlimited de México. México.
eBird (2024). eBird: an online database of bird distribution and abundance [web application]. eBird, Cornell Lab of Ornithology, Ithaca, NY. https://www.ebird.org. (consultado 10 de enero de 2024).
Gammonley, J.H. & Laubhan, M.K. (2002). Patterns of food abundance for breeding waterbirds in the San Luis Valley of Colorado. Wetlands, 22, 499-508.
Grant, P.R. & Grant, B.R. (1992). Hybridization of bird species. Science, 256, 193-197.
Green, A.J. & Elmberg, J. (2014). Ecosystem services provided by waterbirds. Biological Reviews, 89, 105–122. https://doi.org/10.1111/brv.12045
Guillemain, M., Pöysä, H., Fox, A.D., Arzel, C., Dessborn, L., Ekroos, J., Gunnarsson, G., Holm, T.E., Christensen, T.K., Lehikoinen, A., Mitchell, C., Rintala, J. & Mǿller, A.P. (2013). Effects of climate change on European ducks: what do we know and what do we need to know? Wildlife Biology, 19, 404-419. https://doi.org/10.2981/12-118
Güitrón-López, M.M. y Huerta-Martínez, F.M. (2018). Nuevos registros de aves acuáticas para el interior del Estado de Jalisco: caso Laguna de Sayula, México. Acta Universitaria, 28, 14-19. https://doi.org/10.15174/au.2018.1945
Howell, S.N.G. & Webb, S. (1995). A guide to the birds of Mexico and northern Central America. Oxford, NY: Oxford University Press.
Johnsgard, P.A. (1960). Hybridization in the Anatidae and its Taxonomic Implications. Papers in Ornithology, 71.
Keddy, P.A. (2010). Wetland ecology: principles and conservation. [2a. ed.], Cambridge, UK: Cambridge University Press.
Kirby, R.E., Sargeant, G.A. & Shutler, D. (2004). Haldane´s rule and American Black Duck x Mallard hybridization. Canadian Journal of Zoology, 82, 1827-1831. https://doi.org/10.1139/z04-109
Lavretsky, P., Janzen, T. & McCracken, K.G. (2019). Identifying hybrids and the genomics of hybridization: Mallards and American Black Ducks of Eastern North America. Ecology and Evolution, 9; 3471-3490. https://doi.org/10.1002/ece3.4981
Lieske, D.J., Pollard, B., Gloutney, M., Milton, R., Connor, K., Dibblee, R., Parsons, G. & Howerter, D. (2012). The importance of agricultural landscapes as key nesting habitats for the American Black ducks in Maritime Canada. Waterbirds, 35, 525-534. https://doi.org/10.1675/063.035.0403
Lorenz, K. (1993). Consideraciones sobre las conductas animal y humana. México. D.F.: Planeta Mexicana.
MacLachlan, N.J. & Dubovi, E.J. (2011). Fenner´s Veterinary Virology. [4th ed.], New York: Academic Press.
McCarthy, E.M. (2006). Handbook of avian hybrids of the world. Oxford, NY: Oxford University Press.
Nachuha, S. & Quinn, J.L. (2012). The distribution of colonial waterbirds in relation to a Ugandan rice scheme. Waterbirds, 35, 590-598. https://doi.org/10.1675/063.035.0408
Padilla-Aguilar, P., Romero-Callejas, E., García-Márquez, L.J., Cruz-Mendoza, I. y Alcalá-Castro, Y. (2022). Nuevos registros y listado de protozoarios y artrópodos de aves acuáticas de la familia Anatidae en humedales mexicanos. Acta Zoológica Mexicana (n.s.), 38, 1-24. https://doi.org/10.21829/azm.2022.3812424
Palacio-Núñez, J., Jiménez-García, D., Olmos-Oropeza, G. y Enríquez-Fernández, J. (2008). Distribución y solapamiento espacial de las aves acuáticas y ribereñas en un humedal de zonas semiáridas del NE de México. Acta Zoológica Mexicana (n.s.), 24, 125-141.
Pearce, C.M., Green, M.B. & Baldwin, M.R. (2007). Developing habitat models for waterbirds in urban wetlands: a long-linear approach. Urban Ecosystems, 10, 239-254. https://doi.org/10.1007/s11252-007-0026-7
Phillips, M.L., Clark, W.R., Nusser S.M., Sovada M.A. & Greenwood, R.J. (2004). Analysis of predator movement in prairie landscapes with contrasting grassland composition. Journal of Mammalogy, 85,187–195. https://doi.org/10.1644/1545-1542(2004)085<0187:AOPMIP>2.0.CO;2
Ramírez-Albores, J.E. y Pérez-Suarez, M. (2019). El papel de la Universidad Autónoma del Estado de México campus El Cerrillo como refugio de la diversidad de aves en el Valle de Toluca, México. Ciencia ergo sum, 25, e32. https://doi.org/10.30878/ces. v25n3a10
Reeves, A.B., Smith, M.M., Meixell, B.W., Fleskes, J.P. & Ramey, A.M. (2015). Genetic diversity and host specificity varies across three genera of blood parasites in ducks of the Pacific Americas Flyway. PloS One, 10, e0116661. https://doi.org/10.1371/journal.pone.0116661
Richard, A., Erickson, A., Hamilton, R., González-Guzmán, S. y Ruíz, G. (2009). Primeros registros de anidación del pato friso (Anas strepera) en México. Anales Del Instituto de Biología serie Zoología, 73(001). Recuperado de https://www.revistas.unam.mx/index.php/zoo/article/view/7255 (consultado el 10 de enero de 2024).
Rodríguez-Casanova, A.J. y Zuria, I. (2018). Biología reproductiva de anátidos (familia Anatidae) en la laguna de Zumpango, Estado de México. Huitzil, 19, 1-13. https://doi.org/10.28947/hrmo.2018.19.1.301
Ross, B.E., Hooten, M.B., DeVink, J. & Koons, D.N. (2015). Combined effects of climate, predation, and density dependence on greater and lesser scaup population dynamics. Ecological Applications, 25, 1606–1617. https://doi.org/10.1890/14-0582.1
Saavedra, D. (2019). Perdido el 62% de humedales en México. Gaceta UNAM, disponible en https://www.gaceta.unam.mx/perdido-el-62-de-humedales-en-mexico/ (consultado el 24 de febrero de 2024).
Sibley, D.A. (2014). The Sibley guide to birds. [2nd ed.], Knopf Publishing Group.
Sigala-Meza, E., Mellink, E. & Hinojosa-Corono, A. (2022). Waterbird communities and wetland dynamics in the Mexican Highlands, 1951-2006. Wetlands Ecology and Management, 30, 1153-1165. https://doi.org/10.1007/s11273-022-09873-5
Skone, B.R., Rotella, J.T. & Walker, J. (2016). Waterfowl production from winter wheat fields in North and South Dakota. Journal of Wildlife Management, 80, 127–137. https://doi.org/10.1002/jwmg.993
Tubaro, P.L. & Lijtmaer, D.A. (2002). Hybridization patterns and the evolution of reproductive isolation in ducks. Biological Journal of the Linnean Society, 77, 193-200. https://doi.org/10.1046/j.1095-8312.2002.00096.x
Walker, J., Rotella J.T., Stephens S.E., Lindberg M.S., Ringelman J.K., Hunter C. & Smith, A.J. (2013). Time-lagged variation in pond density and primary productivity affects duck nest survival in the Prairie Pothole Region. Ecological Applications, 23, 1061–1074. https://doi.org/10.1890/12-1755.1
Weller, M.W. (2001). Wetland birds, habitat resources and conservation implications. Cambridge, UK: Cambridge University Press.
Wilson, S., Bazin, R., Calvert, W., Doyle, T., Earsom, S., Oswald, S. & Arnold, J. (2014). Abundance and trends of colonial waterbirds in the Large Lakes of Southern Manitoba. Waterbirds, 37, 233-347. https://doi.org/10.1675/063.037.0302
Winkler, D.W., Billerman, S.M. & Lovette, I.J. (2020). Ducks, Geese, and Waterfowl (Anatidae), version 1.0. In Birds of the World. Billerman, S.M., Keeney, B.K., Rodewald P.G. & Schulenberg, T. S. (eds.). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.anatid1.01
Biocenosis • Volumen 35/ Número 1/ 39-52 / Enero-Junio, 2024

1 Doctor en Ciencias Ambientales. Docente de la Universidad Autónoma Agraria Antonio Narro, Departamento de Botánica. Saltillo, Coahuila, México. jorgeramirez22@hotmail.com
ID: https://orcid.org/0000-0001-5295-3717