Diversidad biológica y patrones de actividad de mamíferos
del Corredor Biológico Alexander Skutch, Costa Rica
Biological diversity and patterns of mammal activity in the Alexander Skutch Biological Corridor, Costa Rica
Jesús Alberto Herrera Mora1
DOI: 10.22458/rb.v35i1.5349
Recibido – Received: 29/ 03/ 2024 / Corregido – Revised: 10 /05 / 2024 / Aceptado – Accepted: 23/ 05 / 2024
RESUMEN
Los corredores biológicos surgen como una estrategia esencial para la conservación de la biodiversidad, constituyen la segunda estrategia de conservación más importante del país, solo superada por la de áreas silvestres protegidas. Facilitan el movimiento de fauna entre fragmentos de bosque, pero su efectividad depende de la evaluación de su conectividad. Este estudio se enfocó en mamíferos medianos y grandes en el Corredor Biológico Alexander Skutch. Se utilizaron datos de cámara trampa en nueve puntos entre 2020-2021. Se registraron 692 mamíferos de 21 especies, 14 familias y 8 órdenes, se incluyen felinos y alta presencia de perros domésticos. Especies como Dasyprocta punctata (cherenga), Philander melanurus (zarigüeya de cuatro ojos), Dasypus novemcinctus (armadillo de nueve bandas) y Didelphis marsupialis (zorro pelón), fueron abundantes, mientras que otras como Odocoileus virginianus (venado de cola blanca), Canis latrans (coyote), Herpailurus jagouaroundi (jaguarundi) y Mustela frenata (comadreja), menos comunes. La actividad fue principalmente nocturna o crepuscular. La detección de perros domésticos sugiere insuficiente protección en áreas bajas del corredor. Aunque la riqueza de especies fue alta y la presencia de felinos indica salud del ecosistema, la falta de conectividad podría afectar especies como el Puma concolor (puma). Los patrones de actividad coincidieron con estudios previos. Se concluye que es necesario mejorar la protección y la conectividad para la conservación efectiva de la biodiversidad en el corredor.
Palabras clave: bosque; ecosistema; conectividad; cámara trampa; mamíferos; estimador de riqueza.
ABSTRACT
The biological corridors represent an essential strategy for diversity conservation, they constitute the second most important strategy in the country just behind the protected wildlife areas. They facilitate fauna movements between forest fragments; however, its effectiveness depends on the evaluation of its connectivity. This study focuses on medium-sized and big mammals in the Alexander Skutch Biological Corridor. Data from camera traps in nine spots between 2020-2021 were used. 692 mammals of 21 especies, 14 families and 8 orders were recorded, including felines and the high presence of pet dogs. Species such as Dasyprocta punctata (cherenga), Philander melanurus (zarigüeya de cuatro ojos), Dasypus novemcinctus (armadillo de nueve bandas) and Didelphis marsupialis (zorro pelón), were abundant, whereas others such as Odocoileus virginianus (venado de cola blanca), Canis latrans (coyote), H. jagouaroundi (jaguarundi) and Mustela frenata (comadreja), less common. The activity was mainly at night or at dusk. The spotting of pet dogs suggests underprotection in the low areas of the corridor. Although there was high diversity of species and the presence of felines indicates a healthy ecosystem, the lack of connectivity may affect species such as P. concolor (puma). The activity pattens coincided with previous studies. It is necessary to improve the protection and connectivity for effective biodiversity conservation in the corridor.
Keywords: forest; ecosystem; connectivity; camera trap; mammals; richness estimators.
Introducción
Costa Rica es el hogar de 256 especies de mamíferos, equivalentes a aproximadamente 4% de los mamíferos del mundo (Upham et al., 2022; Ramírez-Fernández et al., 2023). Se destacan las 59 especies de mamíferos terrestres no voladores medianos y grandes, donde el orden Carnívora contabiliza el mayor número de especies -25 especies y 7 familias- (Reid & Gómez-Zamora, 2022). Estas son indispensables para el buen funcionamiento de los ecosistemas, debido a que desempeñan roles ecológicos esenciales para su funcionamiento y equilibrio (Lacher et al., 2019; Marín-Pacheco et al., 2022), tales como la dispersión y polinización de plantas, por lo que son importantes en la regeneración y mantenimiento del bosque (Castro-Avendaño et al., 2019: Sánchez-Porras et al., 2019). Asimismo, los grandes carnívoros mantienen en equilibrio a las especies herbívoras y omnívoras por medio de la depredación, lo cual impacta directamente la estructura y composición vegetal (Mattey-Trigueros et al., 2021).
No obstante, este grupo faunístico es amenazado por la pérdida o fragmentación del bosque debido a sus requerimientos de espacio, alimentación y refugio. Lo anterior, producto de las actividades antropogénicas, que desencadenan cambios en el uso del suelo, como lo son la expansión urbana, agrícola y ganadera. Dichos procesos han causado la pérdida de grandes extensiones de bosques tropicales, lo que podría desencadenar con el tiempo peligrosos declives en las poblaciones de mamíferos (Hoang & Kanemoto, 2021; Morera-Beita et al., 2021). Igualmente, se debe mencionar la cacería ilegal y la introducción de especies exóticas, ambas alteran negativamente la dinámica poblacional de los mamíferos silvestres (Rivas et al., 2018; Zavala et al., 2018).
Por tanto, a lo largo de los años se han implementado estrategias para la conservación de la biodiversidad en el país, las cuales se enfocan principalmente en las áreas silvestres protegidas (Pimm et al., 2018). Sin embargo, estas no poseían la efectividad suficiente para contener o mantener elevados porcentajes de biodiversidad o poblaciones de mamíferos viables. Asimismo, no fomentaban una conectividad estructural adecuada entre ecosistemas, por lo que se afecta el movimiento de especies y se provoca su aislamiento (Pringle, 2017; Arias-Navarro et al., 2021; Marín-Pacheco et al., 2022). Por lo anterior, el SINAC promovió los corredores biológicos mediante el Programa Nacional de Corredores Biológicos de Costa Rica, por medio del Decreto Ejecutivo n.°٤٠٠٣ (SINAC, ٢٠٠٩). Esto con el fin de impulsar el movimiento de especies entre las áreas silvestres protegidas, la conservación y el uso sostenible de la biodiversidad en el país (Decreto Ejecutivo n.°٤٠٠٤٣, ٢٠١٦).
Dentro de los corredores se destaca el Corredor Biológico Alexander Skutch, ubicado dentro del Área de Conservación La Amistad-Pacífico (ACLAP-P). Se creó en 2005 con el fin de conservar y recuperar el único relicto de bosque tropical siempreverde del país (SINAC, 2018). Además, este sirve como zona de amortiguamiento para el Parque Nacional Chirripó y busca su conexión con el Refugio de Vida Silvestre Los Cusingos y el Refugio de Vida Silvestre Las Nubes; conectividad que se logra tomando el río Peñas Blancas como núcleo (Vargas-Salazar, 2016). Para evaluar esta conectividad es indispensable generar información sobre los grupos faunísticos. Siendo los mamíferos una buena elección, ya que son bioindicadores de la salud del bosque, debido a sus requerimientos específicos de hábitat; por lo que se debe velar por su conservación y manejo (Marín-Pacheco et al., 2022).
Objetivo
El trabajo se desarrolló con el fin de conocer la riqueza, abundancia relativa, diversidad y patrones de actividad de los mamíferos en las distintas rutas de conectividad del Corredor Biológico Alexander Skutch, de forma que sea útil en la toma de decisiones relacionadas con la conservación de las especies.
Materiales y métodos
El Corredor Biológico Alexander Skutch (CoBAS) pertenece al Área de Conservación la Amistad Pacífico (ACLA-P) y se encuentra localizado en las faldas de la Cordillera de Talamanca; su división político-administrativa abarca los distritos de El General y Cajón de Pérez Zeledón, en San José. Este corredor es de suma importancia, dado que brinda conexión entre el Refugio de Aves Dr. Alexander Skutch “Los Cusingos” a 650-750 msnm, el Refugio de Vida Silvestre las Nubes y limita al norte y noreste con el Parque Nacional Chirripó, cerca de los 3000 msnm (Canet, 2005). Asimismo, el CoBAS cuenta con un territorio aproximado de 6027 ha, abarca principalmente la subcuenca del río Peñas Blancas, con 74, 9% del área total (Arauz-Beita & Arias-Navarro, 2016; Acuña-Prado et al., 2017). En tanto, la conectividad del CoBAS se compone de 50% de bosques de galería densos y en regeneración y 50% de otros usos no forestales -figura 1- (SINAC, 2018).
Figura 1
Puntos de muestreo, usos del suelo, rutas de conectividad y ríos del Corredor Biológico Alexander Skutch, Pérez Zeledón, San José, Costa Rica (rutas de conectividad: 1-Río Peñas Blancas, 2-Río Caliente)
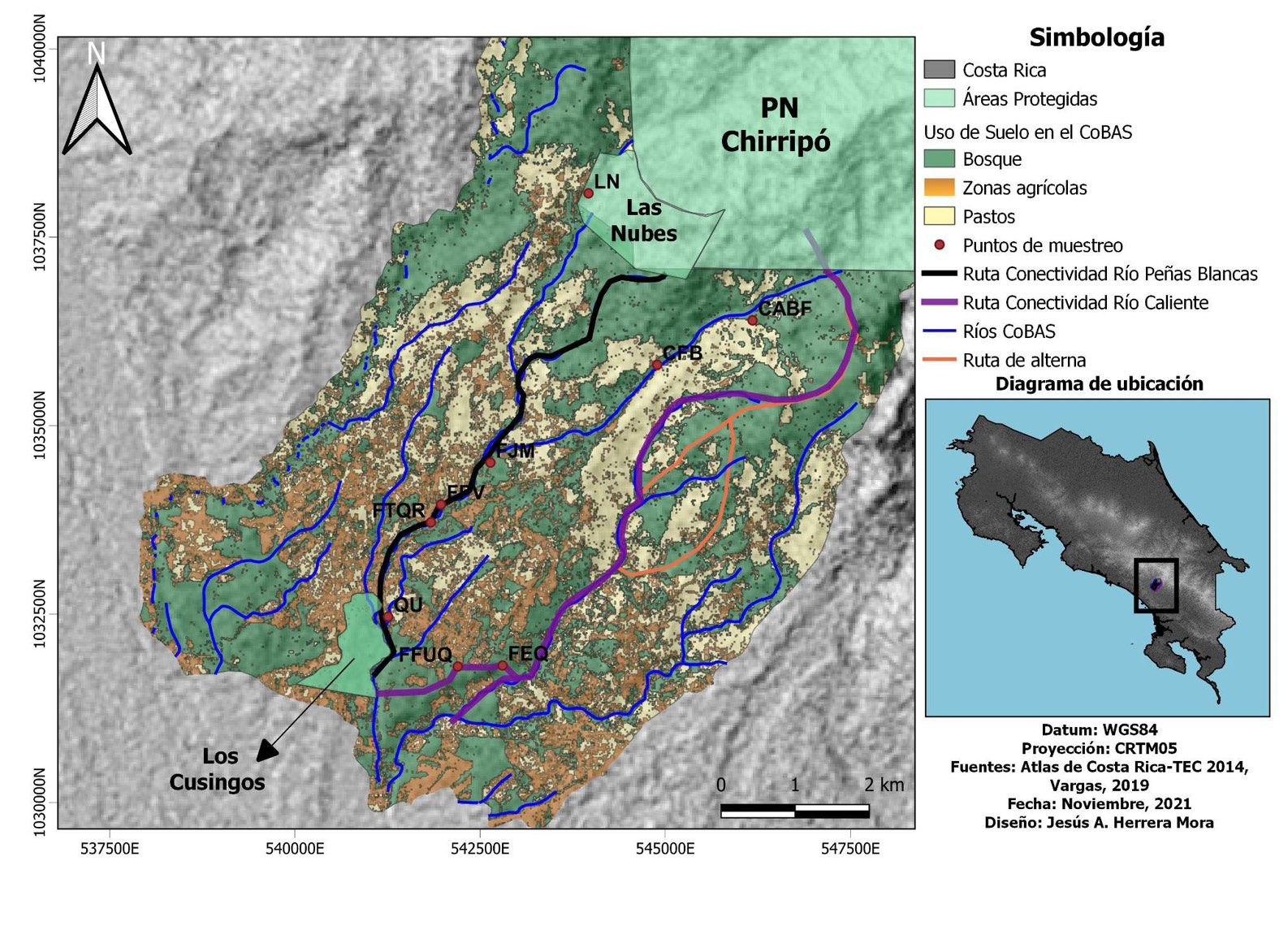
Nota. Elaborado por Jesús Herrera-Mora.
El sitio abarca temperaturas promedio de 27° C en el día y 18°C por la noche, sin embargo, en zonas altas se puede alcanzar una media de 10° C. La precipitación anual a lo largo de todo el corredor es de aproximadamente 3238 mm, siendo mayor en las regiones altas (Mendez-Fernández, 2020). Se debe destacar que es un sitio en el cual llueve todo el año, debido a su clima ecuatorial característico, lo cual provoca que los ríos mantengan su caudal a lo largo del año (Acuña-Prado et al. 2017). En cuanto a las zonas de vida del CoBAS, predominan el bosque pluvial montano bajo (BP-MB) que cubre 5% en zonas altas. El bosque pluvial premontano (bp-P), característico de los sectores medios y altos, abarca la mayor proporción en el corredor con 57%. Por último, se encuentra el bosque muy húmedo premontano (bmh-MB) con 38% de las regiones bajas del corredor (Holdridge, 1987; SINAC, 2018).
Métodos
Para elaborar el estudio, se emplearon datos de cámaras trampa (Bushnell) proporcionados por el Refugio de Aves Dr. Alexander Skutch “Los Cusingos”, los cuales contenían información de nueve puntos a lo largo del CoBAS. Estos puntos estuvieron ubicados en elevaciones que variaban desde los 703,3 msnm en Quizarrá Ureña (QU), hasta su punto máximo de 1297 msnm en Canforro Arriba Bill Foster (CABF), según el GPS utility.
En cuanto a su distribución, las cámaras fueron colocadas en fragmentos de bosque que sirven como rutas de conectividad en el CoBAS. Además, se mantuvieron activas durante períodos de época seca (enero, febrero y diciembre de 2020; febrero a abril de 2021) y época lluviosa (julio a noviembre de 2020; mayo a agosto de 2021).
Respecto a la clasificación del tamaño de los mamíferos, esta se realizó según su peso, considerando como tamaño mediano aquellos con pesos en el rango de 101 g a 10 kg, mientras que se consideraron grandes aquellos que superaban los 10 kg (Sánchez-Porras et al., 2019; Gonzáles-Tenorio et al., 2021; Reid & Gómez-Zamora, 2022).
Además de lo anterior, se utilizaron el programa Quantum Gis 3.26 (QGIS, 2022), el Atlas Digital CR (ITCR, 2014) y las capas de Vargas (2019) para la elaboración de mapas. Estas herramientas permitieron representar el área del CoBAS, con sus respectivas áreas protegidas, además de localizar los nueve puntos de muestreo. Así también, se representaron rutas de conectividad principales, alternas y los ríos.
Por último, se lograron determinar, los usos de suelo alrededor del CoBAS en 2021, los cuales se caracterizan por usos forestales, agrícolas (principalmente parte baja) y pastos abiertos para uso ganadero; fueron identificados mediante Google Earth Engine, según Borràs et al. (2017) -figura1-.
Análisis de datos
Las fotografías fueron archivadas en la computadora y etiquetadas taxonómicamente según especie y número de individuos utilizando DigiKam 7.1.0. Luego, los datos fueron procesados en el lenguaje de programación R (versión 4.3.0; R Development Core Team, 2022). Para esto, se leyó el archivo Excel con la información relevante de los sitios muestreados, que incluía coordenadas, número de cámara, estación, fechas de colocación y retiro, entre otros detalles.
Las celdas de este archivo Excel sirvieron como base para que la librería de CamtrapR creara la estructura de carpetas necesaria para el estudio. Esto incluyó la creación de la carpeta principal del estudio, con subcarpetas correspondientes a cada estación de cámara trampa. Dentro de estas subcarpetas, se crearon otras subcarpetas correspondientes a las especies vistas en cada estación de muestreo (Niedballa et al., 2016).
Para la identificación taxonómica de los mamíferos, se emplearon las guías de Wainright (2007) y Reid & Gómez-Zamora (2022), esta última una fuente de taxonomía más actualizada. Etiquetadas las fotos originales, se arrastraron a las subcarpetas correspondientes a cada especie.
Una vez completados los pasos, se procedió a elaborar la base de datos. Los metadatos de las fotos fueron exportados con ExifTool -versión 12.65- (Harvey, 2022) en formato de archivo Excel. Esto permitió realizar análisis de abundancia relativa (IAR), diversidad, riqueza y patrones de actividad circadiana utilizando el lenguaje de programación R.
Para el análisis de patrones de actividad circadiana, se consideraron datos independientes con eventos separados por intervalos de 60 minutos, con el fin de disminuir el sesgo de registrar el mismo individuo en la cámara en diferentes momentos. En el cálculo del IAR, se utilizaron datos recopilados en períodos de 24 horas (Mandujano-Rodríguez & Pérez-Solano, 2019).
Abundancia relativa
Se calculó mediante el índice de abundancia relativa (IAR), el cual tomó en cuenta los registros fotográficos independientes por especie, los registros debían estar separados por periodos de 24 horas. También, se tomó en cuenta el esfuerzo de muestreo (EM), se utilizó la fórmula IAR= (C/EM) * 100, la cual quiere decir C=número de registros independientes por especie en intervalos de 24 horas, EM= la cantidad de cámaras utilizadas multiplicado por el total de días que estuvieron activas. El 100 indica los días trampa como factor de corrección estándar (Hurtado & Orlando, 2018; Sánchez-Porrás et al., 2021; Marín-Pacheco et al., 2022). Con el fin de determinar la proporción de sitios que ocupan las especies entre los puntos de muestreo se empleó el método Ocupación Naive. Este se calcula como el porcentaje de cámaras donde aparecen las especies (Hedwig et al., 2018). Ambos cálculos se desarrollaron con el paquete estadístico RAI (Mandujano-Rodríguez & Pérez-Solano, 2019).
Diversidad de especies y patrones de actividad
Después de la identificación de las especies, se procedió a calcular los índices de diversidad biológica alfa, los cuales se basan en una comunidad biológica. Entre estos índices se calculó la riqueza específica de especies (N0) tanto en total como en diferentes épocas. El índice indica el número total de especies detectadas mediante los registros fotográficos en el sitio (Mandujano-Rodríguez & Pérez-Solano, 2019).
Asimismo, se determinó la diversidad del sitio utilizando el índice de Shannon-Wiener (H’). El índice busca medir la diversidad específica de especies en relación con la detección de mamíferos obtenida (Nasir et al., 2021).
De manera similar, se definió la dominancia de especies utilizando el índice de Simpson (Si). El índice toma valores cercanos a 1 si hay dominancia de alguna especie, mientras que valores cercanos a 0 para indicar una mayor diversidad en el sitio (Salmerón-López et al., 2017). Estos cálculos se llevaron a cabo utilizando la librería BiodiversityR (Kindt & Coe, 2005).
Además, se estimó la riqueza de especies que podría ser contabilizada en el CoBAS utilizando los estimadores no paramétricos de Chao-2 y Jackknife-2. Los estimadores fueron seleccionados debido a que se adaptan a datos de detección y consideran la posibilidad de especies no detectadas en el estudio (Moreno, 2001; Moreno, 2019).
También, se emplearon los números de Hill por época (seca=diciembre-abril, lluviosa=mayo-noviembre), que representan el número efectivo de especies dentro de una comunidad, mediante la detección de individuos (Jost, 2006; Cambronero et al., 2023). Así, se pudo calcular la riqueza utilizando el primer número (q=0), el número efectivo de especies igualmente comunes mediante el segundo número (q=1) y la dominancia de especies con mayor frecuencia de detección, utilizando el tercer número (q=2). Para estos análisis se empleó la librería de iNEXT (Chao et al., 2014; Hsieh et al., 2016). Junto con lo anterior, se calculó la frecuencia de detección de las especies en ambas épocas -detecciones/días cámara- (Cambronero et al., 2023).
De igual forma, se definió la actividad temporal de los mamíferos con múltiples registros fotográficos. Con el fin de definir si cumplían un patrón de actividad, se utilizaron solo los mamíferos con más de once registros. Para esto, sus horarios fueron agrupados por periodos según la hora en: diurno (07:00-16:59h), nocturno (19:00-04:59h), crepuscular (05:00-06:59h), crepuscular vespertino (17:00-18:59h) y catemeral -especies que no presentan un patrón de actividad específico- (Monroy et al., 2011; Marín-Pacheco et al., 2022).
Los intervalos de actividad fueron descritos mediante densidades de Kernel y representados mediante gráficas según Oliveira-Santos et al. (2013) y Meridth & Rydout (2017). También, se aplicaron pruebas estadísticas circulares de Watson (U) y Rao’s (r), esto para determinar la distribución de los registros de las especies durante lapsos de 24 horas. Así como pruebas de Watson pareadas (U2) de especies silvestres con el C. lupus familiaris, para definir si existía semejanza entre sus horarios (Batschelet, 1981; Zar, 2010).
Por último, se determinó el traslape temporal del C. lupus familiaris con los de las especies silvestres del CoBAS, mediante el coeficiente de superposición “Δ” de Weitzman (1970). El coeficiente toma valores de 0 a 1 y establece un área entre las curvas de densidad de las especies, donde Δ=0 indica que no existe superposición entre estas, y Δ=1 que la superposición entre las especies es total. Para esto, se implementaron simulaciones de 1000 remuestreos entre cada especie utilizando el paquete estadístico de Overlap (Ridout & Linkie, 2009).
Resultados
Se logró un total de 692 registros de mamíferos, con 803 días de cámara trampa. Se representaron 21 especies de mamíferos distribuidos en 14 familias y 8 órdenes. Por tanto, casi la mitad de las especies de mamíferos terrestres medianos y grandes presentes en el país se podrían detectar en el corredor. En tanto a su distribución taxonómica, los órdenes con mayor cantidad de especies fueron Carnívora y Rodentia con nueve y tres especies respectivamente. En caso contrario, Artiodactyla, Cingulata, Lagomorpha, Pilosa y Cebidae sólo sumaron una especie (cuadro 1).
Cuadro 1
Cantidad de registros independientes (RI) de mamíferos según orden y familia taxonómica con su respectivo índice de abundancia (IAR), detectados en el Corredor Biológico Alexander Skutch
|
Orden |
Familia |
Especie |
Nombre común |
RI |
IAR |
Occ |
|
|
Artiodactyla |
Cervidae |
Odocoileus virginanus |
Venado cola blanca |
1 |
0,1 |
0,1 |
|
|
Carnívora |
Canidae |
Canis latrans |
Coyote |
1 |
0,1 |
0,1 |
|
|
Felidae |
Herpailurus yagouaroundi |
Jaguarundi |
1 |
0,1 |
0,1 |
||
|
Leopardus pardalis |
Ocelote |
14 |
1,7 |
0,5 |
|||
|
Puma concolor |
Puma |
1 |
0,3 |
0,1 |
|||
|
Mephitidae |
Conepatus semistriatus |
Zorrillo |
11 |
1,4 |
0,4 |
||
|
Mustelidae |
Eira barbara |
Tolomuco |
32 |
4,0 |
0,8 |
||
|
Galictis vitatta |
Grisón |
2 |
0,3 |
0,2 |
|||
|
Mustela frenata |
Comadreja |
1 |
0,1 |
0,1 |
|||
|
Procyonidae |
Nasua narica |
Pizote |
22 |
2,7 |
0,6 |
||
|
Potos flavus |
Martilla |
3 |
0,4 |
0,2 |
|||
|
Procyon lotor |
Mapache común |
4 |
0,5 |
0,3 |
|||
|
Cingulata |
Dasypodidae |
Dasypus novemcintus |
Armadillo nueve bandas |
73 |
9,1 |
0,9 |
|
|
Didelphimorphia |
Didelphidae |
Philander melanurus |
Zarigüeya de cuatro ojos |
97 |
12 |
0,9 |
|
|
Didelphis marsupialis |
Zorro pelón |
64 |
8,0 |
0,9 |
|||
|
Lagomorpha |
Laporidae |
Sylvilagus dicei |
Conejo de Dice |
3 |
0,4 |
0,3 |
|
|
Pilosa |
Myrmecophagidae |
Tamandua mexicana |
Oso hormiguero |
15 |
1,9 |
0,5 |
|
|
Primate |
Cebidae |
Cebus imitator |
Capuchino |
2 |
0,3 |
0,1 |
|
|
Rodentia |
Cuniculidae |
Cuniculus paca |
Tepezcuintle |
50 |
6,2 |
0,6 |
|
|
Dasyproctidae |
Dasyprocta punctata |
Cherenga o guatusa |
134 |
17 |
0,6 |
||
|
Sciuridae |
Syntheosciurus granatensis |
Ardilla roja |
23 |
3 |
0,6 |
||
|
Total: 8 |
14 |
21 |
555 |
||||
Nota: Elaboración propia con base en los datos obtenidos de la investigación.
En relación con la diversidad del corredor esta fue intermedia (H’= 2,18); así también la dominancia fue alta (Si=0,85), por lo que se observa que hubo dominancia de unas especies sobre otras. Por otra parte, los estimadores Chao-2 y Jackknife-2 indicaron que, con más muestreo en el sitio es posible alcanzar una cantidad de 29 especies de mamíferos en el corredor (figura 2).
Figura 2
Riqueza de especies del Corredor Biológico Alexander Skutch, detectadas y estimadas mediante Jackknife-2 y Chao-2
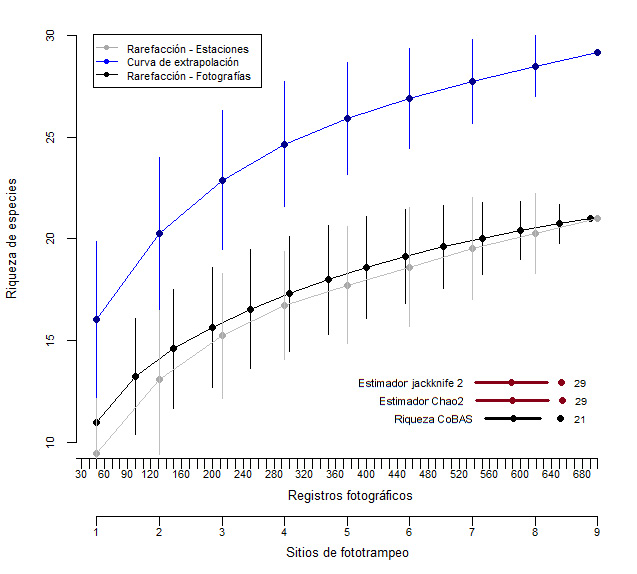
Nota. Elaboración propia con base en los datos obtenidos de la investigación.
De acuerdo con la abundancia relativa (IAR), D. punctata (cherenga), P. melanurus (zarigüeya de cuatro ojos), D. novemcinctus (armadillo de nueve bandas), D. marsupialis (zorro pelón) fueron las más abundantes, además P. melanurus (zarigüeya de cuatro ojos) y D. novemcinctus (armadillo de nueve bandas) obtuvieron valores de ocupación (Occ) del 90%. Asimismo, D. marsupialis (zorro pelón) y E. barbara (tolomuco) alcanzaron valores altos de ocupación (80%). En contraparte, O. virginianus (venado de cola blanca), C. latrans (coyote), M. frenata (comadreja) y H. yagouaroundi (jaguarundi) registraron los menores valores de abundancia y ocupación (cuadro 1). Junto con lo anterior, se destaca la detección de 18 registros de perro doméstico (C. lupus familiaris) contabilizando un IAR de 2,24 en el sitio; se resalta que la mayor cantidad de incidencia se presentó en la parte baja del corredor en QU (13 registros), donde la riqueza de especies fue menor.
Respecto a las estaciones de muestreo, hubo mayor detección de mamíferos en época lluviosa (492 registros) que en la época seca (200 registros). No obstante, la riqueza de especies por estación fue ligeramente mayor en la época seca (18 spp.) que en la lluviosa (17 spp.); para ambos casos, con más esfuerzo de muestreo se podrían llegar a detectar 19 especies. A su vez, el número efectivo de especies comunes fue levemente mayor en la estación seca (q1=9) que en la lluviosa (q1=8). Por otra parte, la dominancia de especies fue igual para ambos casos (q2=6).
La cobertura de la muestra en época seca y lluviosa fue de 98% y 99%, respectivamente, lo cual indica un muestreo representativo para ambos casos. Del mismo modo, se destaca una tendencia asintótica para las tres curvas de acumulación; las pruebas no obtuvieron diferencias significativas (figura 3). La frecuencia general de detección fue de 0,86, con dominancia de las especies D. punctata -cherenga- (0,23), P. melanurus -zarigüeya de cuatro ojos- (0,17), D. novemcinctus -armadillo de nueve bandas- (0,11), C. paca -tepezcuintle- (0,08), D. marsupialis -zorro pelón- y E. barbara -tolomuco- (0,05) sobre el resto; lo cual puede explicar por qué el índice de dominancia presentó un valor cercano a 1. Además, hubo una tendencia a obtener mayores frecuencias de detección en época lluviosa (figura 4).
Figura 3
Curvas de rarefacción y extrapolación para mamíferos detectados en el Corredor Biológico Alexander Skutch, según números de Hill
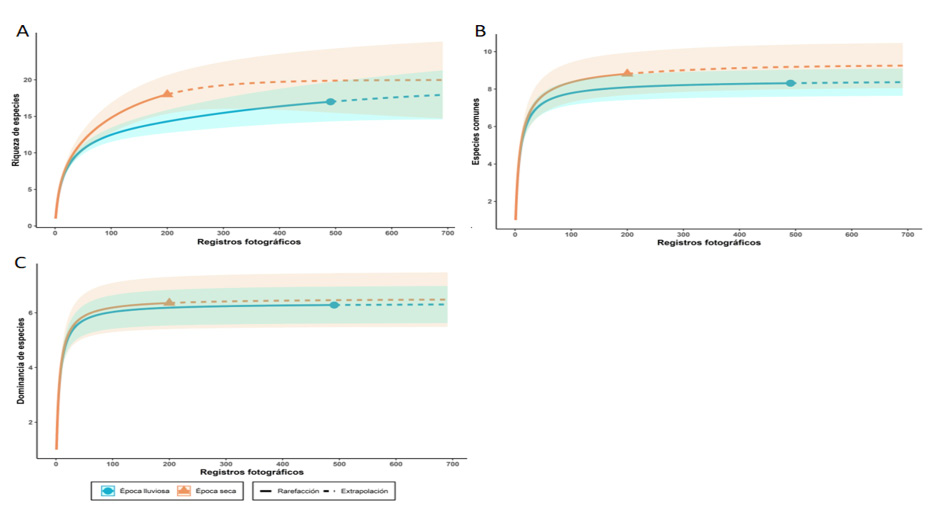
Notas. A) Número efectivo de especies (q=0). B) Número efectivo de especies comunes (q=1). C) Número efectivo de especies dominantes (q=2), comparadas en época seca y lluviosa. Elaboración propia con base en los datos obtenidos de la investigación.
Figura 4
Frecuencia de detección de mamíferos del Corredor Biológico Alexander Skutch durante las épocas seca y lluviosa
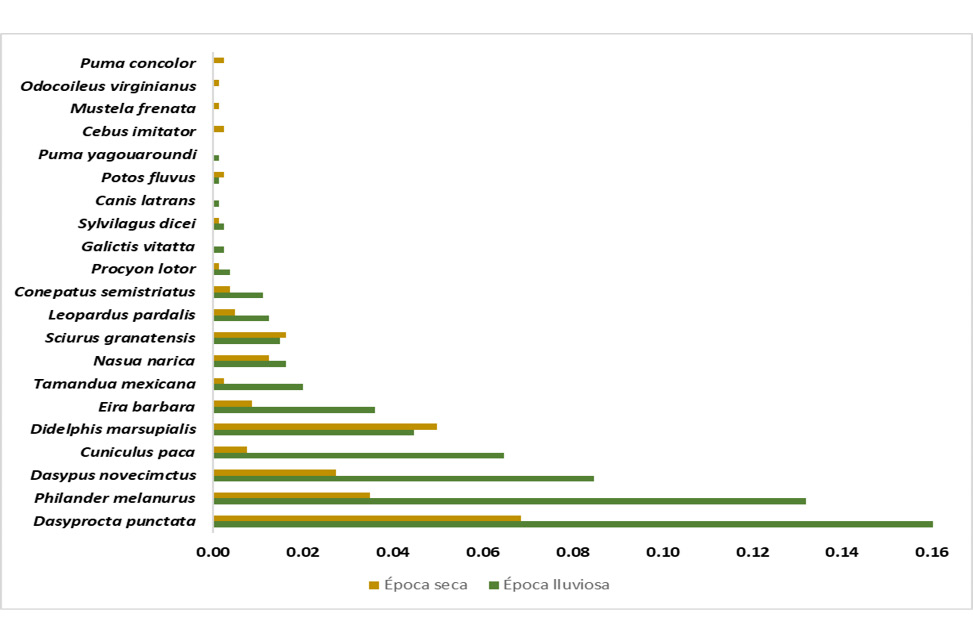
Nota. Elaboración propia con base en los datos obtenidos de la investigación.
En relación con los patrones de actividad, la distribución fue heterogénea para las especies valoradas (p-value < 0,05). En cuanto a sus horarios, se detectaron dos especies mayormente diurnas E. barbara (tolomuco ) y S. granatensis (ardilla roja), en ambos casos también se observaron en horarios crepuscular y crepuscular vespertino. De las especies mayormente nocturnas, se detectaron cuatro especies, D. marsupialis (zorro pelón), D. novemcinctus (armadillo de nueve bandas), C. paca (tepezcuintle), C. semistriatus (zorrilo), L. pardalis (ocelote) y P. melanurus (zarigüeya de cuatro ojos), los cuales también presentaron horarios crepuscular y crepuscular vespertino. En tanto a las catamerales, se contabilizaron tres especies, D. punctata, N. narica (cherenga) y T. mexicana (oso hormiguero) -figura 5-.
Figura 5
Periodo de actividad para los mamíferos detectados en el Corredor Biológico Alexander Skutch
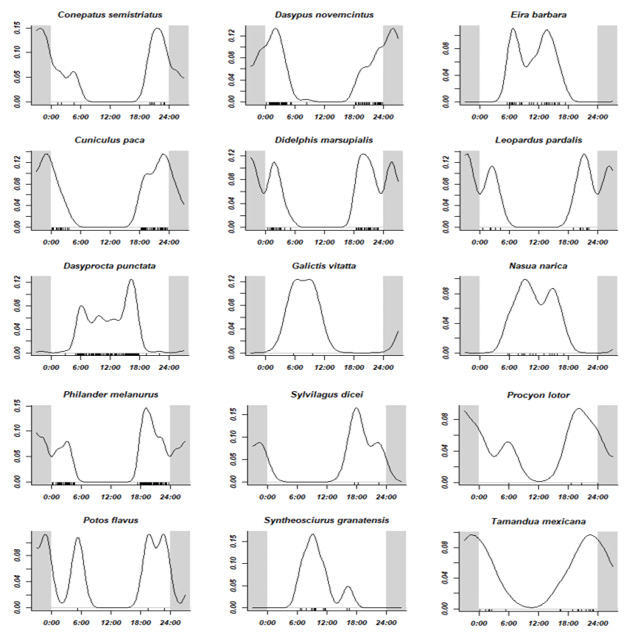
Nota. Elaboración propia con base en los datos obtenidos de la investigación.
Respecto a las pruebas pareadas de Watson (U2), se halló semejanza estadística (p-value >0,05) entre patrones de actividad de tres especies silvestres con C. lupus familiaris (perro doméstico), las cuales fueron D. punctata (cherenga), N. narica (pizote), E. barbara (tolomuco), además se agregó S. granatensis (ardilla roja), ya que esta estuvo muy cercana a obtener significancia estadística entre horarios (0,01 < p-value < 0,05).
En cuanto al coeficiente de superposición “Δ” de Weitzman, D punctata (cherenga), N. narica (pizote) y E. barbara (tolomuco), obtuvieron valores mayores de superposición temporal (“Δ” > 0,5), mientras que para S. granatensis (ardilla roja) este fue intermedio (“Δ” = 0,5). Se debe resaltar el hecho de que a mayor detección de C. lupus familiaris (perro doméstico=13 registros), hubo menores registros de especies silvestres en Quizarrá Ureña (QU=6).
Mediante las cámaras trampa, se lograron detectar 21 especies de mamíferos grandes y medianos, lo que sugiere una alta riqueza de especies. Los resultados se destacan ya que en un estudio previo del CoBAS se logró detectar un total de 15 especies, aunque el esfuerzo de muestreo fue mayor -930 vs. 833 días/trampa- (Vargas-Salazar, 2019). De la misma forma, Marín-Pacheco et al. (2022) y Cartín-Nuñez (2021) detectaron 19 y 20 especies en la Reserva Sierra Zapote (RZS) y en la Reserva Biológica Alberto Manuel Brenes (ReBAMB), respectivamente, con un muestreo de 2135 días/trampa y 1281 días/trampa.
En cuanto al índice de diversidad, fue intermedio en los nueve puntos a lo largo del corredor H’= 2,18; no obstante, parece ser más alto que en otros sitios del país. Por ejemplo, en la ReBAMB se registró un índice de diversidad de H’= 1,65 (Sánchez-Porras et al., 2019), en la RZS H’= 1,96 (Marín-Pacheco et al., 2022), y en la Reserva Natural Cloudbridge H’= 1,91 (Smith, 2021). Es importante destacar que para los dos primeros casos hubo un mayor número de días de actividad en las cámaras trampa (1393 días/trampa y 2135 días/trampa, respectivamente).
Es importante destacar que los índices de la investigación podrían variar, ya que los estimadores estadísticos empleados indican que aún faltan especies por hallar en el sitio (Chao-2 y Jackknife-2= 29 spp). Objetivo que se podría lograr utilizando un mayor número de cámaras trampa o aumentando el tiempo del muestreo, lo cual permitiría un incremento tanto en el registro de especies, principalmente de las especies raras, como en la confiabilidad y representatividad de los resultados del estudio (Tobler et al., 2008; Ahumada et al., 2011; Gonzáles-Tenorio et al., 2021; Smith, 2021).
Por ejemplo, González-Tenorio et al. (2021), lograron detectar 27 especies en distintos sitios del Parque Internacional la Amistad (PILA) con una actividad de cámaras de 15 335 días/trampa. Cabe destacar que, para el caso de los resultados de esta investigación, se podría alcanzar cerca de 50% de especies de mamíferos medianos y grandes del país en el CoBAS (Upham et al., 2022; Ramírez-Fernández et al., 2023).
Es posible que las especies no detectadas en el sitio sean aquellas con hábitos arborícolas, las cuales pueden ser difíciles de capturar debido al diseño de muestreo con cámaras bajas (40-50 cm), que se enfoca principalmente en especies terrestres (Hernández-Hernández et al., 2018; Zamzow et al., 2018). Dentro de estas se pueden encontrar: Marmosa mexicana (zorricí), Leopardus wiedii (caucel), Bradypus variegatus (oso perezoso), Echinosciurus variegatoides (ardilla centroamericana) y Bassarycyon gabbi (olingo), registradas previamente en el Refugio de Aves Los Cusingos (Méndez-Fernández, 2020). Así también, en la finca Las Nubes se han detectado Alouatta palliata (mono aullador) y el Ateles geoffroyi -mono araña- (Acuña-Prado et al., 2017), las cuales son esenciales en la regeneración boscosa ya que dispersan una gran variedad de plantas, su presencia se asocia con una alta diversidad vegetal (Connelly, 2017; Riba-Hernández, 2017; Whitworth et al., 2019; Gómez-Romero 2020; Pruetz & Davis, 2018; Méndez-Carvajal et al., 2020).
Respecto a las especies terrestres, se han detectado en el CoBAS mamíferos de la talla de Tapirus bairdii (danta) y Dycotiles tajacu (pecarí de collar). En el caso de D. tajacu (pecarí de collar), esta es común en las zonas boscosas contiguas a Las Nubes y al Parque Nacional Chirripó (Vargas-Salazar, 2019; Smith, 2021). Por otro lado, T. bairdii (danta) es de las especies con menor frecuencia a lo largo del corredor, según los pobladores de la región (Acuña-Prado et al., 2017). Se señala que ambas especies son importantes, debido a que son presas posibles de la Panthera onca (jaguar), el P. concolor (puma) y el L. pardalis (ocelote); además pueden dispersar semillas pequeñas (3mm), las cuales no sufren daño al pasar por su tracto digestivo (Wainwright, 2007; Yanez-Montalvo et al., 2021).
Asimismo, Vargas-Salazar (2019) obtuvo registros de Cabbassous centralis (armadillo de once bandas); sin embargo, su presencia se ha visto disminuida producto de la caza en el sitio (Acuña-Prado et al., 2017). Esta es una especie poco común, de la cual se sabe muy poco acerca de su distribución (Marín et al., 2021; Marín-Pacheco et al., 2022).
Por otra parte, las especies más abundantes fueron D. punctata (cherenga), P. melanurus (zarigüeya de cuatro ojos), D. novecimctus (armadillo de nueve bandas) y D. marsupialis (zorro pelón). Lo cual coincide con el estudio previo de Vargas-Salazar (2019), donde estas especies alcanzaron mayores registros en dos rutas de conectividad del CoBAS, a excepción de D. novemcinctus. La alta incidencia de las especies se debe a que son de hábitos generalistas, que pueden utilizar tanto hábitats abiertos como boscosos, movilizándose así dentro y fuera del corredor, lo que provoca que su detección sea fácil con la técnica empleada (Marín-Pacheco et al., 2021). De la misma forma, las cámaras colocadas a alturas bajas (40-50 cm) maximizan la detección de especies pequeñas (Lira-Torres & Briones-Salas, 2012).
Aunado a lo anterior, la abundancia de las especies mencionadas es indispensable para el equilibrio y dinámica del ecosistema, ya que mantienen roles ecológicos importantes, como es el caso de la dispersión de semillas, la aireación del suelo y la depredación de pequeños invertebrados (Lacher et al., 2019; Marín-Pacheco et al., 2022). Asimismo, al ser presas de una gran variedad de carnívoros, consecuentemente influyen en su presencia. También son esenciales para especies que requieren de una alta disponibilidad de recursos alimentarios para subsistir, como es el caso de los felinos detectados en el CoBAS (P. concolor, L. pardalis y H. yagouaroundi). Este equilibrio depredador-presa es considerado como buen indicador en la salud de los ecosistemas (Arévalo et al., 2015; Arroyo-Arce et al., 2016; Sánchez-Porras et al., 2019; Marín-Pacheco et al., 2021).
En cuanto a las especies menos abundantes, se destacan O. virginianus (venado de cola blanca) , C. latrans (coyote), P. concolor (puma), H. yagouaroundi (jaguarundi), G. vitatta (grisón) y M. frenata (comadreja). Dato que coincide con Vargas-Salazar (2019), quien incluso no registra para las últimas tres mencionadas. Lo anterior, también refleja lo reportado por los pobladores del sitio, quienes indican que estas especies son poco vistas en el corredor. Por ejemplo, en el caso M. frenata (comadreja), no se mencionan registros. Se incluyen P. lotor (mapache común) y S. dicei (conejo de Dice), como especies con bajas frecuencias de avistamiento (Acuña-Prado et al., 2016). En el caso de H. yagouaroundi, la especie cuenta con pocos registros en el Refugio de Aves los Cusingos (Mendez-Fernández, 2020). Por su parte, P. Flavus (martilla) y C. imitator (mono capuchino) obtuvieron baja incidencia por ser especies arborícolas (Hernández-Hernández et al., 2018; Zamzow et al., 2018; Sánchez-Porras et al., 2019; Marín-Pacheco et al., 2022).
En el caso de los carnívoros, existen especies -como el caso de los felinos- que necesitan de grandes requerimientos de hábitat para desenvolverse de forma apropiada, por lo que su presencia se asocia con un buen estado de conservación (Sánchez-Porras et al., 2019). Tienden a ser muy sensibles a las perturbaciones que suceden en el bosque; asimismo, requieren de amplias áreas de desplazamiento, tienen bajas tasas de reproducción y elevados requerimientos de alimento (Acuña-Prado et al., 2017; Dirzo et al, 2014; Vargas-Salazar, 2019). Además, ejercen un control sobre las poblaciones de otras especies, muchas de las cuales son herbívoras, por lo que influyen positivamente en la diversidad y abundancia de la vegetación. También, ayudan a disminuir la propagación de enfermedades y controlan la incursión de especies invasoras, su ausencia puede influir en cambios estructurales en el medio (Rumiz, 2010; Pardo-Vargas et al., 2016; Hurtado & Orlando, 2018).
En el caso del P. concolor (puma), su detección concuerda con la de Vargas-Salazar (2019) en Las Nubes. El autor informa que esta zona es donde se encuentra la mayor cantidad de parches boscosos donde halla a sus presas, como el D. tajacu (pecarí de collar). Por otra parte, el hecho de que L. pardalis (ocelote) fuera más detectado, pudo deberse a la habilidad de colonizar áreas de bosque denso y ligeramente perturbadas (Cruz-Rodríguez, 2012; Pérez-Irineo & Santos-Moreno, 2014; Vallejo, 201; Mattey-Trigueros et al., 2022). De la misma forma, el clima del Pacifico Sur -donde llueve todo el año- influye en su presencia, debido a que la densidad boscosa se incrementa con las lluvias y decrece con la latitud (Vallejo, 2017; Vargas-Salazar, 2019). Igualmente, su dieta se basa principalmente de D. marsupialis (zorro pelón), P. melanurus (zarigüeya de cuatro ojos) y D. novecinctus (armadillo de nueve bandas), las cuales son abundantes en el corredor (Wainright, 2007; Reid, 2009; Vargas-Salazar, 2019).
Tanto el puma como el manigordo utilizan zonas con bosque como protección para desplazarse a los distintos sitios, lo que los hace indispensables para determinar la conectividad funcional del CoBAS (Vargas-Salazar 2016; Acuña-Prado et al., 2017).
En cuanto al análisis estacional, la riqueza fue similar para ambas temporadas, se detectó solo una especie más durante la época seca, cuando es común detectar un buen número de especies de mamíferos ya que se ven obligadas a aumentar sus áreas de forrajeo. Lo anterior, debido a que algunos recursos como el alimento comienzan a escasear, por lo que sus probabilidades de detección aumentan (Hernández-Hernández et al., 2018). Por otra parte, la frecuencia de detección fue superior en época lluviosa para la mayoría de las especies, ya que se afecta la fenología de las plantas, se provoca así que muchos árboles fructifiquen y crezca la detección de animales herbívoros que, al ser presas, afectan positivamente la incidencia de otros gremios, como es el caso de omnívoros y carnívoros (Ramírez-Carmona, 2022; Salinas & Stalin, 2023; Cambronero et al., 2023).
Respecto a los patrones de actividad de mamíferos, es una característica relacionada con su tamaño corporal. De forma que grandes mamíferos del neotrópico tienden a forrajear durante todo el día con el fin de satisfacer sus requerimientos energéticos (Albanesi et al., 2016; Hernández-Hernández et al., 2018). Asimismo, los medianos que cuentan con pesos menores a 10 kg, tienden a ser nocturnos en respuesta a la evasión de depredadores (Marín-Pacheco et al., 2022). Esto último, coincide con las especies D. marsupialis (cherenga), D. novemcinctus (armadillo de nueve bandas), C. paca (tepezcuintle), C. semistriatus (grisón) y P. melanurus (zarigüeya de cuatro ojos), las cuales fueron principalmente nocturnas-crepusculares. En el caso de L. pardalis (ocelote) existe evidencia de que puede ser catemeral, es decir, sin patrón de horario claro. Sin embargo, en nuestro caso fue nocturna-crepuscular, ya que su patrón de actividad puede verse influenciado por el horario de sus presas, como el caso de C. paca (tepescuintle), la estación (seca o lluviosa), así como un factor evolutivo de actividad por competencia o depredación de otros felinos (Sánchez-Porrás et al., 2019).
Tanto E. barbara (tolomuco) como S. granatensis (ardilla roja) fueron mayormente diurnas-crepusculares, por lo que se sugiere que la temperatura, el recurso alimentario y el nicho tienen más influencia sobre su actividad (Lira-Torres & Briones-Salas, 2012). Aunque N. narica (pizote) y D. punctata (cherenga), catalogadas mayormente como diurnas, en el estudio fueron catemerales. Para el caso de N. narica, se sugiere que los machos solitarios suelen estar activos en horarios nocturnos. La D. punctata puede variar sus patrones como respuesta al riesgo de depredación; así también para ambas especies el alimento, las presas, la época del año, las estaciones lunares, entre otros factores, tienen influencia sobre su patrón (Albanesi et al., 2016; Hernández-Hernández et al., 2018; Marín-Pacheco et al., 2022). Por su parte, T. mexicana (oso hormiguero) fue una especie mayormente nocturna, con pocos registros crepusculares; no obstante se registra como catemeral, pues los individuos de una misma localidad pueden estar activos tanto en horarios diurnos como nocturnos (Reid, 2009; Reid & Gómez-Zamora, 2022; Marín-Pacheco et al., 2022).
Por último, se debe mencionar que la presencia del perro doméstico (C. lupus familiaris) a lo largo del CoBAS, puede influir negativamente en la detección de especies silvestres en su ecosistema natural (Arroyo-Arce et al., 2016), ya que puede actuar como depredador y remplazar a los carnívoros naturales por competencia, además de desplazar a la fauna nativa por medio de sus rastros de olor y ser vector de enfermedades (Calderón, 2008; Manjarrés, 2013; Zapata-Ríos & Branch, 2018, Marín Pacheco et al., 2022). De la misma forma, se ha demostrado que existe una correlación negativa entre la riqueza de especies de mamíferos y la presencia del perro doméstico (Hammoud, 2012; Davis, 2018). Por tanto, se debe prestar atención a las zonas con alta incidencia de perros, principalmente en la parte baja del CoBAS en Quizarrá, ya que puede reflejar un bajo nivel de protección en el sitio y un alto nivel de perturbación humana (Khazan et al., 2016).
Agradecimientos
Se agradece a la Coordinadora del Museo de Docencia-Zoología de la Universidad Nacional, la Dra. Yara Azofeifa Romero, por el conocimiento brindado. Asimismo, al coordinador de proyectos de investigación del Refugio de Aves Los Cusingos y el Corredor Biológico Alexander Skutch, el licenciado José Araya Orozco, por compartir los datos de cámaras trampa y ofrecer información sobre el corredor. Igualmente, al Refugio Los Cusingos por el hospedaje durante la realización del proyecto y a mi familia por su apoyo. Por último, a los miembros del Proyecto de Paisajes Productivos, UNDP Costa Rica y a sus brigadas de monitoreo, ya que estos colectaron los datos y permitieron su uso en la investigación.
Referencias
Acuña-Prado, E., Molina, J. N. y Rodríguez, S. (2017). Análisis de la estructura del paisaje en el Corredor Biológico Alexander Skutch, Pérez Zeledón, en los años 2005, 2012 y 2016. [Tesis de licenciatura]. Universidad Nacional de Costa Rica
Ahumada, J. A., Silva, C. E., Gajapersad, K., Hallam, C., Hurtado, J., Martin, E., McWilliam, A.,Mugerwa, B., O’Brien, T., Rovero, F., Sheil, D., Spironello, W. R., Winarni, N. & Andelman, S. J. (2011). Community structure and diversity of tropical forest mammals: data from a global camera trap network. Philosophical Transactions of the Royal Society B: Biological Sciences, 366(1578), 2703-2711. Doi: https://doi.org/10.1098/rstb.2011.0115
Albanesi, S. A., Jayat, J. P. y Brown, A. D. (2016). Patrones de actividad de mamíferos de medio y gran porte en el pedemonte de yungas del noroeste argentino. Mastozoología Neotropical 23(2), 335-358.
Arauz-Beita, I., Arias-Navarro, A. (2016). Corredores biológicos como potenciadores del desarrollo local: Estudio de caso del corredor biológico Alexander Skutch. Revista Universidad en Diálogo, 6(1), 67-79
Arévalo, J. E., Méndez, Y., Roberts, M., Alvarado, G. & Vargas, S. (2015). Monitoring species of mammals using track collection by rangers in the Tilarán mountain range, Costa Rica Cuadernos de Investigación, UNED, 7(2), 249-257
Arroyo-Arce, S., Thomson, I., Fernández, C. & Salom-Pérez, R. (2017). Relative abundance and activity patterns of terrestrial mammals in Pacuare Nature Reserve, Costa Rica. Cuadernos de Investigación, UNED, 9(1), 15-21.
Batschelet, E. (1981). Circular Statistics in Biology. 1.ª ed. Academic Press, Londres, Reino Unido.
Borràs, J., Delegido, J., Pezzola, A., Pereira-Sandoval, M., Morassi, G. y Camps-Valls, G. (2017). Clasificación de usos del suelo a partir de imágenes Sentinel-2. Revista de Teledetección, (48), 55-66.
Calderón, L. M. (2008). Evaluación de la presencia de perros (Canis familiaris) en humedales de la Sabana de Bogotá (Colombia) y su efecto potencial sobre la fauna silvestre [Tesis de grado]. Universidad de los Andes.
Cambronero, M., Sánchez-Calderón, R., Lobo, R. (2023). Medium and large-sized mammals in a premontane moist forest fragment, Atenas, Costa Rica. Revista de Biología Tropical, 71(1). https://doi.org/10.15517/rev.biol.trop..v71i1.53245
Canet, L. (2005). Ficha Técnica para el Diseño y Oficialización del Corredor Biológico Alexander Skutch. San José, Costa Rica.
Chao, A., Gotelli, N. J., Hsieh, T. C., Sander, E. L., Ma, K. H., Colwell, R. K., & Ellison, A. M. (2014). Rarefaction and extrapolation with Hill numbers: a framework for sampling and estimation in species diversity studies. Ecological Monographs, 84(1), 45-67.
Cartín-Nuñez, M. (2021). Mamíferos terrestres de la Reserva Biológica Alberto Manuel Brenes, Costa Rica, durante el período 2009-2012. InterSedes, 22(45), 20-35. http://dx.doi.org/10.15517/isucr.v22i45.47084
Connelly, E. (2017). A comparison of seedling diversity and abundance in the range of howler monkeys (Alouatta palliata) in Bocas del Toro, Panama. [Tesis de grado]. Universidad Central de Washinton. https://digitalcommons.cwu.edu/etd/688/
Cruz-Rodríguez, C. A. (2012). Ecología espacial del ocelote (Leopardus pardalis) en un paisaje fragmentado del Municipio de Colosó (Sucre), Caribe colombiano. Mastozoología Neotropical, 19(2),367-383.
Davis, L. (2018). Presence and diversity of mammals across microhábitats in San Luis, Monteverde, Costa Rica. Tropical Ecology and Conservation [Montever Institute]. 661 https://digitalcommons.usf.edu/tropical_ecology/661
Dirzo, R., Broadbent, E. B, Almeyda-Zambrano, A. M., Morales-Barquero, L., AlmeydaZambrano, S. L., y Quispe Gil, C. A. (2014). Especies indicadoras del estado de conservación de Osa y Golfito. Stanford Woods Institute for the Environment Stanford University, United States.
Gonzáles-Tenorio, R. G., Eppert, A. A., Mooring, M. S. (2021). Diversidad y patrones de actividad de mamíferos silvestres medianos y grandes en la Cordillera de Talamanca, Costa Rica. Research Journal, 13(2), 3621-3621. https://doi.org/10.22458/urj.v13i2.3621
Hammoud, K. (2012). The effect of free-roaming Canis lupus familiaris on wild mammal species richness and abundance in Monteverde, Costa Rica. EAP Tropical Biology and Conservation.
Harvey, P. (2022) Exiftool by Phil Harvey. Available online: https://Exiftool.Org/
Hedwig, D., Kienast, I., Bonnet, M., Curran, B. K., Courage, A., Boesch, C. & King, T. (2018). A camera trap assessment of the forest mammal community within the transitional savannah-forest mosaic of the Batéké Plateau National Park, Gabon. African Journal of Ecology. doi:10.1111/aje.12497
Hernández-Hernández, J. C., Chávez, C., List, R. (2018). Diversidad y patrones de actividad de mamíferos medianos y grandes en la Reserva de la Biosfera La Encrucijada, Chiapas, México. Revista de Biología Tropical, 66(2), 634-646. http://dx.doi.org/10.15517/rbt.v66i2.33395
Holdridge, L. R. (1987). Ecología Basada en Zonas de Vida. Instituto Interamericano de Cooperación para la Agricultura, San José, Costa Rica.
Hsieh, T. C., Ma, K. H., Chao, A. (2016). iNEXT: An R package for rarefaction and extrapolation of species diversity (Hill numbers). Methods in Ecology and Evolution, 7(12), 1451–1456. https://doi. org/10.1111/2041-210X.12613
Hurtado, C. & Orlando, L. (2018). Diversidad de masto fauna en bosque seco tumbesino; el caso de estudio de la Reserva Ecológica Arenillas REA. [Tesis de grado]. Universidad Católica de Loja. http://dspace.utpl.edu.ec/handle/20.500.11962/21797
Hurtado, J., Soto C. (2017). Manual para el Monitoreo Participativo de Vertebrados Terrestres a través de Cámaras Trampa en Costa Rica. Proyecto MAPCOBIO-SINAC-JICA. Santo Domingo de Heredia, Costa Rica
Jost, L. (2006). Entropy and Diversity. Oikos, 113(2), 363-375. https://doi.org/10.1111/j.2006.0030-1299.14714.x
Khazan, E. S., Arias, M., Fernández, L. M. (2016). Large mammal community composition and density under a disturbance gradient in Northeast Costa Rica. Revista de Biología Tropical, 64(4), 1553-1564.
Kindt, R., Coe, R. (2005). Tree diversity analysis: A manual and software for common statistical methods for ecological and biodiversity studies. World Agroforestry Centre (ICRAF), Nairobi, Kenya, 196. http://wwww.orldagroforestry.org/treesandmarkets/tree_diversity_analysis.asp
Lacher, T. E., Davidson, A. D., Fleming, T. H., Gómez-Ruiz, E. P., McCracken, G. F., Owen-Smith, N., & Vander Wall, S. B. (2019). The functional roles of mammals in ecosystems. Journal of Mammalogy, 100(3), 942-964. https://doi.org/10.1093/jmammal/gyy183
Lira-Torres, I., Briones-Salas, M. (2012). Abundancia relativa y patrones de actividad de los mamíferos de los Chimalapas, Oaxaca, México. Acta zoológica mexicana, 28(3), 566-585.
Mandujano, S., Pérez-Solano, L.A. (2019). Fototrampeo en R: Organización y Análisis de Datos. Volumen I. Instituto de Ecología AC Xalapa, Ver., 248 pp.[ISBN: 978-607- 7579-90-8]. Revista Mexicana de Mastozoología (Nueva Época), 10(1), 64-67.
Manjarrés Rodríguez, T. S. (2013). Distribución y uso de hábitat del perro (Canis familiaris) en la cuenca alta del río Otún (Risaralda-Colombia). [Tesis de grado]. Universidad Javeriana.
Marín-Pacheco, P. M., Cambronero, A. V., López, L. I., y Mora, J. M. (2022). Riqueza, abundancia relativa y actividad de los mamíferos de una reserva en restauración en Costa Rica. Research Journal, 14(2). https://doi.org/10.22458/urj.v14i2.4210
Marín-Pacheco, P., Mora J.M., López, L.I., Pérez, J.A., Rodríguez, M.A., Cambronero, A.V. y Arias, I. (2021) New records on the distribution and habitat of the northern naked-tailed armadillo, Cabassous centralis (Mammalia, Cingulata, Chlamyphoridae) in Costa Rica. Neotropical Biology and Conservation, 16(3), 451–460. https://doi.org/10.3897/ neotropical.16.e67969
Méndez-Carvajal, P. G., de Huertas, I. G., Pineda, K. M. G., Moreno, R. S., Peñafiel, M. A., Girón-Rengifo, A. S. y González-Hernández, P. A. (2020). Potencial regenerativo de bosques de galería en base a diversidad y abundancia de mamíferos en la Reserva Forestal El Montuoso y afluentes del río La Villa, Herrera, Panamá. Mesoamericana, 24(1), 58-76. https://revistasvip.up.ac.pa/index.php/mesoamericana/article/view/625
Méndez-Fernández, C.A. (2020). Plan de Manejo Refugio De Aves Dr. Alexander Skutch. [Tesis doctoral]. Universidad para la Cooperación Internacional
Meredith, M., Ridout, M. (2017). Overlap: Estimates of coefficient of overlapping for animal activity patterns. R package version 0.3.0
Monroy, O., Zarco-González, M. M., Rodríguez-Soto, C., Soria-Díaz, L., & Urios, V. (2011). Fototrampeo de mamíferos en la Sierra Nanchititla, México: abundancia relativa y patrón de actividad. Revista de Biología Tropical, 59(1), 373-383.
Moreno, C. E. (2001). Métodos para medir la biodiversidad. M&T–Manuales y Tesis SEA, vol. 1. Zaragoza, 84 pp.
Moreno, C. E. (Ed.). (2019). La biodiversidad en un mundo cambiante: fundamentos teóricos y metodológicos para su estudio. Universidad Autónoma del Estado de Hidalgo. 380 pp. https://altexto.mx/biodiversidad-en-un-mundo-cambiante-kbejw.html
Nasir, N. M., Nasir, D. M., & Ramli, R. (2021). Diversity of bats in three selected forest types in Peninsular Malaysia. Turkish Journal of Zoology, 45(2), 142-155.
http://doi.org/10.3906/zoo - 1912 - 50
Niedballa, J., Sollmann, R., Courtiol, A., Wilting, A. (2016). CamtrapR: an R package for efficient camera trap data management. Methods in Ecology and Evolution, 7(12).
https://doi.org/10.1111/2041-210X.12600
Oliveira-Santos, L., Zucco, C., Agostinelli, C. (2013). Using conditional circular kernel density
functions to test hypotheses on animal circadian activity. Animal Behaviour, 85 (1), 269-280.
Pardo-Vargas, L. E., Cove, M. V., Spinola, R. M., de la Cruz, J. C., & Saenz, J. C. (2016). Assessing species traits and landscape relationships of the mammalian carnivore community in a neotropical biological corridor. Biodiversity and Conservation, 25(4). doi:10.1007/s10531-016-1089-7
Pérez-Irineo, G., Santos-Moreno, A. (2014). Density, distribution, and activity of the ocelot Leopardus pardalis (Carnivora: Felidae) in Southeast Mexican rainforests. Revista de Biología Tropical, 62(4), 1421-1432. https://doi.org/10.15517/rbt.v62i4.12941
Pruetz, D., & Davis, D. (2018). Seed Dispersal of A Pioneer Tree Species, Castilla Elastica, by Mantled Howling Monkeys (Alouatta Palliata) in Regenerating Forest in Costa Rica. Neotropical Primates, 24(1), 21.
Ramírez-Carmona, G. (2022). Evaluación de la composición del paisaje y su asociación con la comunidad de mamíferos medianos y grandes en una selva seca de Puebla. [Tesis de maestría]. Benemérita Universidad Autónoma de Puebla. https://hdl.handle.net/20.500.12371/17463
Ramírez-Fernández, J. D., Sánchez, R. , May-Collado, L. J., González-Maya J. F. & Rodríguez- Herrera, B. (2023). Revised checklist and conservation status of the mammals of Costa Rica. Therya,14(2), 233-244. 10.12933/therya-23-214
R Development Core Team (2022). The R project for statistical computing. (https:/www.r-project.org/ about.html) Reid, F.A (2009). A Field Guide to the Mammals of Central America and Southeast Mexico. 2nd Edition. Oxford University Press, New York. 346 pp.
Reid, F. A., Gómez-Zamora, G. (2022). Pocket Guide to the Mammals of Costa Rica. Comstock Publishing Associates.
Riba-Hernández, J. P. (2017). Conservación, estructura poblacional y ecología reproductiva de la fruta dorada (Virola surinamensis: Myristicaceae) un árbol dioico maderable en la Península de Osa, Costa Rica. [Tesis doctoral]. Universidad de Costa Rica http://hdl.handle.net/123456789/227
Ridout, M. S., Linkie, M. (2009). Estimating overlap of daily activity patterns from camera trap data. Journal of Agricultural, Biological, and Environmental Statistics, 14(3), 322–337. doi:10.1198/jabes.2009.08038
Rumiz, D. I. (2010). Roles ecológicos de los mamíferos medianos y grandes. En R. B. Wallace, H. Gómez, Z. R. Porcel y D. I. Rumiz (Eds.) Distribución, ecología y conservación de los mamíferos medianos y grandes de Bolivia, 2, 53-73.
Salinas, R., Stalin, O. (2023). Determinación de la abundancia relativa y patrones de actividad de mamíferos depredador y presa, mediante fototrampeo en el bosque de la comuna de Olón [Tesis de grado]. Universidad Estatal Península de Santa Elena.
Salmerón-López, A., Geada López, G. y Fagilde Espinoza, M. D. C. (2017). Propuesta de un índice de diversidad funcional: Aplicación a un bosque semideciduo micrófilo de Cuba Oriental. Bosque (Valdivia), 38(3), 457-466. http://dx.doi.org/10.4067/S0717-92002017000300003
Sánchez-Porras, R. S., Cambronero, L. B., Esquivel, K. C. y Vásquez, Y. M. (2019). Diversidad y patrones de actividad de mamíferos medianos y grandes, en la Reserva Biológica Alberto Manuel Brenes, Alajuela, Costa Rica. Pensamiento Actual, 19(33), 175-189.
Sánchez-Porras. S., Esquivel, K. C., y Vásquez, Y. M. (2021). Abundancia relativa, diversidad y patrones de actividad de mamíferos terrestres medianos y grandes, sendero Pájaro Sombrilla, Reserva Biológica Alberto Manuel Brenes, Alajuela, Costa Rica. Pensamiento Actual, 21(36). https://doi.org/10.15517/pa.v21i36.47014
Sistema Nacional de Áreas de Conservación. (2018). Diagnóstico del Corredor Biológico Alexander Skutch. Proyecto Implementación del Programa Nacional de Corredores Biológicos en el marco de la Estrategia Nacional de Biodiversidad de Costa Rica SINAC/GIZ. San José, 91p.
Sistema Nacional de Áreas de Conservación. (2018). Plan de Gestión del Corredor Biológico Alexander Skutch. Proyecto Implementación del Programa Nacional de Corredores Biológicos en el marco de la Estrategia Nacional de Biodiversidad de Costa Rica SINAC/GIZ. San José, 99p.
Smith, G. (2021). Estimating the diversity of bird and mammal communities using camera traps in a c loud forest environment, Costa Rica. [Graduate work]. University of Plymouth cloudbridge.org
Tobler, M. W., Carrillo-Percastegui, S. E., Pitman, R. L., Mares, R., & Powell, G. (2008). An evaluation of camera traps for inventorying large-and medium-sized terrestrial rainforest mammals.
Animal Conservation, 11(3), 169-178. https://doi.org/10.1111/j.1469-1795.2008.00169.x
Upham, P., Burgin, C., Widness, J., Liphardt, S., Parker, C., Becker, M., Rochon, I., & Huckaby, D.
(2022). Mammal Diversity Database (1.10). Zenodo. https://zoi.org/10.5281/zenodo.739452
Vallejo, A. F (2017). Leopardus pardalis. En: Brito, J., Camacho, M. A., Romero, V., Vallejo, A. F. (eds.). Mamíferos del Ecuador (Versión 2018.0). Museo de Zoología, Pontificia Universidad Católica del Ecuador.
Vargas-Salazar, E. (2019). Grado de conectividad y diversidad de especies de dos posibles rutas de enlace entre áreas prioritarias de conservación dentro del Corredor Biológico Alexander Skutch. [Tesis de grado]. Universidad Latina de Costa Rica
Wainwright, M. (2007). The mammals of Costa Rica: A natural history and field guide. Comstock
Publishing Associates.
Whitworth, A., Whittaker, L., Pillco Huarcaya, R., Flatt, E., Morales, M. L., Connor, D., & Beirne, C. (2019). Spider monkeys rule the roost: ateline sleeping sites influence rainforest heterogeneity. Animals, 9(12), 1052. https://doi.org/10.3390/ani912105
Yanez-Montalvo, A., Gaona, O., Águila, B., Arias-Domínguez, N., Falcón, L. I., & Pérez-Flores, J. (2021). Tapirus bairdii-Associated Fecal Microbiome from a Critical Conservation Area: Calakmul, México. Current Microbiology, 78(7), 2648–2659. doi:10.1007/s00284-021-02531-8
Zamzow, B. K., Nieman, S. J., Davis, C. N., Garro Cruz, M., Monroe, A., Stallcup, L., & Moran, M. D. (2018). Status of large terrestrial vertebrates in the Monteverde-Arenal bioregion, northwestern Costa Rica. Tropical Conservation Science, 11, 1940082918809617. https://doi.org/10.1177/194008291880961
Zapata-Ríos, G., Branch, L. C. (2018). Mammalian carnivore occupancy is inversely related to presence of domestic dogs in the high Andes of Ecuador. PLoS ONE, 13(2), 1-17.
https://doi.org/10.1371/journal.pone.0192346
Zar, J. H. (2010). Biostatistical analysis. Upper Saddle River, NJ: Prentice Hall.
Biocenosis • Volumen 35/ Número 1/ 19-37 / Enero-Junio, 2024

1 Universidad Nacional, Unidad de Ciencias Biológicas, Sede Central, Heredia, Costa Rica. jesus.herrera.mora@est.una.ac.cr
ID: https://orcid.org/0009-0008-2668-1322