La diversidad taxonómica y la red de interacción especie-hábitat son elementos clave en un enfoque de paisaje para la conservación de artrópodos en un bosque seco de Costa Rica
Taxonomic diversity and the species-habitat interaction network are key elements in a landscape approach for the conservation of arthropods in the dry forests of Costa Rica
Leonardo Vilas-Bôas M.P. de Cerqueira1
DOI: 10.22458/rb.v34i1.4824
Recibido – Received: 02 / 03/ 2023 / Corregido – Revised: 22/ 03/ 2023 / Aceptado – Accepted: 19/ 05/ 2023
Al tomar decisiones sobre cuáles áreas deben ser preservadas e incluidas en planes de gestión de parques, bosques y otras áreas importantes para la conservación de la biodiversidad, es crucial tener en cuenta la diversidad de hábitats y especies presentes. Sin embargo, es común no considerar las interacciones entre los diferentes elementos del ambiente ni reconocer la importancia de entender un sitio específico como un ecosistema integrado. Para evaluar la estructura de las comunidades de artrópodos, se empleó un diseño de paisaje y dos enfoques: el enfoque de diversidad taxonómica y el enfoque de análisis de redes de interacción. Se investigaron los efectos de la composición del paisaje en la diversidad verdadera, la diversidad beta y la interacción entre paisajes y especies. Se llevó a cabo el estudio en Palo Verde, uno de los últimos remanentes de bosque seco de Costa Rica. Se muestrearon 399 individuos de 34 morfotipos de artrópodos. A escala de paisaje, los resultados destacan la relación positiva entre la vegetación densa y la diferencia entre el porcentaje de vegetación moderada entre paisajes con la diversidad de especies dominantes y la diversidad beta y el recambio de especies de artrópodos, respectivamente. Los resultados indican que aquellos que cuentan con una mayor diferencia de vegetación moderada pueden ser más heterogéneos y, por tanto, más efectivos en la conservación de la biodiversidad de artrópodos en los paisajes de Palo Verde; además, una mayor proporción de vegetación densa contribuye a mantener comunidades diversas, estables en términos de dominancia de especies y mayor conectividad con otros paisajes.
Palabras clave: diversidad beta; conservación de la biodiversidad; heterogeneidad de hábitat; filtro ambiental; Palo Verde.
When making decisions about which areas should be preserved and included in the management plans of parks, forests, and other important areas for biodiversity conservation, it is crucial to take into account the diversity of current habitats and species. However, it is common not to consider the interactions between the different elements of the environment, nor to recognize the importance of understanding a specific site as an integrated ecosystem. To evaluate the structure of arthropod communities, a landscape design and two approaches were used: the taxonomic diversity approach and the interaction network analysis approach. The effects of landscape composition on true diversity, beta diversity, and the interaction between landscapes and species were investigated. The study was conducted in Palo Verde, one of the last remnants of dry forest in Costa Rica, where 399 individuals of 34 arthropod morphotypes were sampled. At the landscape scale, the results highlight the positive relationship between dense vegetation and the difference between the percentage of moderate vegetation in landscapes with, respectively, dominant species diversity and beta diversity and the turnover of arthropod species. The results indicate that landscapes that have a higher difference in moderate vegetation can be more heterogeneous and, therefore, more effective in conserving arthropod biodiversity in Palo Verde landscapes. Additionally, a higher proportion of dense vegetation contributes to maintaining diverse communities, stable in terms of species dominance and greater connectivity with other landscapes.
Keywords: beta diversity; biodiversity conservation; habitat heterogeneity; environmental filter; Palo Verde.
Introducción
La diversidad de hábitats y especies ha sido una consideración primordial al decidir cuáles sitios deben conservarse (Goeden, 1979; Margules & Usher, 1981), además de incluirse como información clave para los tomadores de decisiones en los planes de manejo de parques, bosques y áreas estratégicas para la conservación de la biodiversidad (Thomas et al., 1979). Comúnmente, no se consideran las interacciones entre los diferentes elementos de un paisaje y la consideración del paisaje como ecosistemas separados (Forman,1981).
Con los desarrollos recientes en la ecología del paisaje, el concepto de diversidad se ha vuelto más complejo. ¿A qué escala debe medirse y gestionarse la diversidad? En este sentido, es importante reconocer tres escalas de diversidad. La diversidad alfa es el número (o riqueza) de especies dentro de un solo hábitat o comunidad (Whittaker, 1972). En la mayoría de los casos, un solo hábitat se considera una pequeña área de estructura de vegetación uniforme.
Por otra parte, la diversidad beta refleja el cambio en la composición de especies a lo largo de un gradiente ambiental o serie de hábitats. La evidencia indica que la diversidad beta depende de los patrones locales y a escala del paisaje -por ejemplo, la estructura de la vegetación y la estructura del paisaje- directamente relacionados con factores deterministas -por ejemplo, filtro ambiental e interacciones entre especies- y estocásticos -por ejemplo, deriva ecológica y extinciones aleatorias- (Chase & Myers, 2011). Finalmente, la diversidad gamma está dada por el total de especies de una gran región geográfica o por la comunidad total (Whittaker, 1972).
Además de las métricas de diversidad comúnmente utilizadas, los efectos del hábitat en toda la escala del paisaje también se pueden examinar utilizando redes de interacción especie-hábitat, que comprenden una herramienta de red bipartita recientemente adaptada para la ecología del paisaje por Marini et al. (2019). Una red especie-hábitat representa un paisaje en el que cada especie es un nodo que está vinculado a otro conjunto de nodos correspondientes a parches de hábitat donde se encuentra esa especie (Astudillo et al., 2020). Los enlaces de interacción dentro de la red se establecen por la ocurrencia de una especie dada en un parche especifico.
Los bosques tropicales estacionalmente secos presentan una distribución global y naturalmente comprenden una variedad de tipos de ecosistemas: desde bosques completamente abiertos hasta bosques densos, también son ecosistemas que se caracterizan por tener una temporada seca prolongada y una estación lluviosa relativamente corta (Quintero & Azofeifa, 2010). Por tanto, se determinan como paisajes heterogéneos, ya que cada parte puede presentar diferentes recursos ambientales característicos y ser potencialmente ocupados por diferentes especies, aumentando así la complejidad en los niveles de divergencia comunitaria entre parches y paisajes (Laurance et al., 2007; Tscharntke et al., 2012).
La relación entre los artrópodos y los bosques secos es compleja y está influenciada por diversos factores, incluyendo la composición del paisaje y la heterogeneidad de los hábitats. Siendo así, el objetivo del trabajo fue evaluar la estructura de las comunidades de artrópodos en Palo Verde, un remanente de bosque seco en Costa Rica, utilizando un diseño de paisaje y dos enfoques: el enfoque de diversidad taxonómica y el análisis de redes de interacción. El estudio tuvo como objetivo investigar los efectos de la composición del paisaje sobre la diversidad verdadera, la diversidad beta y la interacción entre los paisajes y las especies. El estudio enfatiza la importancia de considerar las interacciones entre diferentes elementos del ambiente y reconocer la importancia de comprender un sitio específico como un ecosistema integrado al tomar decisiones sobre cuáles áreas deben ser preservadas.
Materiales y métodos
El estudio fue realizado en febrero de 2023 en el Parque Nacional Palo Verde (10º20’35 “N, 85º20’25” W), ubicado en la provincia de Guanacaste, al noroeste de Costa Rica (Trama et al., 2009). El parque comprende una de las últimas reliquias de bosque tropical seco en Costa Rica (Hartshorn, 1983). Tiene una precipitación anual promedio de 1380 mm. Con dos estaciones climáticas bien definidas, comprendidas entre mayo y noviembre -temporada de lluvias- y diciembre y abril -temporada seca- (Jiménez-Rodríguez et al., 2019). La temperatura media anual es de 27,5ºC, variando anualmente entre 26,3ºC y 29,3ºC (Jiménez-Rodríguez et al., 2019). El suelo del área de estudio se clasifica como Vertisol (Taxonomía de Suelos del USDA; Ortiz-Malavassi, 2014).
Se definieron ocho parcelas circulares (buffers) de muestreo con un diámetro de 200 m, cada una contenía dos trampas de caída, las cuales se colocaron en el centro de cada área de muestreo. Además, se fijó una distancia mínima de 200 m entre el centro de cada buffer para minimizar la interferencia espacial entre las trampas y garantizar la independencia a escala de paisaje (es decir, evitar la superposición espacial; Silva y Hernández, 2015). Cada trampa consistía en un recipiente de 250 ml, enterrado a nivel del suelo y lleno con una solución compuesta de agua y jabón. Las trampas fueron cebo con aproximadamente 25 g de heces humanas frescas. Cada trampa estuvo activa durante 24 horas, y después de recolectar los artrópodos se almacenaron en alcohol a 80% para la posterior morfotipificación.
Para estimar la vegetación presente en los buffers de los paisajes en el área de estudio, se clasificó cada paisaje utilizando el índice de vegetación de diferencia normalizada (NDVI) con datos del satélite Landsat 7 (imágenes mapeadas en febrero de 2023). Los valores de NDVI varían de -1 a 1, permitiendo así la clasificación de la vegetación, donde cuanto más cerca de 1, más densa es la vegetación. Para los cálculos del NDVI ver Myneni (1995). Para el estudio se especificó para cada uno de los ocho buffers (figura 1) un porcentaje de vegetación densa (NDVI>0.6), moderada (NDVI entre 0.6 y 0.4) y escasa (NDVI <0.4).
Figura 1
Representación visual de un buffer categorizado basado en el Índice de vegetación de diferencia normalizada (NDVI)
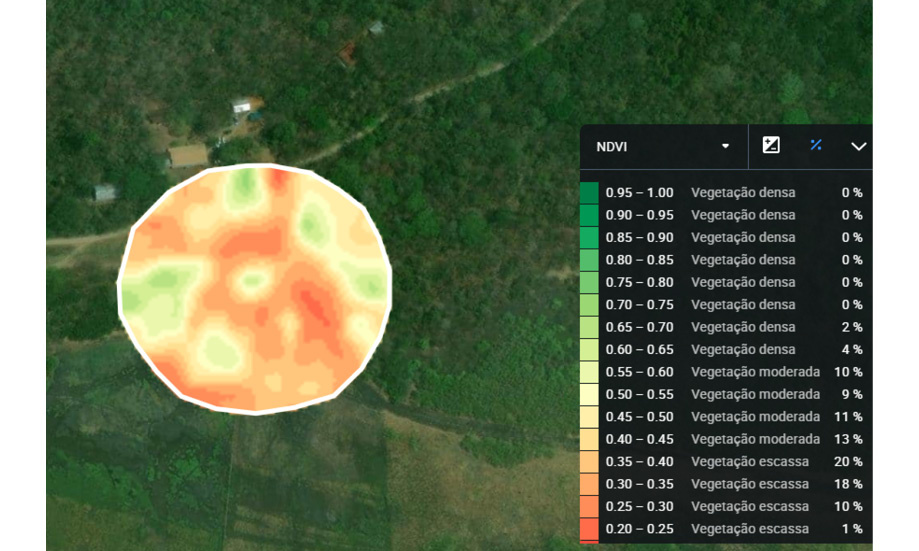
Nota. Elaboración del autor con base en la investigación.
Las métricas de diversidad fueron estimadas utilizando números de Hill (Jost, 2006) de orden 0 (0D, riqueza de especies), 1 (1D, exponencial de Shannon) y 2 (2D, inverso de Simpson). 0D no es sensible a la abundancia de especies y, por tanto, proporciona un peso igual para especies raras y abundantes (Jost, 2006). 1D pondera cada especie según su abundancia en la comunidad; así, se puede interpretar como el número de especies “comunes” o “típicas” en la comunidad (Jost, 2006). Finalmente, 2D se puede interpretar como el número de especies “muy abundantes” o “dominantes” en la comunidad (Jost, 2006). Las fórmulas detalladas para los números de Hill se pueden encontrar en Jost (2006).
Además, para el índice de diversidad beta, se empleó una matriz de distancia euclidiana por la función vegdist del paquete vegan (Baselga et al., 2022; Oksanen et al., 2022) contra matrices de diversidad beta por el índice de disimilitud estandarizado de Sorensen (que considera datos sobre la presencia y ausencia de especies) por la función betapair del paquete betapart (Baselga et al., 2022). Además, se dividió la diversidad beta en dos componentes: el componente resultante del recambio de especies y el componente resultante de la anidación de especies (Baselga, 2010). Luego, se trazaron modelos lineales (lm) para evaluar cómo las variables de paisaje afectan la diversidad beta total y sus dos componentes.
Considerando todos los taxones combinados, se compiló una matriz aij en la que i corresponde a un paisaje, j corresponde a un morfotipo y el elemento ij se llena con la presencia o ausencia de la especie j en el paisaje i. Primero se obtuvo una representación gráfica de las redes especie-hábitat considerando la abundancia de las especies, usando el paquete igraph (Csardi & Nepusz, 2006). Luego, se caracterizó la estructura de la red estimando la conectividad, como la proporción realizada de interacciones especie-hábitat dadas todas las interacciones posibles (Dunne et al., 2002) obtenidas usando la función networklevel del paquete visNetwork.
Para evitar la colinearidad entre las variables predictoras (porcentaje de vegetación densa, moderada y escasa), se estimaron sus factores de inflación de varianza (VIF) usando el paquete car. Los valores de VIF deben ser < 2,5 para evitar el efecto de colinearidad (Zuur et al., 2009). De esta manera, todas las variables predictoras se consideraron para evaluar los efectos de los descriptores de paisaje sobre las variables de respuesta de los artrópodos (0D, 1D, 2D, diversidad beta total -Sorensen- y sus dos componentes: anidamiento y recambio).
Se evaluó la normalidad de los residuos, homocedasticidad y presencia de outliers mediante el paquete DHARMa (Hartig, 2022). Se llevaron a cabo todos los análisis con el software R versión 4.2.2 (R Core Team, 2022).
Resultados
En total, se encontraron 399 individuos de 34 morfotipos de artrópodos (tabla 1), que variaron de 1 a 184 individuos entre los ocho paisajes. La morfoespecie más abundante fue la Coleoptera_Sp5 con una abundancia total de 184 individuos (variando de 0 a 125, x ± SD: 23 ± 39.5 individuos entre paisajes).
Tabla 1
Abundancia de las morfoespecies de artrópodos en los ocho paisajes (1-8) muestreadas
|
Especie/Paisaje |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
Blattodea_Sp1 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Scarabaeinae_Sp1 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Scarabaeinae_Sp2 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Coleoptera_Sp1 |
7 |
3 |
0 |
1 |
1 |
0 |
0 |
0 |
|
Formicidae_Sp1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
|
Hymenoptera_Sp1 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Orthoptera_Sp2 |
1 |
0 |
0 |
0 |
2 |
0 |
1 |
0 |
|
Coleoptera_Sp2 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Scarabaeinae_Sp3 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Coleoptera_Sp3 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Blattodea_Sp2 |
1 |
8 |
0 |
0 |
0 |
1 |
91 |
4 |
|
Coleoptera_Sp4 |
3 |
0 |
0 |
1 |
1 |
0 |
0 |
0 |
|
0 |
3 |
9 |
125 |
17 |
0 |
3 |
27 |
|
|
Arthropoda_Sp1 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Arthropoda_Sp2 |
0 |
16 |
0 |
2 |
0 |
0 |
0 |
0 |
|
Blattodea_Sp3 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Arthropoda_Sp3 |
0 |
0 |
2 |
3 |
2 |
0 |
0 |
0 |
|
Araneae_Sp1 |
0 |
0 |
0 |
2 |
0 |
0 |
0 |
0 |
|
Arthropoda_Sp4 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
|
Coleoptera_Sp6 |
0 |
0 |
0 |
0 |
8 |
0 |
0 |
6 |
|
Diptera_Sp1 |
0 |
0 |
0 |
0 |
3 |
0 |
0 |
0 |
|
Blattodea_Sp4 |
0 |
0 |
0 |
0 |
1 |
0 |
2 |
1 |
|
Curculionidae_Sp1 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
|
Orthoptera_Sp3 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
|
Araneae_Sp2 |
0 |
0 |
0 |
0 |
1 |
0 |
1 |
1 |
|
Coleoptera_Sp7 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
|
Coleoptera_Sp8 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
|
Arthropoda_Sp5 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
|
Orthoptera_Sp4 |
0 |
0 |
0 |
0 |
0 |
0 |
7 |
0 |
|
Arthropoda_Sp6 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
|
Araneae_Sp3 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
1 |
|
Scarabaeinae_Sp4 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
|
Scarabaeidae_Sp1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
Nota. Elaboración del autor con base en la investigación.
De acuerdo con la clasificación, el paisaje “6” fue el que presentó la mayor cantidad de vegetación densa (93%), el “4” presentó la mayor proporción de vegetación escasa (49%) y el paisaje “8” presentó la mayor proporción de vegetación moderada (68%), ver tabla 2. En relación con la diversidad verdadera (Número de Hills), los paisajes más diversos fueron el “1” y el “5”, presentando en ambos un valor de 13 especies (para orden q = 0), para q =1, 9.77 en el paisaje “1” y 6.8 en el paisaje “5” y para q = 2, 7.05 en el paisaje “1” y 4.23 para el paisaje “5”. Los menos diversos para q = 0 fueron los paisajes “3” y “6”, para q = 1 y q = 2 fueron los paisajes “4” y “7” (ver tabla 2 y figura 2).
Tabla 2
Porcentaje de cobertura de vegetación densa, moderada y escasa, y los valores de diversidad obtenidos del Número de Hills (D) de orden 0, 1 y 2, en cada paisaje muestreado
|
Paisaje (Fig. 2) |
% Vegetación densa |
% Vegetación moderada |
% Vegetación escasa |
D0 |
D1 |
D2 |
|
1 |
92 |
8 |
0 |
13 |
9.77 |
7.05 |
|
2 |
59 |
39 |
2 |
7 |
4.26 |
3.19 |
|
3 |
27 |
48 |
14 |
3 |
2.06 |
1.67 |
|
4 |
6 |
43 |
49 |
8 |
1.54 |
1.18 |
|
5 |
54 |
45 |
0 |
13 |
6.8 |
4.23 |
|
6 |
93 |
7 |
0 |
4 |
4 |
4 |
|
7 |
38 |
55 |
8 |
9 |
2.04 |
1.4 |
|
8 |
3 |
68 |
29 |
9 |
3.72 |
2.35 |
Nota. Elaboración del autor con base en la investigación.
Figura 2
Paisajes clasificados según el Índice de Vegetación de Diferencia Normalizada (NDVI) en el Parque Nacional de Palo Verde, Costa Rica
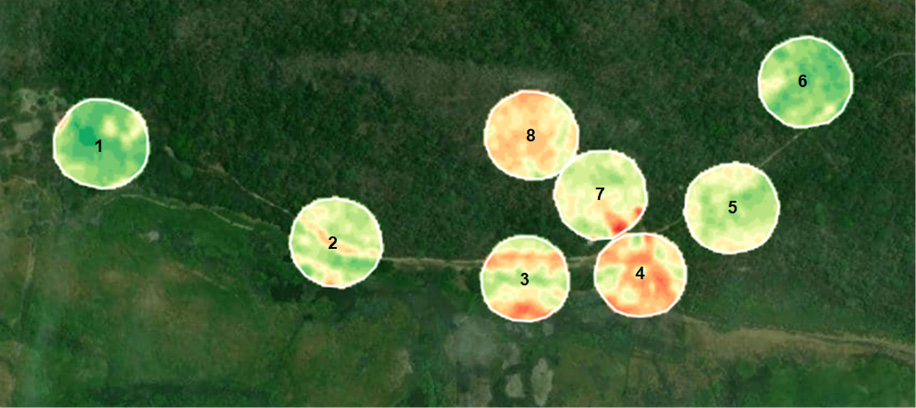
Nota. Elaboración del autor con base en la investigación. Cada número representa un paisaje distinto.
La única categoría de vegetación que explicó la diversidad verdadera de artrópodos fue la vegetación densa, la cual afectó positivamente la diversidad de especies dominantes (D2, ver tabla 3).
Tabla 3
Efecto de las proporciones de cada tipo de clasificación vegetacional presente en todos los paisajes sobre la diversidad taxonómica mediante el Número de Hills de orden 0, 1 y 2
|
% Vegetación densa |
% Vegetación moderada |
% Vegetación escasa |
|
|
D0 |
F = 0.01, P = 0.77 |
F < 0.01, P = 0.99 |
F = 0.11, P = 0.75 |
|
D1 |
F = 4.88, P = 0.07 |
F = 2.58, P = 0.16 |
F = 2.96, P = 0.14 |
|
D2 |
F = 11.16, P = 0.01 |
F = 6.26, P = 0.07 |
F = 3.89, P = 0.10 |
Nota. Elaboración del autor con base en la investigación. Las células internas en negrita indican diferencias estadísticas significativas (P < 0.05).
Con respecto al efecto de los tipos de vegetación en la diversidad beta total, el único que explicó la variación fue la diferencia de la vegetación moderada, cuanto mayor la diferencia entre las vegetaciones moderadas, mayor la diversidad beta entre paisajes (ver tabla 4).
Tabla 4
Efecto de las proporciones de cada tipo de clasificación vegetacional presente en todos los paisajes sobre la diversidad beta total (Sorensen).
|
% Vegetación densa |
% Vegetación moderada |
% Vegetación escasa |
|
|
Diversidad beta total (Sorensen) |
F = 1.72 / P = 0.20 |
F = 10.75 / P < 0.01 |
F = 0.01 / P = 0.91 |
Nota. Elaboración del autor con base en la investigación. Las celdas internas en negrita indican diferencias estadísticas significativas (P < 0.05).
Al descomponer la diversidad beta en sus dos componentes, recambio y anidamiento, el efecto de la diferencia de vegetación moderada, que explicó la diversidad beta entre paisajes, estuvo relacionado solamente con el componente de recambio que, de la misma manera, afectó positivamente la sustitución de especies entre paisajes con mayores diferencias entre vegetación moderada (ver tabla 5).
Tabla 5
Efecto de las proporciones de cada tipo de clasificación de vegetación presente en todos los paisajes sobre los componentes de diversidad beta: recambio y anidamiento (turnover y nestedness)
|
% Vegetación densa |
% Vegetación moderada |
% Vegetación escasa |
|
|
Turnover |
F = 0.46, P = 0.50 |
F = 14.37, P < 0.01 |
F = 0.97, P = 0.34 |
|
Nestedness |
F = 0.03, P = 0.87 |
F = 3.77, P = 0.06 |
F = 1.64, P = 0.21 |
Nota. Elaboración del autor con base en la investigación. células internas en negrita indican diferencias estadísticas (P < ٠,٠٥).
Figura 3
Representación gráfica de la red de interacción especie-hábitat teniendo en cuenta las abundancias de las especies

Nota. Elaboración del autor con base en la investigación. Los rectángulos horizontales representan los paisajes muestreados (en verde, paisajes categorizados por la mayor proporción de vegetación densa, en amarillo, moderada y en rojo, escasa) y especies (en negro). El tamaño de cada rectángulo representa la cantidad de individuos, cuanto mayor el rectángulo, mayor la abundancia de individuos de artrópodos que interactúan con estos paisajes. Las líneas representan las interacciones.
En relación con el análisis de la red de interacciones, los paisajes ‘4’ y ‘7’, clasificados como la mayor proporción de vegetación escasa y moderada, respectivamente, fueron los que presentaron la mayor abundancia de especies; sin embargo, es relativa a solamente una especie (figura 3). En este mismo sentido, el paisaje ‘6’, clasificado como la mayor proporción de vegetación densa, fue el que presentó la menor abundancia de individuos (figura 3). No obstante, considerando la cantidad de interacciones entre especies-hábitat, los paisajes con mayor proporción de vegetación densa fueron los que más presentaron cantidades de interacciones, seguidos de la vegetación moderada y escasa (ver figura 4). En este mismo sentido, en relación con las especies, las que más presentaron interacciones fueron Formicidae_Sp1 que interactuó con el 100% de los paisajes y Coleoptera_Sp5 que interactuó con el 75% de los paisajes (ver figura 4).
Figura 4
Representación gráfica de la red de interacciones especie-hábitat
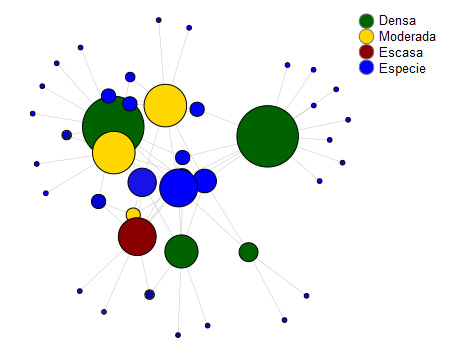
Nota. Elaboración del autor con base en la investigación. Los círculos representan los paisajes muestreados (en verde, paisajes categorizados como densa, en amarillo, moderada y en rojo, escasa) y especies (en azul). El tamaño de cada círculo representa la cantidad de interacciones entre especie-hábitat, cuanto más grande el círculo, mayor la cantidad de interacciones. Las líneas representan las interacciones.
Discusión
Los resultados revelaron que incluso en un bosque primario, los diferentes tipos de vegetación natural pueden actuar como filtro ambiental para la mayoría de las especies de artrópodos que los componen, lo que respalda los resultados de algunos estudios previos que sugieren que la diversidad de especies depende de la composición del paisaje (por ejemplo, en insectos, Solar et al., 2015 y en plantas, Arroyo-Rodríguez et al., 2013). En paisajes con una mayor proporción de vegetación densa, la diversidad de especies igualmente dominantes indica una estabilidad de la comunidad en relación con la dominancia de especies, así como una mayor conectividad de paisajes con mayor proporción de vegetación densa que otros. Mientras que, en paisajes con grandes diferencias de vegetación moderada, se indica un mayor grado de heterogeneidad ambiental que permite una mayor cantidad de nichos ecológicos que pueden ser utilizados por diferentes especies, aumentando la diversidad beta en estos paisajes (Melo et al., 2013; Liu & Slik, 2014).
Los resultados a su vez destacan la importancia de la vegetación densa en los paisajes por promover una alta diversidad de especies igualmente dominantes, en contraste con las vegetaciones escasas que homogeneizan la diversidad de las especies de artrópodos. Además, los resultados revelaron una interesante relación del paisaje como modulador de especies generalistas que están suficientemente adaptadas para interactuar con diversos tipos de paisajes y al mismo tiempo dominarlos con baja cobertura vegetal (por ejemplo, Coleoptera_Sp5 dominante en el paisaje ‘4’ y al mismo tiempo es una de la especie que más interactúa con otros paisajes).
Basados en la hipótesis de diversidad beta (ver Tscharntke et al., 2012), los niveles de diversidad gamma pueden mantenerse si los paisajes tienen un alto nivel de diversidad beta entre localidades. Nuestros resultados al apoyar esta hipótesis, destacan la importancia de la conservación de vegetaciones moderadas que contribuyen positivamente a la diversidad beta y aumentan notablemente las tasas de sustitución de especies entre paisajes. En este sentido, los esfuerzos de conservación deben considerar los patrones de diversidad beta al proponer la delimitación de áreas prioritarias para la conservación de la biodiversidad (Ribeiro et al., 2008; Solar et al., 2015), garantizando la preservación de manchas de este tipo de vegetación a lo largo de todo el gradiente ambiental (Liu & Slik, 2014).
El estudio destaca también la importancia de evaluar diferentes escalas espaciales y diferentes predictores de diversidad. Si se hubiera evaluado la diversidad solo en una escala local, los resultados habrían demostrado solo la homogeneización de la composición de especies en paisajes con menos cobertura forestal. Además, los diferentes patrones encontrados en cada paisaje pueden indicar que se deben utilizar diferentes estrategias de conservación para mantener la diversidad de artrópodos en cada paisaje.
De esta forma, surge la urgencia de que en paisajes donde predomina una baja cobertura boscosa sea necesario preservar la mayor cantidad de parches de bosque posible, y principalmente de vegetación moderada con el fin de promover la diversidad beta, por tanto, también la diversidad gamma y densa con el fin de impulsar la mayor estabilidad de la comunidad en términos de dominancia de especies, además de fomentar una conectividad ecológica óptima entre las comunidades de artrópodos y sus hábitats adyacentes para garantizar la continuidad del flujo de especies y mantener la biodiversidad en la región.
Agradecimientos
Mi más sincero agradecimiento a la Organización para Estudios Tropicales y a los coordinadores del Curso de Ecología Tropical y Conservación 2023. Asimismo, deseo agradecer a los colegas que colaboraron con los esfuerzos de campo y con el material necesario para llevar a cabo el estudio. Del mismo modo, al Parque Nacional Palo Verde por permitirnos trabajar en sus instalaciones.
Referencias
Arroyo-Rodríguez, V., Rös, M., Escobar, F., Melo, F.P.L., Santos, B.A., Tabarelli, M. et al. (2013). Plant b-diversity in fragmented rain forests: testing floristic homogenization and differentiation hypotheses. Journal of Ecology, 6, 1449–1458.
Astudillo, P.X., Grass, I., Siddons, D.C., Schabo, D.G., & Farwig, N. (2020). Centrality in species-habitat networks reveals the importance of habitat quality for high-Andean birds in Polylepis woodlands. Ardeola, 67, 307–324.
Baselga, A. (2010). Partitioning the turnover and nestedness components of beta diversity. Global Ecology and Biogeography, 19(1), 134-143.
Baselga, A., Orme, D., Villeger, S., De Bortoli, J., Leprieur, F., & Logez, M. (2022). Betapart: Partitioning Beta Diversity into Turnover and Nestedness Components. R package version 1.5.6.
Beckett, S. J. (2016). Improved community detection in weighted bipartite networks. R. Soc. Open Science, 3, 140536.
Chase, J.M. & Myers, J.A. (2011). Disentangling the importance of ecological niches from stochastic processes across scales. Philosophical Transactions of the Royal Society B: Biological Sciences, 366, 2351–2363.
Csardi, G., & Nepusz, T. (2006). The igraph software package for complex network research. InterJournal, Complex Systems, 1695.
Dunne, J.A., Williams, R.J., & Martinez, N.D. (2002). Network structure and biodiversity loss in food webs: robustness increases with connectance. Ecology Letters, 5, 558–567.
Forman, R.T.T. (1981). Interactions among landscape elements: a core of landscape ecology. In P. J. Burel & A. G. H. G. (Eds.), Proceedings of the international conference on landscape ecology and management (pp. 35–48). Wageningen, Netherlands: PUDOC.
Girvan, M., & Newman, M. E. (2002). Community structure in social and biological networks. Proceedings of the National Academy of Sciences of the United States of America, 99(12), 7821–7826.
Goeden, G. B. (1979). Biogeographic theory as a management tool. Environmental Conservation, 6, 27-32.
Hartig, F. (2022). DHARMa: Residual Diagnostics for Hierarchical (Multi-Level / Mixed) Regression Models. R package version 0.4.6.
Hartshorn, G. (1983). Plants. In D. Janzen (Ed.), Costa Rican Natural History (pp. 118–157). University of Chicago Press.
Jiménez-Rodríguez, C. D., Esquivel-Vargas, C., Coenders-Gerrits, M., & Sasa Marín, M. (2019). Quantification of the evaporation rates from six types of wetland cover in Palo Verde National Park, Costa Rica. Water, 11(4), 674.
Jost, L. (2006). Entropy and diversity. Oikos, 113(2), 363–375.
Laurance, W. F., Nascimento, H. E. M., Laurance, S. G., Andrade, A., Ewers, R. M., & Harms, K. E. (2007). Habitat fragmentation, variable edge effects, and the landscape-divergence hypothesis. PloS one, 2, e1017.
Liu, J. J., & Slik, J. W. F. (2014). Forest fragment spatial distribution matters for tropical tree conservation. Biological Conservation, 171, 99–106.
Margules, C., & Usher, M. B. (1981). Criteria used in assessing wildlife conservation potential: a review. Biological Conservation, 21, 79–109.
Marini, L., Bartomeus, I., Rader, R., & Lami, F. (2019). Species–habitat networks: A tool to improve landscape management for conservation. Journal of Applied Ecology, 56(4), 923–928.
Melo, F.P.L., Arroyo-Rodríguez, V., Fahrig, L., Martínez-Ramos, M. & Tabarelli, M. (2013). On the hope for biodiversity-friendly tropical landscapes. Trends in Ecology and Evolution, 28, 461–468.
Myneni RB, Hall FG, Sellers PJ, Marshak AL. (1995). The interpretation of spectral vegetation indexes. IEEE Transactions on Geoscience and Remote Sensing, 33, 481–486.
Oksanen, J., Simpson, G., Blanchet, F., Kindt, R., Legendre, P., Minchin, P., & et al. (2022). Vegan: Community Ecology Package. R package version 2.6-4.
Ortiz-Malavassi, E. (2014). Atlas Digital de Costa Rica 2014. Tecnológico de Costa Rica: Cartago, Costa Rica.
Portillo-Quintero, C. A., & Sánchez-Azofeifa, G. A. (2010). Extent and conservation of tropical dry forests in the Americas. Biological Conservation, 143(1), 144–155.
R Core Team. (2022). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. https://www.R-project.org/
Ribeiro, D. B., Prado, P. I., Brown, K. S. Jr., & Freitas, A. V. L. (2008). Additive partitioning of butterfly diversity in a fragmented landscape: Importance of scale and implications for conservation. Diversity and Distributions, 14, 961–968.
Silva, P. G., & Hernández, M. I. M. (2015). Spatial patterns of movement of dung beetle species in a tropical forest suggest a new trap spacing for dung beetle biodiversity studies. Plos One, 10, e0126112.
Solar, R. R. C., Barlow, J., Ferreira, J., Berenguer, E., Lees, A. C., Thomson, J. R., & et al. (2015). How pervasive is biotic homogenization in human-modified tropical forest landscapes? Ecology Letters, 18, 1108–1118.
Thomas, J. W., Maser, C., & Rodiek, J. E. (1979). Edges. In J. W. Thomas (Ed.), Wildlife habitats in managed forests: The blue mountains of Oregon and Washington (pp. 48-59). US For. Serv. Agr. Handbook No. 553. Washington, DC.
Trama, F. A., Rizo-Patrón, F. L., Kumar, A., González, E., Somma, D., & McCoy C., M. B. (2009). Wetland cover types and plant community changes in response to cattail-control activities in the Palo Verde Marsh, Costa Rica. Ecological Restoration, 27, 278–289.
Tscharntke, T., Tylianakis, J. M., Rand, T. A., Didham, R. K., Fahrig, L., Batary, P., et al. (2012). Landscape moderation of biodiversity patterns and processes – eight hypotheses. Biological Reviews, 87, 661–685.
Whittaker, R. H. (1972). Evolution and measurement of species diversity. Taxon, 21, 213–251.
Zuur, A. F., Ieno, E. N., Walker, N. J., Saveliev, A. A., & Smith, G. M. (2009). Mixed effects models and extensions in ecology with R. Highland Statistics Limited.
1 Programa de Pós-Graduação em Ecologia, Instituto Nacional de Pesquisas da Amazônia, Manaus, Brasil. leonardovboas@live.com
ID: https://orcid.org/0000-0002-1191-4014