Análisis de nicho ecológico de Amazona auropalliata (Psittaciformes: Psittacidae) y Quiscalus mexicanus(Passeriformes: Icteridae) en Costa Rica
Ecological Niche Analysis of Amazona auropalliata (Psittaciformes: Psittacidae) and Quiscalus mexicanus (Passeriformes: Icteridae)
in Costa Rica
Jamie Martínez-Urbina1
DOI: 10.22458/rb.v33i2.4537
Recibido – Received: 03/10/2022 / Corregido – Revised: 20/11/2022 / Aceptado – Accepted: 02/12/2022
Se analizaron bases de datos de observaciones humanas de las especies Amazona auropalliata (amazona nuca amarilla) y Quiscalus mexicanus (zanate) en el territorio costarricense, como área de interés, así se conoció el patrón de distribución geográfica y su influencia en el solapamiento de nicho de ambas especies. Se usaron 20 variables bioclimáticas y, mediante el programa RStudio, se conocieron las correlaciones principales entre todas las variables para cada una de las especies del estudio. La especie invasora Quiscalus mexicanus muestra una amplia expansión de distribución geográfica ya que puede adaptarse a zonas de gran perturbación ambiental ocasionada por los seres humanos, tal como la urbanización o las actividades agrícolas, además tolera los cambios climáticos, mientras que la Amazona auropalliata tiene una distribución restringida de acuerdo con su alimentación y anidación. Por tanto, se puede intuir que la especie invasora podría influir en la disminución de las poblaciones de Amazona auropalliata, la cual es encuentra en peligro de extinción de acuerdo con la IUCN (2020).
Palabras clave: aves; distribución; nicho; especie invasora; variables bioclimáticas.
Human observations of the Amazona auropalliata (yellow-naped amazon) and Quiscalus mexicanus (zanate) were analyzed in the Costa Rican territory, the area of interest, where the geographic distribution pattern and its influence on the niche overlap of both species were known. Twenty bioclimatic variables were used, using the RStudio program where the main variable correlations were known for each of the species in this study. The invasive species, being Quiscalus mexicanus, has a wide expansion of geographical distribution since it can adapt to areas of great disturbance caused by human beings such as: urbanization or agricultural activities, it also tolerates climatic changes, while Amazona auropalliata has a restricted distribution according to their feeding and nesting. Consequently, it can be predicted that the invasive species could influence the reduction of the populations of Amazona auropalliata which is in danger of extinction according to IUCN (2020).
Keywords: birds; distribution; niche; invasive species; bioclimatic variables.
Introducción
A nivel global, la familia Psittacidae es un grupo de aves muy popular entre los seres humanos, sin embargo, a pesar de ser conocidas y ofrecer una gran riqueza de especies (pericos, guacamayas, cacatúas y loros) son pocos los estudios sobre ella. Por otro lado, el género Amazona se destaca por presentar tonalidades variadas en todo su plumaje, tonos amarillos, rojos, azules, morados y anaranjados en la cabeza, y rojos, azules y amarillos en las alas. Las especies de Amazona auropalliata comúnmente conocidas como amazona de nuca amarilla (ver figura 1) son originarias de Mesoamérica, ocupan el hábitat de manglares de tierras bajas y bosques secos tropicales desde el sur de México hasta el norte de Costa Rica a lo largo de las costas del Pacífico y el Caribe (BirdLife International, 2017; Forshaw, 1989, Juniper y Parr, 1998).
Figura 1
Amazona auropalliata, comúnmente conocidas como amazona de nuca amarilla
Nota. Foto tomada por kenneth Acuña-Vargas en Corral
de Piedra, Nicoya, 2021.
En Costa Rica, se ha evidenciado que las poblaciones de estas especies han experimentado una disminución de alrededor de 54% en apenas 11 años, ocasionada por las actividades antropogénicas. Entre las más relevantes se encuentran: la caza furtiva para el comercio a nivel nacional e internacional de la especie como mascota; por otra parte, aunque las amazonas de nuca amarilla son tolerantes a la fragmentación del hábitat, existe evidencias de que su pérdida es significativa para su reproducción (Dahlin et al., 2018; Wright y Dahlin, 2018; Wright et al., 2019). Actualmente, se encuentran en la lista roja de especies en peligro de extinción (IUCN, 2020), aunque esta especie estaba en el Apéndice II del CITES (Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres), que incluye las especies que no están necesariamente amenazadas de extinción, pero pueden llegar a estarlo a menos que se controle estrictamente su comercio; fue transferida al Apéndice I del CITES propio de las especies sobre las cuales se cierne el mayor grado de peligro de extinción y se prohíbe el comercio internacional (Rosser et al., 2001).
Por otro lado, Quiscalus mexicanus (ver la figura 2) especie nativa de México, conocidacomúnmente como zanate, zanate mexicano o clarinero, posee un amplio rango de distribución, se expande desde el suroeste de Estados Unidos hasta el noroeste de Venezuela, por lo cual se considera como una especie de ave invasora que se traslada a nuevas áreas a través de matrices de hábitats y podrían ocasionar grandes efectos negativos en las avifaunas locales (MacGregor-Fors et al., 2009).
En Costa Rica, el arribo de Quiscalus mexicanus está estrechamente relacionado con la fragmentación del paisaje ocasionada por las influencias antropogénicas entre las que resaltan actividades urbanas y agrícolas. Se ha evidenciado la colonización de diferentes sitios a lo largo del país; además, la especie se caracteriza por su fácil adaptación a diversos ecosistemas (Gurrola-Hidalgo et al., 2009).
Figura 2
Quiscalus mexicanus conocido comúnmente como zanate

Nota. Foto tomada por Jamie Martínez-Urbina, San José, Costa Rica.
La especie por su adaptación prospera en las urbanizaciones y sufre menos el cambio climático que otras, existen estudios que señalan que el zanate mexicano pareciera haber creado un hábitat estable y que puede reproducirse con menos depredadores (Wehtje, 2003). Actualmente, el Quiscalus mexicanus se encuentra dentro de la categoría de preocupación menor según la lista roja de especies en peligro de extinción (IUCN, 2020).
Los registros de presencia de las especies sirven para delimitar las áreas de distribución. Se emplean distintos métodos en los que los conceptos de la biogeografía son el contexto histórico y espacial de la sistemática (Peterson et al., 2011; Zunino y Zullini, 2003). El estudio tiene como objetivo analizar los nichos ecológicos de las especies Amazona auropalliata y Quiscalus mexicanus con el fin de obtener los patrones de distribución espacial, así como también pronosticar su nivel de solapamiento de nichos y las áreas con mayor influencia de interacción.
Materiales y métodos
Área de estudio y datos de presencia
de especies
El área de estudio fue el territorio costarricense -sitio de interés para la investigación-. Los registros de presencia de cada una de las especies (Amazona auropalliata y Quiscalus mexicanus) se obtuvieron de la página de GBIF (Global Biodiversity Information Facility, 2020). Los registros fueron georreferenciados, se incluyeron las coordenadas geográficas y fueron filtrados a partir de observaciones humanas.
Datos climáticos
Para modelar las distribuciones de Amazona auropalliata y de Quiscalus mexicanus, se utilizaron 19 variables bioclimáticas obtenidas de Worldclim versión 2.0 con una resolución espacial de 30 segundos -1km2- y la variable de elevación con una resolución espacial de 30 segundos -1km2- (Fick y Hijmans, 2017).
Las 19 variables bioclimáticas descargadas fueron: BIO1 = Temperatura media anual;
BIO2 = Rango medio diurno; BIO3 = Isotérmica; BIO4 = Estacionalidad de temperatura;
BIO5 = Temperatura máxima del mes más cálido; BIO6 = Temperatura mínima del mes más frío; BIO7 = Rango Anual de Temperatura (BIO5-BIO6); BIO8 = Temperatura media del trimestre más húmedo; BIO9 = Temperatura media del trimestre más seco; BIO10 = Temperatura media del trimestre más cálido; BIO11 = Temperatura media del trimestre más frío; BIO12 = Precipitación anual;
BIO13 = Precipitación del mes más húmedo; BIO14 = Precipitación del mes más seco; BIO15 = Estacionalidad de la precipitación; BIO16 = Precipitación del trimestre más húmedo; BIO17 = Precipitación del trimestre más seco; BIO18 = Precipitación del trimestre más cálido; BIO19 = Precipitación del trimestre más frío (Fick y Hijmans,2017).
Programa RStudio
Se utilizó el programa RStudio, versión 1.3.1073, y se usó NTBOX, un paquete en R, donde tiene una función diseñada para una tarea específica (Rstudio Team, 2020). Para la realización de limpieza de datos se usó GBIF con un umbral de distancia de 0,01 grados de Amazona auropalliata y Quiscalus mexicanus (Osorio-Olvera et al., 2020). Además, se empleó el paquete USDM para el análisis del factor de inflación de varianza (VIF) el cual permite calcular las correlaciones entre todas las variables para conocer su grado de influencia general para cada una de las especies de interés.
Programa PAST
Se utilizó el programa estadístico PAST (Paleontological Stadistics) versión 4.0 (Hammer et al., 2001) para obtener los gráficos de comparación de nichos de las especies con 95% de las elipses, que son dos ejes perpendiculares desiguales (Tinoco, 2013), y así poder analizar los componentes PCA (análisis de componentes principales) de todas las variables bioclimáticas.
Análisis de nicho y distribución geográfica
Se empleó el programa de QGIS versión 3,14 (Quantum Geografic Information System, 2016) para el desarrollo de los mapas de distribución geográfica de las especies, utilizando los puntos filtrados de GBIF (Global Biodiversity Information Facility) que fueron analizados en el programa RStudio. Así como también los mapas de distribución geográfica de las especies, adquiridos de IUCN (International Union for Conservation of Nature), además de los mapas de modelamiento de nicho conforme con los resultados que se obtuvieron en Maxent.
Programa Maxent
Se utilizó este programa para la elaboración de modelos de distribución geográfica de Amazona auropalliata y Quiscalus mexicanus, mediante el uso de las variables correlacionadas analizadas en el programa Rstudio (25% de error); lo anterior para encontrar la probabilidad de distribución de una de las especies mediante la probabilidad de distribución de máxima entropía (Phillips et al., 2006).
Resultados
Se inició el estudio con una base de datos compuesta por 6882 observaciones humanas de Amazona auropalliata, y 88 402 observaciones humanas de Quiscalus mexicanus en Costa Rica, obtenidas de GBIF (Global Biodiversity Information Facility). De acuerdo con la limpieza de los datos de ambas especies, realizada mediante el programa RStudio con el paquete NTBOX, se obtuvieron 627 puntos de observación para Amazona auropalliata y 3813 para Quiscalus mexicanus; mediante estos puntos de observación filtrados para cada especie se confeccionaron los gráficos y los mapas.
En las figuras 3 y 4 se pueden notar las distribuciones geográficas según GBIF y IUCN de Amazona auropalliata y Quiscalus mexicanus, respectivamente. Además, se observa el modelo de distribución generado en Maxent, en la figura 5 resalta la idoneidad de hábitat, donde el color azul con 1,80912e-07 significa que es la mínima probabilidad de observación, en cambio el color rojo con 0,789948 representa la mayor probabilidad de observación de Amazona auropalliata. Por otra parte, en la figura 6, resalta la idoneidad de hábitat donde el color azul con 4,5664e-06 significa que es la mínima probabilidad de observación, en cambio el color rojo con 0,749941 representa la mayor probabilidad de observación de Quiscalus mexicanus.
Figura 3
Mapa de distribución geográfica Amazona auropalliata según los puntos GBIF y IUCN
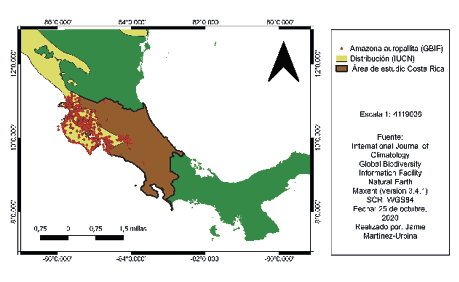
Nota. Elaborado por Jamie Martínez-Urbina.
Figura 4
Mapa de distribución geográfica de Quiscalus mexicanus según los puntos de GBIF y IUCN
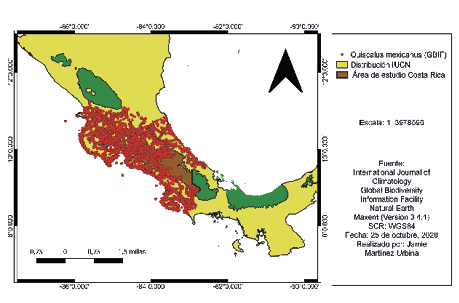
Nota. Elaborado por Jamie Martínez-Urbina.
Figura 5
Modelo de distribución geográfica generado en Maxent de Amazona auropalliata
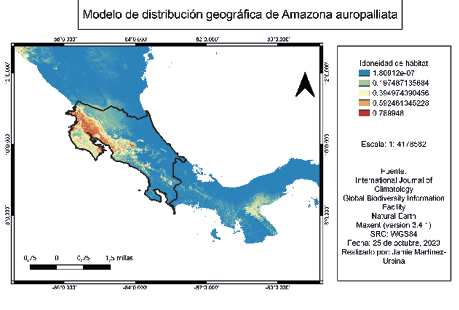
Nota. Elaborado por Jamie Martínez-Urbina.
Figura 6
Mapa de distribución geográfica generado en Maxent de Quiscalus mexicanus
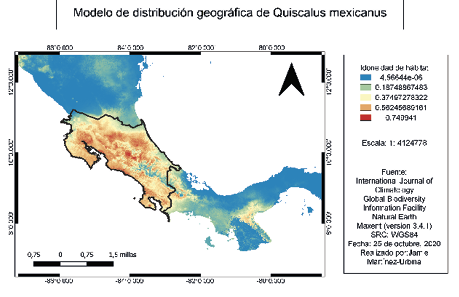
Nota. Elaborado por Jamie Martínez-Urbina.
En la figura 7 se puede observar el gráfico de las variables bioclimáticas de Amazona auropalliata producidas por Maxent, siendo las más importantes BIO7, BIO18, BIO19, BIO15, BIO12, BIO14, BIO9, BIO13, BIO3 y BIO4, respectivamente. Las variables citadas, ejecutadas en el programa RStudio por el paquete USDM, presentan alto grado de influencia general entre todas las variables correlacionadas.
Figura 7
Gráfico de las variables bioclimáticas de Amazona auropalliata
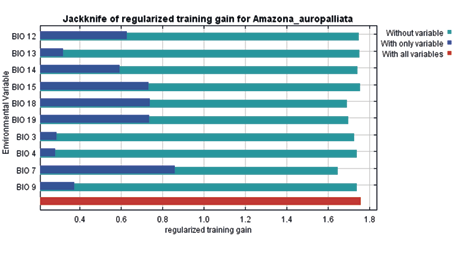
Nota. Elaborado por Jamie Martínez-Urbina.
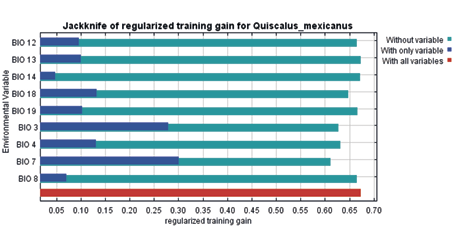
En la figura 8, se puede observar el gráfico de las variables bioclimáticas de Quiscalus mexicanus producidas por Maxent siendo las más importantes BIO7, BIO3, BIO18, BIO4, BIO19, BIO13, BIO12, BIO8 y BIO14, respectivamente. Las variables poseen alto grado de influencia general entre todas las variables correlacionada; las variables también fueron ejecutadas en el programa RStudio mediante el paquete USDM.
Figura 8
Gráfico de las variables bioclimáticas de Quiscalus mexicanus
Nota. Elaborado por Jamie Martínez-Urbina.
En las figuras 9 y 10 se advierte el solapamiento de nicho según el PCA (análisis de componentes principales) el cual es significativo, la especie invasora Quiscalus mexicanus representada en color rojo ocupa la mayoría del nicho de la especie nativa que sería Amazona auropalliata representada en color azul. Y en la figura 11 se observa el mapa de solapamiento de ambas especies dentro del área de estudio.
Figura 9
Compartimiento de nicho entre especies según los PCA
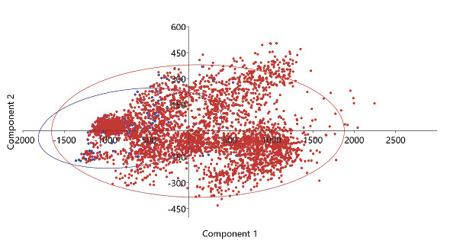
Nota. Elaborado por Jamie Martínez-Urbina.
Figura 10
Gráfico de solapamiento de nicho de las especies según los PCA 1, 2 y 3
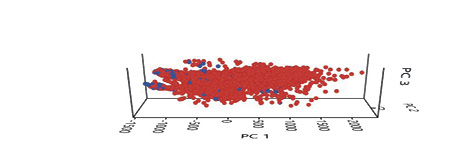
Nota. Elaborado por Jamie Martínez-Urbina.
Figura 11
Mapa de solapamiento de Amazona auropalliata y Quiscalus mexicanus
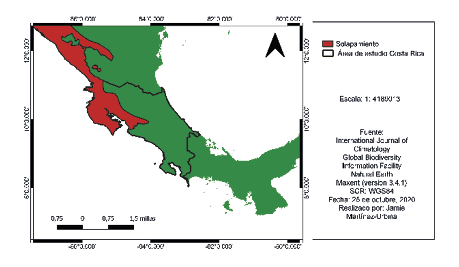
Nota. Elaborado por Jamie Martínez-Urbina.
Discusión
En general, los psitácidos se encuentran asociados a áreas dominadas por bosques ya que buscan los recursos necesarios para su crecimiento como la alimentación y el anidamiento (Morales-Pérez, 2005, Monterrubio-Rico y Escalante-Pliego, 2006). De acuerdo con los datos obtenidos de GBIF, se puede observar que la mayor distribución de Amazona auropalliata se encuentra en la vertiente del Pacífico, en cambio Quiscalus mexicanus -siendo la especie invasora-, según los puntos obtenidos por GBIF, se encuentra con un amplio rango de distribución, lo anterior debido a que prospera en áreas residenciales y paisajes agrícolas, ya que se adapta a los recursos de la zona (Haeming, 2014).
Wehtje (2003) considera que Quiscalus mexicanus al ser de origen tropical tolera temperaturas cálidas, en cambio restringe la expansión de su área de distribución en las bajas temperaturas; aunque hay que considerar que debido al cambio climático ha podido sobrevivir en zonas donde no se acoplaba anteriormente. Por lo que la reciente modificación en su distribución ha influido en su invasión o colonización de diversas áreas (Sánchez-González, 2013).
En cambio, Amazona auropalliata se encuentra en una zona específica del territorio costarricense cuyo hábitat es el bosque seco tropical (Forshaw, 2006), por tanto, su población varía ampliamente entre los 10 000 y 50 000 individuos, lo cual genera incertidumbre, además las poblaciones de esta especie cada vez se van reduciendo por diferentes actividades tanto antropogénica como por las especies invasoras en zonas locales (Birdlife International, 2016a, 2016b, 2017; Marin-Togo et al., 2012), ejemplo de ello Quiscalus mexicanus, especie que se encuentra dentro del hábitat de Amazona auropalliata como se pudo observar en la figura 9, 10 y 11.
En cuanto a las variables bioclimáticas que afectan, se nota que la más influyente es la BIO7 (rango anual de temperatura), la cual representa la estacionalidad, que se estima con la BIO5 y BIO6 (la temperatura máxima del mes más cálido y temperatura mínima del mes más frío respectivamente), estás variables se derivan de valores mensuales de temperatura y lluvia (Fick y Hijmans, 2017).
Conclusiones
Mediante el estudio se puede observar que la especie invasora Quiscalus mexicanus muestra una gran expansión con respecto a su distribución geográfica en el territorio costarricense, además de poseer un alto nivel de tolerancia de acuerdo con la temperatura, la cual podría potencialmente influir en las poblaciones de Amazona auropalliata. Asimismo, en ambas especies la variable bioclimática con mayor predominancia es la BIO 7 la cual puede considerarse para futuras investigaciones.
Se recomienda realizar estudios con más variables ambientales en las que se pueda observar el gran nivel de competencia entre ambas especies, además de ampliar el área de estudio para obtener más evidencias de las especies de interés. Al no existir variedad de investigaciones sobre Amazona auropalliata y Quiscalus mexicanus en relación con los nichos ecológicos, el estudio puede sumar datos a una problemática de gran relevancia en cuanto a la protección de especies.
Referencias
BirdLife International (2016a). The IUCN Red List of Threatened Species. Version 2016.3. https://www.iucnredlist.org
BirdLife International (2016b). Amazona auropalliata. The IUCN Red List of Threatened Species 2016. https://www.iucnredlist.org/search?query=birds&searchType=species
BirdLife International. (2017). Amazona auropalliata. The IUCN Red List of Threatened Species 2017. https://www.iucnredlist.org/search?query=birds&searchType=species
Dahlin, C.R., Blake, C., Rising, J. Wright, T. F. (2018). Long-term Monitoring of Yellow-naped Amazons (Amazona auropalliata) in Costa Rica: Breeding Biology, Duetting, and the Negative Impact of Poaching. J. The Journal of Field Ornithology, 89, 1–10.
Fick, S., y Hijmans, R. (2017). WorldClim 2: new 1km Spatial Resolution Climate Surfaces for Global Land Areas. International Journal of Climatology, 37 (12): 4302-4315.
Forshaw, J.M. (1989). Parrots of the World. Third (revised) ed., Lansdowne Edition, Melbourne, Australia.
Forshaw, J.M. (2006). Parrots of the World: Identification Guide. Princeton: Princeton University Press.
GBIF.org (2020). Global Biodiversity Information Facility. https://www.gbif.org/es/
Gurrola-Hidalgo, M.A., C. Sánchez-Hernández y M.L. Romero-Almaraz. (2009). Dos nuevos registros de alimentación de Quiscalus mexicanus y Cyanocorax sanblasianus en la costa de Chamela, Jalisco, México. Act. Zool. Mex., 25(2): 427- 430.
Haemig, P. D. (2014). Introduction of the Great-Tailed Grackle by Aztec Emperor Auitzotl: Four-stage analysis with new information. The Auk, 58, 387–397.
Hammer, Ø., Harper, D. y Ryan, P. (2001). PAST: Paleontological Statistics Software Package for Education and Data Analysis. Paleontología Electronical 4(1): 9pp.
IUCN. (2020). The IUCN Red List of Threatened Species. Version 2019-3. https://www.iucnredlist.org
Juniper, T y Parr, M (1998). Parrots: a guide to the parrots of the world. Yale University Press, New Haven, Connecticut, 584 p.
MacGregor-Fors, I. L., Vázquez, J. Vega-Rivera, J. Schondube. (2009). Non-exotic Invasion of Great-tailed Grackles Quiscalus mexicanus in a tropical dry forest reserve. ARDEA, 97(3): 367-369.
Marin-Togo, M. C., Monterrubio-Rico, T. C., Renton, K., Rubio-Rocha, Y., Macias-Caballero, C., Ortega-Rodriguez, J. M. and Cancino-Murillo, R. (2012) Reduced current distribution of Psittacidae on the Mexican Pacific coast: potential Impacts of Habitat Loss and Capture for Trade. Biodiversity and Conservation, 21: 451–473.
Monterrubio-Rico, T. C., y Escalante-Pliego, P. (2006). Richness, Distribution and Conservation Status of Cavity Nesting Birds in Mexico. Biological Conservation, 128: 67–78.
Morales-Pérez, L. (2005). Evaluación de la abundancia poblacional y recursos alimenticios para tres géneros de psitácidos en hábitats conservados y perturbados de la costa de Jalisco, México. Tesis de maestría, Posgrado en Ciencias Biológicas, Universidad Nacional Autónoma de México, México, D.F.
Osorio-Olvera, L., Lira-Noriega, A., Soberón, J., Peterson, A., Falconi, M., Contreras-Días, R., Martínez-Meyer, E., Barve, V. y Barve, N. (2020). Ntbox: un paquete R con interfaz gráfica de usuario para modelar y evaluar nichos ecológicos multidimensionales. Métodos Ecol. Evol. Manuscrito de autor aceptado. DOI: 10.1111 / 2041-210X.13452.
Peterson, A. T., Soberón, J., Pearson, R. G., Anderson, R. P., Martínez-Meyer, E., Nakamura, M. (2011). Ecological Niches and Geographic Distributions. Princeton, NJ: Princeton University Press.
Phillips, S., Anderson, R., y Schapire, R. (2006). Maximum Entropy Modeling of Species Geographic Distributions. Ecological Modelling 190(3-4): 231-259. DOI: https://doi. org/10.1016/j.ecolmodel.2005.03.026
Quantum GIS Development Team (QGIS). (2016). Quantum GIS Geographic Information System. Open-Source Geospatial Foundation Project. https://www.qgis.org/es/site/
RStudio Team (2020). RStudio: Integrated Development for R. RStudio, PBC, Boston, MA URL http://www.rstudio.com/
Rosser, A., Haywood M. y Harris D. (2001). Guía para enmendar los apéndices de la convención sobre el comercio internacional de especies amenazadas de fauna y flora silvestres. Sétima edición. The Rufford Foundation.
Sánchez-González, L. A. (2013). Cuando un “nuevo registro” es realmente un nuevo registro: consideraciones para su publicación. Huitzil, 14, 17–21.
Tinoco, G. (2013). Elementos y ecuación de la elipse. México UAEM.
Wehtje, W. (2003). The range expansion of the Great-tailed Grackle (Quiscalus mexicanus Gmelin) in North America since 1880. Journal of Biogeography, 30, 1593–1607.
Wright, T.F. y Dahlin, C.R. (2018). Vocal dialects in parrots: Patterns and processes of cultural evolution. Emu 118, 50–66.
Wright, T.F., Lewis, T.C., Lezama-Lopez, M., Smith-Vidaurre, G., Dahlin, C.R. (2019). Yellow-naped Amazon Amazona auropalliata Populations are Markedly Low and Rapidly Declining in Costa Rica and Nicaragua. Bird Conservation International. 29, 291–307.
Zunino, M. y Zullini, A. (2003). Biogeografía, la dimensión espacial de la evolución. México D.F.: Fondo de Cultura Económica.
1 Escuela de Ciencias Biológicas, Universidad Latina de Costa Rica, San Pedro de Montes de Oca, San José, Costa Rica.
jjamie2137@gmail.com